金黄色葡萄球菌腺苷酰转移酶耐药基因的克隆及其原核表达*
2016-11-03陈洪升陈吟霜谢永强张咏莉周珍文
陈洪升,周 帅,陈吟霜,谢永强,张咏莉,周珍文△
(1.广东药学院,广州 510224;2.广东省广州市妇女儿童医疗中心 510000)
·论著·
金黄色葡萄球菌腺苷酰转移酶耐药基因的克隆及其原核表达*
陈洪升1,周帅2,陈吟霜2,谢永强2,张咏莉1,周珍文2△
(1.广东药学院,广州 510224;2.广东省广州市妇女儿童医疗中心510000)
目的在大肠杆菌中克隆表达金黄色葡萄球菌氨基糖苷类耐药基因,即腺苷酰转移酶基因,为其功能研究奠定基础。方法按金黄色葡萄球菌腺苷酰转移酶蛋白编码序列设计引物,以金黄色葡萄球菌基因组DNA为模板,扩增腺苷酰转移酶基因,所得片段与pGEX-4t-1(+)载体连接,转化至感受态大肠杆菌BL21(DE3),提取质粒进行双酶切及测序鉴定,IPTG诱导重组蛋白表达,SDS-PAGE及Western-blot对重组蛋白作鉴定。结果使用金黄色葡萄球菌基因组为模板,成功扩增约800 bp目的片段,重组质粒双酶切见目的片段,测序显示腺苷酰转移酶基因长783 bp,始于ATG,止于TAG,预测的等电点和相对分子质量分别为7.75和29×103,目的基因与Genbank腺苷酰转移酶同源性为99%,SDS-PAGE及Western-blot显示在55×103见重组蛋白表达。结论在大肠杆菌中成功克隆表达了金黄色葡萄球菌腺苷酰转移酶基因。
金黄色葡萄球菌;腺苷酰转移酶;耐药基因
金黄色葡萄球菌是机体化脓感染中最常见的病原菌,随着氨基糖苷类药物的广泛应用,耐药性日益严重。腺苷酰转移酶是一种跨膜多重药物外排蛋白,介导葡萄球菌对氨基糖苷类药物及多种结构上近似甚至无关的药物耐药[1-2]。本研究对腺苷酰转移酶基因进行克隆及原核表达,为其功能研究奠定基础。
1 材料与方法
1.1一般材料金黄色葡萄球菌菌株(111123035)分离自广州市妇女儿童医疗中心内科病区,11岁儿童患者的全身多发软组织感染脓液。
1.2仪器与试剂上海力申公司HF safe-1200型生物安全柜,德国Biometra公司PCR,英国Uvitec公司GAS7508-T20紫外凝胶成像分析系统,德国Sorvall公司micro 17R台式高速冷冻离心机。pGEX-4t-1质粒载体购自法国马来亚公司;质粒提取试剂盒、DNA纯化试剂盒、rTaq DNA聚合酶、EcoR Ⅰ和Xhol Ⅰ限制性内切酶、T4 DNA连接酶DNA marker等购自Takara公司。IPTG、丙烯酰胺、Tris碱、预染蛋白Marker和DAB显色剂等购自鼎国生物公司。鼠抗GST标签单克隆抗体购自北京康为世纪生物有限公司。
1.3方法
1.3.1最低抑菌浓度(MIC)按照美国临床和实验室标准化协会2012年发布的《抗微生物药物敏感试验的执行标准》,采用琼脂2倍稀释法进行MIC检测。
1.3.2腺苷酰转移酶基因PCR扩增根据GenBank金黄色葡萄球菌腺苷酰转移酶基因序列(CP002120.1),设计特异性引物1对。P1:5′-CGC GAA TTC ATG AGC AAT TTG ATT AAC GG-3′,P2:5′-CGC CTC GAG CTA ATT GAG AGA AGT TTC TA-3′。引物序列分别加入EcoR Ⅰ、Xhol Ⅰ酶切位点。挑取金黄色葡萄球菌单菌落于50 μL 水中,煮沸15 min,12 000r/min离心1 min,取上清液作为PCR模板。PCR反应条件:94 ℃热变性5 min后,94 ℃变性45 s,53 ℃退火45 s,72 ℃延伸1 min,共34个循环,最后72 ℃延伸15 min。
1.3.3腺苷酰转移酶基因克隆至pGEX-4t-1表达载体腺苷酰转移酶基因 PCR产物纯化后,经EcoRⅠ、XholⅠ酶切纯化后,与相同酶切的pGEX-4t-1质粒连接,转化至大肠杆菌BL21。挑取经氨苄霉素筛选的阳性菌落提取质粒进行PCR及双酶切鉴定。
1.3.4腺苷酰转移酶基因在大肠杆菌BL21/DE3的诱导表达将含有重组质粒的BL21/DE3工程菌接种至含氨苄霉素(50 μg/mL)的LB琼脂板,培养过夜后挑单菌落于LB液体培养基中(含氨苄霉素50 μg/mL),37 ℃培养至OD值0.4左右,加IPTG至终浓度1 mmol/L 30 ℃诱导表达6 h,8 000 r/min 4 ℃离心20 min,收集菌体,SDS-PAGE电泳鉴定。
1.3.5重组蛋白Western-blot分析重组蛋白表达产物经12% SDS-PAGE后转移至PVDF膜,使用HRP标记的GST标签鼠单克隆抗体(1∶1 000稀释),DAB显色液显色。
2 结 果
2.1氨基糖苷类抗菌药物的MIC金黄色葡萄球菌菌株(111123035)对庆大霉素、阿米卡星的MIC分别为18、16 μg/mL。均为耐药。头孢西丁MIC值为18 μg/mL,该菌株为耐甲氧西林金黄色葡萄球菌菌株。
2.2腺苷酰转移酶基因的PCR扩增以111123035菌株基因组DNA为模板,PCR扩增产物进行1%琼脂糖凝胶电泳,在800~1 000 bp间见明显特异性条带,与目的基因(783 bp)大小相似。见图1。

图1 腺苷酰转移酶基因的PCR扩增
2.3重组质粒的鉴定从转化的大肠杆菌BL21提取的重组质粒,经EcoRⅠ和XholⅠ酶切后见目的条带。见图2。测序显示腺苷酰转移酶基因长783 bp,启始于ATG,终止于TAG,预测的等电点为7.75,相对分子质量约为29×103,与GenBank中编号为NC_017341.1的基因同源性为99%。氨基酸比对结果显示仅见第49位氨基酸D改变为Y。
2.4SDS-PEGE电泳及Western-blot0.5 mmol 的IPTG诱导8 h后,重组菌体经SDS-PEGE电泳后,在55×103可见明显表达带,这与融合重组蛋白的理论相对分子质量相符(26×103GST+29×103adenylyltransferase)。见图3。
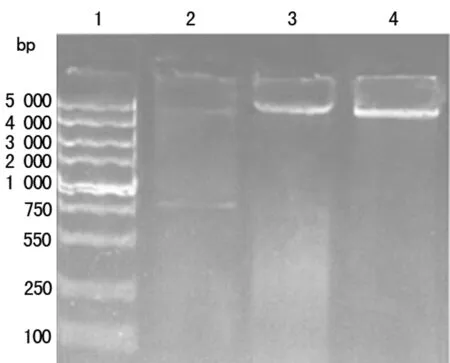
注:1表示DNA 标记;2表示重组质粒双酶消化;3表示重组质粒;4表示双亲 pGEX-4T-1(+)重组。
图2重组质粒双酶切鉴定电泳图

注:1表示蛋白质标记;2表示pEGX-4T-1(+)/BL21(DE3) 诱导IPTG;3表示质粒pEGX-4T-1(+)-腺苷酰转移酶/BL21(DE3) 诱导 IPTG;4表示质粒 pEGX-4T-1(+)-腺苷酰转移酶/BL21(DE3)无IPTG诱导。
图3重组腺苷酰转移酶12% SDS-PAGE电泳图
2.5重组腺苷酰转移酶 Western-blot分析鉴定使用鼠抗GST标签单克隆抗体进行Western-blot,结果显示在55×103左右见目的蛋白。见图4。

注:1表示蛋白质标记;2表示质粒pEGX-4T-1(+)-腺苷酰转移酶/BL21诱导。
图4重组蛋白表达产物Western-blot检测
3 讨 论
本研究从患者全身多发软组织感染脓液标本分离出1株高耐药菌株(111123035),为耐甲氧西林金黄色葡萄球菌,对庆大霉素、阿米卡星的MIC分别为18、16 μg/mL,结果表明对氨基糖苷类药物高度耐药。对氨基糖苷抗菌药物耐药是因细菌产生氨基糖苷类双功能修饰酶(AA C(6′)- APH(2")钝化酶所致[3-5]。该种耐药性的决定因子为PSK-1样质粒[4]。Jordens 等研究报道金黄色葡萄球菌对庆大霉素的耐药性并非质粒携带,而是染色体携带。
有学者在大肠杆菌、酵母菌等进行了腺苷酰转移酶耐药基因的分离及鉴定,结果显示腺苷酰转移酶基因序列和蛋白相对分子质量与报道相符[6-7]。本研究首次对金黄色葡萄球菌腺苷酰转移酶耐药基因进行克隆表达,从基因组扩增出的腺苷酰转移酶目的片段经双酶切与质粒载体pGEX-4T-1(+)成功重组,测序结果表明目的基因片段与GenBank中金黄色葡萄球菌菌株腺苷酰转移酶基因的一致性高达99.9%,仅第145位T碱基突变成G和第274位G碱基突变成A,说明该基因具有高度保守性。
构建表达系统时选择了pGEX表达系统,该系统是目前广泛使用的一种融合蛋白表达系统,可用于表达和纯化,作为免疫原和生物、生化制剂的多肽,或构建cDNA表达文库[8-10]。GST标签体系具有蛋白表达产率高、表达产物纯化方便,以及有利于GST抗体制备等特点。GST融合蛋白可溶于水溶液,可从细菌裂解液中提取,在不变性的条件下通过亲和层析得到。GST融合蛋白可被位点特异性蛋白酶裂解,从而除去GST蛋白。融合蛋白又是一个良好的强免疫原,因此很容易制备抗新蛋白的抗体[11-12]。本组实验结果显示,在IPTG的诱导下,重组表达质粒表达出约55×103的融合蛋白,其中腺苷酰转移酶蛋白约为29×103,与由核苷酸序列推导的蛋白质相对分子质量大小相符。
本研究成功对染色体介导的氨基糖苷耐药基因腺苷酰转移酶进行了克隆和原核表达,获得腺苷酰转移酶蛋白,为进一步进行腺苷酰转移酶蛋白高级结构测定做好了准备,为了解腺苷酰转移酶蛋白的特性和功能及其对细菌耐药机制的深入研究奠定了基础[13-14]。
[1]Borgundvaag B,Ng W,Rowe B,et al.Prevalence of methicillin-resistant Staphylococcus aureus in skin and soft tissue infections in patients presenting to Canadian emergency departments[J].CJEM,2013,15(3):141-160.
[2]Hanessian S,Giguère A,Grzyb J,et al.Toward overcoming staphylococcus aureus aminoglycoside resistance mechanisms with a functionally designed neomycin analogue[J].ACS Med Chem Lett,2011,2(12):924-928.
[3]Woegerbauer M,Zeinzinger J,Springer B,et al.Prevalence of the aminoglycoside phosphotransferase genes aph(3′)-Ⅲa and aph(3′)-Ⅱa in Escherichia coli,Enterococcus faecalis,Enterococcus faecium,Pseudomonas aeruginosa,Salmonella enterica subsp.Enterica and Staphylococcus aureus isolates in Austria[J].J Med Microbiol,2014,63(Pt 2):210-217.
[4]Emaneini M,Bigverdi R,Kalantar D,et al.Distribution of genes encoding tetracycline resistance and aminoglycoside modifying enzymes in Staphylococcus aureus strains isolated from a burn center[J].Ann Burns Fire Disasters,2013,26(2):76-80.
[5]Hanessian S,Giguère A,Grzyb J,et al.Toward overcoming staphylococcus aureus aminoglycoside resistance mechanisms with a functionally designed neomycin analogue[J].ACS Med Chem Lett,2011,2(12):924-928.
[6]Gou D,Liang L,Liu R,et al.Effect of overexpression of nicotinic acid mononucleotide adenylyltransferase on succinic acid production in Escherichia coli NZN111[J].Sheng Wu Gong Cheng Xue Bao,2012,28(9):1059-1069.
[7]Emanuelli M,Carnevali F,Lorenzi M,et al.Identification and characterization of YLR328W,the Saccharomyces cerevisiae structural gene encoding NMN adenylyltransferase.Expression and characterization of the recombinant enzyme[J].FEBS Lett,1999,455(1/2):13-17.
[8]Guo JX,Wei HS,Song YJ,et al.Cloning and expressing of golgi protein73 gene fragment and preparation of monoclonal antibodies against the recombinant protein[J].Zhonghua Shi Yan He Lin Chuang Bing Du Xue Za Zhi,2013,27(4):301-303.
[9]Wang J,Li N,Shen Q,et al.Expression and identification of recombinant Staphylococcus aureus enterotoxin A[J].Wei Sheng Yan Jiu,2013,42(6):920-924.
[10]Li RH,Hao HX,Wang HL,et al.Cloning and expression of actin gene of Toxoplasma gondii[J].Zhongguo Ji Sheng Chong Xue Yu Ji Sheng Chong Bing Za Zhi,2013,31(5):352-355.
[11]Huang X,Liu G,Hu X,et al.Expression and activity determination of recombinant capsid protein VP2 gene of enterovirus type 71[J].Zhonghua Yu Fang Yi Xue Za Zhi,2014,48(4):324-327.
[12]Liu Q,Xu XN,Zhou Y,et al.Molecular cloning and characterization of a novel Clonorchis sinensis antigenic protein containing tandem repeat sequences[J].Zhongguo Ji Sheng Chong Xue Yu Ji Sheng Chong Bing Za Zhi,2013,31(4):245-250.
[13]Gao JS,Wu W,Hou HL,et al.Cloning and prokaryotic expression of casein kinase Ⅱ subunit beta gene fragment of Dirofilaria immitis[J].Zhongguo Ji Sheng Chong Xue Yu Ji Sheng Chong Bing Za Zhi,2013,31(4):290-292.
[14]Wu G,Wang G,Ji J,et al.Cloning of a cytosolic ascorbate peroxidase gene from Lycium chinense Mill.and enhanced salt tolerance by overexpressing in tobacco[J].Gene,2014,543(1):85-92.
Clone and prokaryotic expression of staphylococcus aureus drug resistance adenylyltransferase gene*
CHENHongsheng1,ZHOUShuai2,CHENYinshuang2,XIEYongqiang2,ZHANGYongli1,ZHOUZhenwen2△
(1.GuangdongCollegeofPharmacy,Guangzhou,Guangdong510224,China;2.GuangzhouWomenandChildren′sMedicalCenter,Guangzhou,Guangdong510000,China)
ObjectiveTo clone and express Staphylococcus aureus drug resistance adenylyltransferase gene in E.coli BL21,and to make the foundation for its function research.MethodsPrimers were designed on the basis of adenylyltransferase gene in genbank,PCR was used to amplify adenylyltransferase gene using Staphylococcus aureus genomic DNA as template.The obtained PCR production was attatched with pGEX-4t-1(+) plasmid,and transformed into E.coli BL21 (DE3).The recombinant plasmid was digested by double enzyme digestion and identified by gene sequence.The recombinant protein was induced to expression by IPTG and identified by Western-blotting.ResultsUsing Staphylococcus aureus genome as a template,the target fragment about 800 bp was successful amplified.After enzyme-cutting and DNA-sequencing,the target fragment showed that the ORF begin with ATG,end with TAG,783 bp in length,the predicted isoelectric point and molecular weight were 7.75 and 29×103,and it was homology 99% homology with the reported sequence gene in genbank.SDS-PAGE and Western-blot showed the molecular weight of recombinant fusion protein was about 55×103.ConclusionAdenylyltransferase gene of Staphylococcus aureus was successfully cloned and expressed in E.coli as a fusion protein,which makes the foundation for the research of its function.
Staphylococcus aureus;adenosine acyl transferase;drug resistance gene
广州市医药科技项目(20131A011053)。
陈洪升,男,在读硕士,主要从事病原生物学研究。
,E-mail:861636726@qq.com。
10.3969/j.issn.1673-4130.2016.19.003
A
1673-4130(2016)19-2667-03
2016-02-22
2016-04-17)
