自制大容量扣式负压抽提装置应用于RNA抽提的性能评价*
2016-11-03庄健海卓雪芽郑文标
庄健海,何 娴,卓雪芽,郑文标
(广东省佛山市中医院检验科 528000)
·论著·
自制大容量扣式负压抽提装置应用于RNA抽提的性能评价*
庄健海,何娴,卓雪芽,郑文标
(广东省佛山市中医院检验科528000)
目的对自制大容量扣式负压抽提装置进行扩增前性能评价。方法采用配套负压抽提装置(对照组装置)和自制大容量扣式负压抽提装置(实验组装置)对67份白细胞(WBC)大于2.0×109/L的新鲜全血进行核酸(RNA)提取并进行扩增前性能评价,验证实验组的工作效率、提取RNA的浓度、纯度及完整性。结果67份RNA标本采用对照组装置69 min完成抽提,处理效率平均为0.97份/分;实验组装置41 min完成抽提,效率为1.63份/分。对照组抽提标本RNA浓度为(248.8±21.4)μg/mL,实验组为(260.3±21.8)μg/mL。对照组抽提标本OD260/OD280和OD260/OD230分别为(1.995±0.095)和(2.020±0.082),95%CI分别为1.964~2.025和2.001~2.040,实验组分别为(2.093±0.092)和(2.071±0.120),95%CI分别为2.075~2.113和2.044~2.103;2组比较差异有统计学意义(t=24.570,P<0.001),线性回归方程Y=0.950X+0.039,R2=0.903。2组装置提取RNA后完整性均较好,电泳条带整齐、清晰。结论自制大容量扣式负压抽提装置具有更高的抽提工作效率,且能保证RNA浓度、纯度及完整性,更符合实验室实际情况,具有更优的临床价值。
负压抽提装置;核酸;RNA提取
核酸提取是下游检测、基因分型的起点,是分子生物学最关键的基本方法之一,已经广泛渗透到生物学、遗传学、医学等各个生命领域。抽提所分离的核酸质量直接影响后续的检测效率及准确性,起着承前启后的关键作用[1-3]。
本科室日均处理RNA提取标本量大,使用的配套负压抽提装置存在压力易泄漏,不稳定,处理工作效率低,容量小等缺陷。为此现研制一款大容量扣式负压抽提装置,通过平行使用配套负压抽提装置和自制大容量扣式负压抽提装置进行扩增前性能评价,比较两者工作效率、提取RNA的纯度及完整性,为自制装置的使用提供理论依据。
1 资料与方法
1.1一般资料选取该院已检测的白细胞(WBC)大于2.0×109/L的新鲜全血67份作为标本,排除严重脂浊、溶血、黄疸标本,采用乙二胺四乙酸二钾(EDTA-K2)抗凝。
1.2仪器与试剂
1.1.1RNA抽提的柱式抽提法(1)对照组RNA提取装置:采用配套的美国AXYGEN公司生产的负压抽提装置(型号 AP VM Ⅱ)AP VM Ⅱ 可容纳16支柱子。(2)实验组RNA提取装置:采用自制大容量扣式负压抽提装置。本实验室从3个方面进行改进:第一,将负压抽提装置改为四面蝶形的扣环,启动时完全取代人力,也可克服装置使用时间长后,上下两部分间隙逐渐加大的弱点。第二,将衔接处改为螺旋接口,支持单个衔接处更换,不用时用螺旋盖帽封闭,避免因个别泄露导致整个装置漏压。第三,将装置改为8×12阵列形式,容纳96支柱子,较市面普遍使用的负压抽提装置容纳柱量增加6倍以上,完美衔接下游的PCR扩增仪。
1.1.2RNA纯度检测采用eppendorf bioPhotometer plus核酸蛋白测定仪,RNA完整性检测使用北京六一仪器厂生产的DYY-4C型电泳仪与UVI凝胶电泳成像仪,抽提柱子及抽提试剂由上海科华生物工程股份有限公司提供。
1.3方法将标本3 500 r/mL离心15 min,吸取标本中白细胞层,装至试管中,再往试管中加入红细胞溶血素-SYS-SLS,由兰桥医疗医学科技有限公司提供,比例为1∶5,冰上孵育10 min,期间涡旋振荡2次,然后4 ℃ 2 100 r/min离心10 min,弃上清液,加入500 μL红细胞溶血素,重悬沉淀WBC,重复上一步骤,最后加入400 μL配套提取试剂里的裂解液,振荡重悬沉淀,WBC平均分成2份(A、B),各200 μL,并分装至试管,并作编号。所有处理标本的吸头、吸嘴及试管皆用0.1焦碳酸二乙酯(DEPC)室温浸泡2 h,无菌水淋洗数次,100 ℃干烤15 min,1.034×105Pa高压灭菌15 min,备用。
1.4标本RNA提取同时使用对照组装置和实验组装置对67份标本进行RNA抽提,其中A标本使用对照组装置抽提,B标本使用实验组装置。
1.5性能评价(1)提取工作效率:记录对照组装置和实验组装置完成67份标本RNA抽提所需时间。(2)浓度及纯度检测:标本4倍稀释后,直接使用eppendorf bioPhotometer plus核酸蛋白测定仪测定标本的OD260、OD260/OD280 及OD260/OD230。可分别反映标本抽提总RNA浓度、蛋白质干扰及有机溶剂残留情况。(3)完整性检测:取10 μL提取标本与2 μL上样缓冲液混匀,点样于1%琼脂糖凝胶,0.5 TBE电泳缓冲液环境下,110 V 恒压电泳15 min,然后0.5 μg/mL溴化乙锭(EB)染色5 min,最后凝胶电泳成像系统拍照检测。
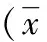
2 结 果
2.12种装置工作效率结果比较对照组装置处理67份RNA标本抽提用时69 min,处理效率平均为0.97份/分;实验组装置用时41 min,效率平均为1.63份/分,差异有统计学意义(P<0.05)。
2.22种装置RNA浓度及纯度检测结果比较对照组标本检测OD260为(1.555±0.134),实验组为(1.627±0.136)。计算2组RNA浓度分别为(248.8±21.4)μg/mL和(260.3±21.8)μg/mL。对照组OD260/OD280 及OD260/OD230比值分别为(1.995±0.095)和(2.020±0.082),实验组分别为(2.093±0.092)和(2.071±0.120)。2种装置抽提RNA浓度比较,差异有统计学意义(P<0.05)。2种装置抽提标本RNA蛋白质干扰及有机溶剂残留,RNA OD260/OD280 95%CI为1.80~2.00,OD260/OD230 95%CI大于2.00。相关性分析显示,Y=0.950X+0.039,R2=0.903,2组数据相关性良好。
2.32种装置RNA完整性结果比较凝胶电泳成像系统拍照检测,电泳结果显示,2种设备提取的总RNA有2条整齐、清晰条带(18S、28S),说明2种设备在RNA提取过程中,RNA降解少,完整性较好,2组完整性均符合要求。见图1、2。

图1 自制装置提取RNA(A13-A17)

图2 配套装置提取RNA(B13-B17)
3 讨 论
方法学评价通过实验途径测定分析方法的技术性能,确认其是否满足临床使用要求或验证是否达到厂家声明的技术性能指标[4-6]。血液中提取RNA是分子生物学研究中常用的重要实验技术[7-8]。RNA分子结构极不稳定,可受较多因素改变而降解[9-10]。本研究RNA提取采用柱式分离技术[11]。
本研究结果表明,RNA提取工作效率上,对照组装置为69 min,处理效率平均为0.97份/分;实验装置为41 min,平均为1.63份/分,实验组远高于对照组。对照组装置每次只能处理16份标本,当标本大于16份时,需多次处理,67份标本须下柱4次及装柱5次;实验组装置可一次性完成67份标本处理。本实验室日均处理RNA抽提标本在125份以上,可节约时间近60 min,提示标本量越大,优势越明显。使用实验组装置降低等待下游检测时间太长所致的RNA降解风险[12-13]。2组抽提标本RNA浓度结果显示,对照组装置为(248.8±21.4)μg/mL,实验组装置为(260.3±21.8)μg/mL,实验组装置抽提标本RNA浓度较高,差异有统计学意义(t=24.570,P<0.001)。相关性分析表明,Y=0.950X+0.039,R2=0.903,2组数据相关性良好。
OD280nm和OD230nm的吸光度分别代表蛋白质和有机溶剂含量,OD260/OD280和OD260/OD230比值可考察上述物质在RNA进行下游检测时的干扰程度,即反映抽提的RNA纯度[14]。对照组装置的OD260/OD280和OD260/OD230分别为(1.995±0.095)和(2.020±0.082),95%CI为1.964~2.025和2.001~2.040;实验组装置为(2.093±0.092)和(2.071±0.120),95%CI分别为2.075~2.113和2.044~2.103,说明2组OD260/OD280的95%CI为1.80~2.00,OD260/OD230的95%CI>2.00,证明2种装置提取RNA纯度均较好,但实验组装置的OD260/OD280和OD260/OD230比值较对照组大,纯度更好,可能与抽提过程中扣式装置传递和维持负压更稳定有关。RNA完整性分析显示,2种设备提取的RNA在28S及18S处有2条明显的条带,且28S亮度大于18S,说明2种设备在RNA提取过程中,RNA降解少,完整性较好。
综上所述,实验组装置RNA抽提质量稍好于对照组,能保证RNA的浓度、纯度及完整性,可在临床实验室使用,且工作效率提高较大,解决了负压抽提装置普遍存在需借助人手按压启动、压力易泄露、易损坏及柱子容纳数量少等缺点,实用性增强,具有更优的临床价值。
[1]刘洪波,刘晓雷,罗小铭.核酸提取方法进展[J].现代生物医学进展,2011,11(16):3187-3190.
[2]章林华,王丰园.核酸提取方法的改进[J].放射免疫学杂志,2011,24(5):591.
[3]张杰,武晶晶,赵飞飞,等.不同温度和不同放置时间对总 RNA 提取浓度和纯度的影响[J].实验技术与管理,2013,30(11):79-82.
[4]辛运超.细菌生物膜RNA提取方法研究[J].国际检验医学杂志,2015,36(2):244-246.
[5]何松哲,何慧,陈懿,等.不同保存和处理方式对全血标本总RNA提取的影响[J].中国微生态学杂志,2015,27(2):223-226.
[6]王惠民,王清涛.临床实验室管理学[M].6版.北京:高等教育出版社,2012:68-97.
[7]J·萨姆布鲁克,D·W·拉塞尔.分子克隆实验指南[M].北京:北京科学出版社,2002:516-522.
[8]孟浩,彭贞,王闯,等.血液总RNA提取方法的比较[J].塔里木大学学报,2014,26(1):46-49.
[9]Jiang Z,Uboh CE,Chen J,et al.Isolation of RNA from equine peripheral blood cells:comparison of methods[J].Springerplus,2013,2(1):478-479.
[10]邱方,陈子祥,杨清玉,等.不同方法提取血清总RNA的性能评价[J].国际检验医学杂志,2012,33(4):457-458.
[11]刘学敏,陈丽茹,马冬雪,等.丙肝病毒 RNA 提取方法优化研究[J].现代仪器与医疗,2015,21(5):50-52.
[12]邱方,陈子祥,杨清玉,等.不同方法提取血清总RNA的性能评价[J].国际检验医学杂志,2012,33(4):457-458.
[13]黄培堂,俞炜源,陈天弥.PCR技术实验指南[M].北京:北京科学出版社,1998:75-81.
[14]穆龙龙,赵志英,朱立.全血标本保存条件对人总RNA提取效率的影响[J].北京医学,2010,32(10):837-840.
Performance evaluation of the one self-developed device for transmitting negative pressure in RNA extraction*
ZHUANGJianghai,HEXian,ZHUOXueya,ZHENGWenbiao
(DepartmentofClinicalLaboratory,FoshanTraditionalChineseMedicineHospital,Foshan,Guangdong528000,China)
ObjectiveTo evaluate the self-developed device for transmitting negative pressure with large capacity before propagating.MethodsTotally 67 ribonucleic acid(RNA) of WBC>2.0×109/L fresh whole blood were extracted with the intrinsic device(control) and the self-developed device for transmitting negative pressure with large capacity(test) in parallel.The difference of the performance including efficiency,concentration,purity and integrity of RNA extraction were evaluated between the two groups.ResultsIn 67 specimens of RNA extraction,efficiency,concentration,purity and integrity of the control device were 0.97(portion/minute),(248.8±21.4)μg/mL,(1.995±0.095) (OD260/OD280),(2.020±0.082) (OD260/OD230),1.964-2.025 (95% confidence interval for mean) (OD260/OD280),2.001-2.040(95% confidence interval for mean) (OD260/OD230) and complete.Those of test device were 1.63 portion/minutes,(260.3±21.8)μg/mL,(2.093±0.092) at OD260/OD280,(2.071±0.120) at OD260/OD230,2.075-2.113 for 95% confidence interval for mean at OD260/OD280,2.044-2.103 for 95% confidence interval for mean at OD260/OD230 and complete.Thetvalue was 24.570 (P<0.001) in pairedt-test,and the linear regression equation wasY=0.950X+0.039,R2=0.903 for the two groups data of RNA concentration.ConclusionThe self-developed device for transmitting negative pressure with large capacity is excellent in the work efficiency,concentration,purity,integrality and of the RNA in extracting.It is better than the intrinsic device in the clinical value for situation of lab.
device for transmitting negative pressure;ribonucleic acid;RNA extraction
广东省科技厅科枝计划项目(2013-137-06)。
庄健海,男,主任技师,主要从事临床免疫及分子生物学研究。
10.3969/j.issn.1673-4130.2016.19.025
A
1673-4130(2016)19-2723-03
2016-03-01
2016-04-23)
