热应激状态下牛血清生化指标、miRNA表达变化及其相关性分析
2016-11-01蔡明成张佳卉左福元
胡 煜,蔡明成,王 玲,谭 林,毕 武,张佳卉,左福元*
(1.西南大学荣昌校区动物科学系,荣昌 402460;2.四川农业大学动物遗传育种研究所,温江 611130 )
热应激状态下牛血清生化指标、miRNA表达变化及其相关性分析
胡煜1,蔡明成2,王玲1,谭林1,毕武1,张佳卉1,左福元1*
(1.西南大学荣昌校区动物科学系,荣昌 402460;2.四川农业大学动物遗传育种研究所,温江 611130 )
本研究旨在探索热应激对牛miRNA表达量和血清生化指标的影响及其相互关系,筛选牛血清中与热应激相关的调控因子。选择20头体况相近、饲养管理一致的红安格斯公牛,分别于热应激期和非热应激期采集血样,进行血清生化指标及miRNA表达量的测定。结果表明,与非热应激期相比,热应激下血清Cl-浓度、LDH活性显著升高(P<0.05),MDA含量极显著升高(P<0.01);T-AOC活性、GSH-Px活性、IgA含量、 IgG含量显著降低(P<0.05),SOD活性、IL-2含量极显著降低(P<0.01)。对血清miRNA定量分析发现,miR-181a、miR-486表达量显著下调(P<0.05),分别与IgA、IL-2含量均呈显著正相关(P<0.05),分别与IgG含量呈极显著正相关(P<0.01)。而miR-1246表达量极显著上调(P<0.01),与MDA含量呈极显著正相关(P<0.01)。综上表明,miR-1246、miR-181a、miR-486在机体热应激状态下参与了调控免疫应答及抗氧化等方面的作用,可作为肉牛抗热应激的分子标记。
热应激;miRNA;血清生化指标;相关性
热应激是外界环境温度超过等热范围,物理调节不能维持机体热平衡,机体散热受阻,体温升高而引起的非特异性防御反应和特异性障碍在内的全身性适应症[1-2]。肉牛属于恒温动物,汗腺不发达,耐热性差,在中国南方高温高湿环境下极易出现热应激反应。
血液承担着机体营养物质及代谢产物的运输,是调节机体各代谢的主要途径。血清生化指标可以反映机体各组织器官的生理病理状况。由于血液样本较易获取,常常作为寻找疾病分子标志物最理想的材料。目前,世界各地科研工作者和临床医生已在心血管疾病、癌症、肿瘤、组织损伤等领域开展了一系列外周血循环miRNA标志物的研究与开发,并取得了一定进展[3]。miRNA是一种微小RNA,发挥基因转录后的调控功能,在各种生理和病理过程中扮演着重要的角色[4]。血液中的miRNA表达十分稳定,可作为潜在的生物标志物应用于疾病的早期诊断、预后判断以及化疗监测[5]。miRNA是热应激状态下奶牛血清中高表达的调控因子,参与机体各组织器官免疫及抗氧化的调控过程[6],而关于肉牛血清miRNA的研究鲜有报道。本研究旨在通过对热应激和非热应激状态下牛血清生化指标及基因表达量的测定,探讨热应激、miRNA及其与机体免疫功能和抗氧化作用的关系,为筛选牛抗热应激调控因子提供参考。
1 材料与方法
1.1试验动物
在重庆市良种肉牛场选择20头体况相近、体重450 kg左右,饲养管理一致的红安格斯公牛为试验动物,试验期分热应激期(9月11日-17日)和非热应激期(10月17日-23日)两阶段进行,每阶段为期7 d。
1.2牛舍温湿度测定
参考A.Srikandakumar等[7]方法,在各试验阶段每天下午02:00,牛舍中部和两端,离地面1.5 m处悬挂温湿度表,测定干湿球温度,计算温湿指数(THI),THI= 0.72( Td+Tw)+40.6,其中Td是干球温度,Tw是湿球温度。(判断标准:THI<72为正常生理状态;72~79为轻度热应激状态;79~89为中度热应激状态;> 90为重度热应激状态)
1.3指标测定
1.3.1血样采集在各试验期第7 天下午02:00利用真空采血进行颈静脉采血(10 mL·头-1),并于离心机中,3 000 r·min-1离心15 min,分离血清于-20 ℃冷冻保存供生化指标测定。
1.3.2直肠温度、呼吸频率测定参考杨游等[8]方法,采用兽用体温计及秒表计数器测定直肠温度及呼吸频率。
1.3.3血清生化指标测定用全自动生化分析仪及酶标仪进行血清生化指标的测定。测定内容:血清离子含量(K+、Na+、Cl-、Ca2+);血清酶(ALT、AST、ALP、CK、LDH);抗氧化指标(T-AOC、SOD、GSP-Px、MDA);免疫指标(ALB、IgA、IgG、IgM、IL-2、IL-4、IL-6);内分泌指标(T3、T4);血脂指标(TC、TG、HDL、LDL);测定试剂盒购于南京建成生物工程研究所。
1.4实时荧光定量PCR检测
1.4.1RNA提取及反转录采用Trizol法提取血清总RNA,用紫外分光光度计确定RNA的浓度及OD值,并通过琼脂糖凝胶电泳和毛细血管电泳检测RNA完整性。参照反转录试剂盒说明书(上海生工,B532451)的步骤,反转录总RNA得到miRNA第一链cDNA。
1.4.2引物设计与合成利用miRBase、NCBI等在线工具,获取的miRNAs的成熟序列,采用加尾法设计miRNA引物,同时以U6为内参,下游引物为通用引物(试剂盒自带)。上游引物由上海生工合成(表1)。
1.4.3荧光定量PCR反应采用SYBR®Green I染料法,参照荧光定量说明书(Bio-Rad,1725272)进行。对PCR产物进行熔解曲线分析,同时取PCR产物于1%琼脂糖凝胶中进行电泳,检测引物特异性。随机取1个cDNA样品,用10倍梯度连续稀释回收产物得到实时荧光定量PCR的标准品。将标准品进行标准曲线分析。
表1荧光定量PCR引物及扩增条件
Table 1Primer pairs and amplification requirement for real-time PCR

名称Name上游引物序列(5'→3')Primersequences登录号Accessionnumber退火温度/℃Tm产物大小/bpSizemiR-1246AATGGATTTTTGGAGCAGGMI002111258.8miR-31AGGCAAGATGCTGGCATAGCTMI000476258.8miR-486TCCTGTACTGAGCTGCCCCGAGTMI000984358.8mR-148a-5pAAAGTTCTGAGACACTCCGACTMIMAT000454958.880~120mR-340TCCGTCTCAGTTACTTTATAGCCMI000980960.0miR-181aAACATTCAACGCTGTCGGTGAGTMIMAT000354360.0miR-21TAGCTTATCAGACTGATGTTGACMI000474260.0
1.5统计分析
采用2-△△ct法分析定量结果。使用EXCEL2010对数据进行初步处理,所得数据采用SPSS19.0统计软件Paired-Samplesttest进行显著性分析。结果以“均值±标准差”表示。用Bivariate Correlations估计各变量间的简单相关。
2 结 果
2.1牛舍THI及生理指标的测定
由表2可知,热应激期THI平均为84.83,为79~88,属于中度热应激状态,非热应激期THI平均为62.51,<72,属于正常生理状态。热应激期牛直肠温度达39.24 ℃、呼吸频率达49.60 次·min-1,极显著高于非热应激期(P<0.01)。
2.2热应激对牛血清生化指标的影响
对两个时期血清生化指标检测结果表明(表3),热应激期测得的Cl-浓度、 LDH活性显著高于非热应激期(P<0.05);T-AOC活性、GSP-PX活性、IgA含量、IgG含量、T4含量、TC含量显著低于非热应激期(P<0.05);而MDA活性、HDL含量极显著高于非热应激期(P<0.01);SOD活性、IL-2含量、LDL含量极显著低于非热应激期(P<0.01);剩余指标除热应激期IL-4含量较非热应激期有所升高外,其余指标均有所下降,但差异均不显著(P>0.05)。
表2牛舍环境THI及生理指标测定结果
Table 2The results of barn environment THI and physiological index determination

项目Items温湿指数THI直肠温度/℃RT呼吸频率/(次·min-1)Respiratoryrate状态Condition热应激期Heatstress84.83±0.2939.24±0.34A49.60±2.77A中度热应激状态非热应激期Nonheat-stress62.51±0.4238.34±0.11B32.00±2.83B正常生理状态
同行数据无字母表示差异不显著(P>0.05);不同小写字母表示差异显著(P<0.05);不同大写字母表示差异极显著(P<0.01),下同
No letter in the same row means not significant difference between treatments(P>0.05);Different small letters in the same row means significant difference between the treatments(P<0.05);Different capital letters in the same row means extremely significant difference between the treatments(P<0.01).The same as below
表3血清生化指标的测定结果
Table 3The results of biochemical indexes in serum

项目Items热应激Heatstress非热应激Nonheat-stress钾/(U·L-1)K+4.47±0.495.23±0.66钠/(U·L-1)Na+138.72±2.53139.36±2.14氯/(mmol·L-1)Cl-100.94±3.04a98.52±1.86b钙/(mmol·L-1)Ca2+2.18±0.182.35±0.12谷丙转氨酶/(U·L-1)ALT25.60±7.2028.40±4.88谷草转氨酶/(U·L-1)AST60.20±8.2665.20±10.43碱性磷酸酶/(U·L-1)ALP40.20±8.9340.20±15.35肌酸激酶/(U·L-1)CK188.80±100.51194.60±38.06乳酸脱氢酶/(U·L-1)LDH1320.60±206.03a1075.20±212.67b总抗氧化能力/(U·mL-1)T-AOC4.39±0.47a6.41±0.81b超氧化物歧化酶/(U·mL-1)SOD99.65±3.53A113.00±3.19B谷胱甘肽过氧化/(μmol·L-1)GSP-Px104.81±15.88a141.70±9.60b丙二醛/(nmol·mL-1)MDA3.52±0.35A1.67±0.34B白蛋白/(U·L-1)ALB34.00±3.2536.70±2.50免疫球蛋白A/(μg·mL-1)IgA257.54±41.67a320.33±36.19b免疫球蛋白G/(mg·mL-1)IgG7.68±1.38a14.95±4.97b免疫球蛋白M/(mg·mL-1)IgM3.02±1.913.67±1.76白细胞介素2/(ng·L-1)IL-2360.84±215.75A628.42±213.06B白细胞介素4/(ng·L-1)IL-4380.14±117.14335.57±82.18白细胞介素6/(ng·L-1)IL-61255.48±459.511461.43±322.67三碘甲状腺原氨酸/(nmol·L-1)T32.36±0.962.46±1.82甲状腺素/(nmol·L-1)T493.93±14.14a126.93±8.56b总胆固醇/(g·L-1)TC3.13±0.39a3.96±0.93b甘油三酯/(g·L-1)TG0.23±0.110.33±0.16高密度脂蛋白/(mmol·L-1)HDL2.53±0.31A1.66±0.41B低密度脂蛋白/(mmol·L-1)LDL0.50±0.11A2.15±0.58B
2.3总RNA抽提结果及引物特异性检测
用Nanodrop 2000检测提取的总RNA,OD值均为1.8~2.0,将总RNA进行1%的琼脂糖凝胶电泳后,可见28S、18S、5S 3条条带,28S和18S条带亮度比约为2,条带明亮清晰且无杂带,RNA无降解(图1);同时用Agilent 2100毛细管电泳检测RNA完整性,结果显示,RIN≥8.0,且28S/18S≥0.8,样品完整性好,质量合格(图2)。最后将miRNA扩增产物进行2% 琼脂糖凝胶电泳,结果显示的片段大小与预期一致,引物特异性好(图3)。

图1 总RNA电泳检测Fig.1 Electrophoresis of total RNA extraction
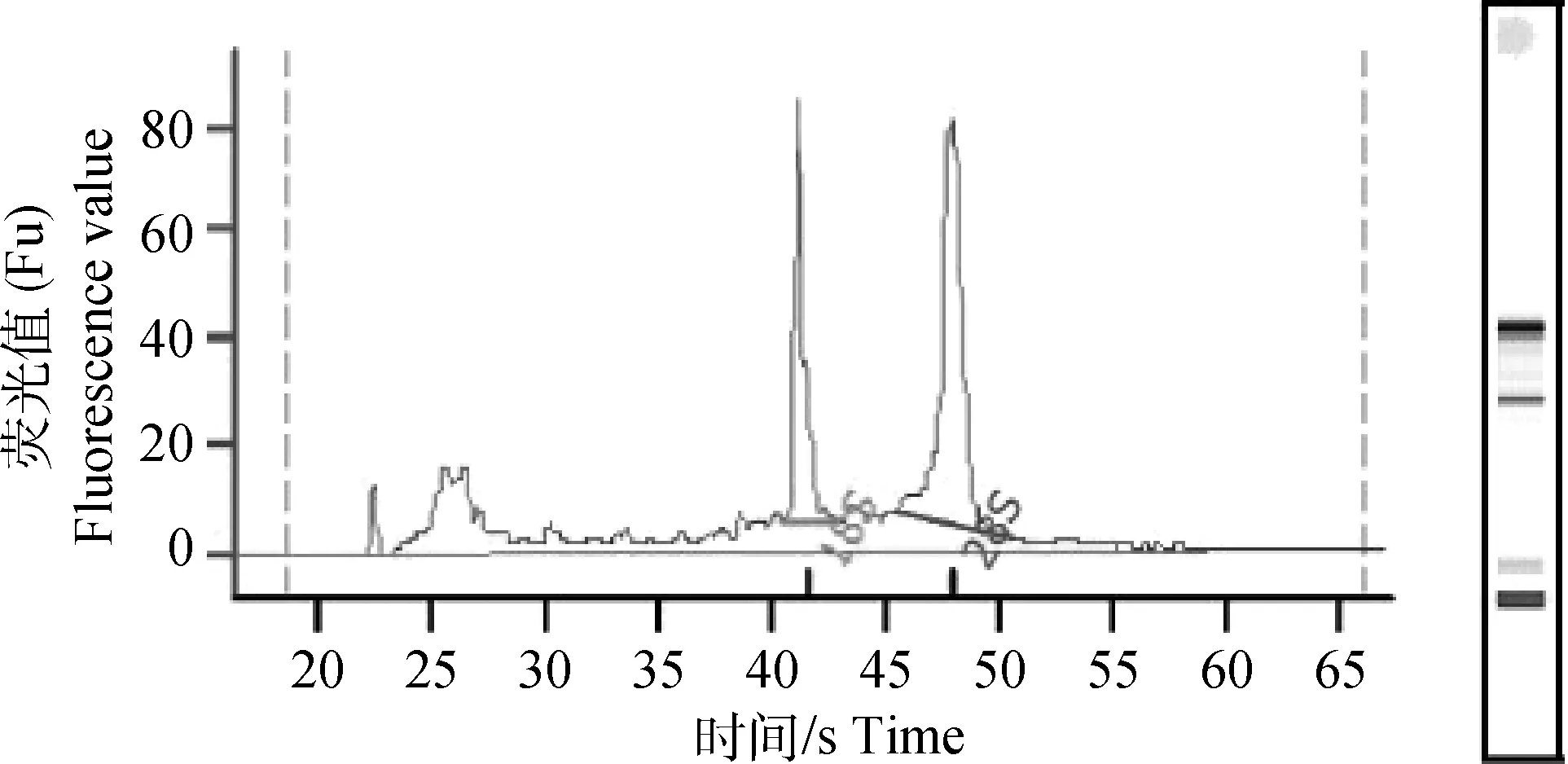
图2 RNA完整性检测Fig.2 Integrity detection of RNA

图3 miRNAs qRT-PCR产物检测Fig.3 Results of miRNAs qRT-PCR
2.4血清miRNA表达情况及其与生化指标的相关性分析
血清中miRNA的表达情况如图4所示。与非热应激期相比,热应激期miR-181a、miR-486表达量均显著下调(P<0.05),miR-1246表达量极显著上调(P<0.01)。将上述差异显著的血清生化指标与血清miRNA表达量进行相关性分析,相关系数如表4所示。由分析结果可知:血清 miR-1246表达量与Cl-、MDA含量呈极显著正相关(P<0.01),与TC含量呈显著负相关(P<0.05);血清miR-181a表达量与IgG含量呈极显著正相关(P<0.01),与IgA、IL-2含量呈显著正相关(P<0.05);血清miR-486表达量与IgG含量呈极显著正相关(P<0.01),与LDH、T-AOC、IgA、IL-2含量呈显著正相关(P<0.05),其余变量之间无显著相关性。

**.P<0.01;*.P<0.05,表4同 **.P<0.01;*.P<0.05.The same as Table 4图4 血清miRNA 的表达情况Fig.4 The expression of miRNA in serum
表4血清miRNA表达量与血清生化指标的相关性分析
Table 4The correlation analysis of miRNA expression and biochemical indexes in serum
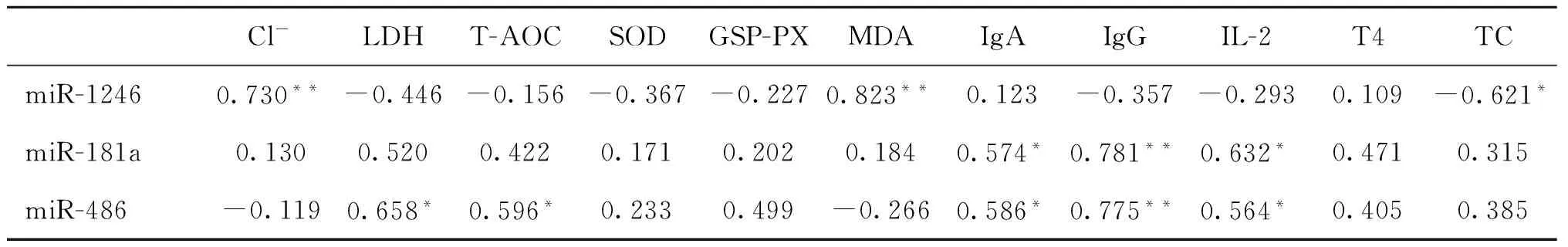
Cl-LDHT-AOCSODGSP-PXMDAIgAIgGIL-2T4TCmiR-12460.730**-0.446-0.156-0.367-0.2270.823**0.123-0.357-0.2930.109-0.621*miR-181a0.1300.5200.4220.1710.2020.1840.574*0.781**0.632*0.4710.315miR-486-0.1190.658*0.596*0.2330.499-0.2660.586*0.775**0.564*0.4050.385
2.5 miRNA-靶基因的网络互作
相关性分析结果表明,miRNAs与抗氧化指标及免疫指标存在显著相关性,提示miRNAs可能在机体免疫应答、抗氧化等方面具有调控作用,用TargetScan和 microRNA.Org 等软件对miRNA进行靶基因预测,将预测到的靶基因在KEGG、DAVID数据库中进行GO分析和KEGG分析。并用Cytoscape软件对筛选结果进行分析处理,由图5可知,这些miRNA与靶基因构成一个结构复杂的多中心基因互作结构图,处于网络中心的节点除与网络周边节点之间存在相互作用外,与其他网络中心节点之间也存在广泛的互作关系。GO和KEGG分析表明,这些基因广泛参与多种生物学过程,并在免疫系统发育信号通路、B细胞受体信号通路、T受体信号通路和MAPK级联反应等信号通路中发挥重要作用(表5)。
3 讨 论
热应激是一种全身性的反应,对机体的神经内分泌、消化吸收、血液循环、泌尿生殖、免疫和物质代谢等方面均会产生影响。血清中无机离子含量对牛的正常生理代谢具有重大意义。本研究发现热应激下,牛血清K+、Ca2+、Na+均降低,血清Cl-则显著升高,其原因可能是在热应激早期,由于环境温度变化,引起机体呼吸中枢兴奋,呼吸加快,使血液CO2含量下降,引起呼吸性碱中毒。从而引起肾中碳酸氢盐的分泌能力增强,使肾小管对Cl-的吸收增加,最终导致血清中Cl-含量增加[9]。这与Z.Arad等[10]研究结果基本一致,说明热应激影响了机体电解质平衡。本研究还发现热应激状态下血清LDH升高,可能原因是LDH参与了无氧酵解,LDH可能导致机体乳酸水平增加,引起酸中毒,而酸中毒会影响呼吸,使机体出现呼吸功能障碍,机体缺氧。然而在此情况下,为保证中枢神经系统、心等重要器官供氧充足,其他组织则采取无氧酵解的方式供能,而无氧酵解运动加强的同时,又会使机体LDH升高。说明随着热应激程度的加深,机体出现呼吸性碱中毒和代谢性酸中毒的混合型酸碱紊乱。本研究发现热应激期T-AOC、SOD、GSP-PX含量均降低,而MDA含量升高,这是由于在热应激情况下,机体抗氧化防御体系受到破坏,自由基产生过多,自由基与不饱和脂肪酸作用,生成脂质过氧化物,最终降解为MDA代谢物,这与李忠浩[11]的研究结果一致。说明热应激下牛抗氧化能力下降,自由基清除减少,对机体组织、细胞造成了氧化攻击。
表5miRNA 靶基因GO和KEGG分析参与的主要信号通路
Table 5GO and KEGG analyze the main pathway of miRNA target genes
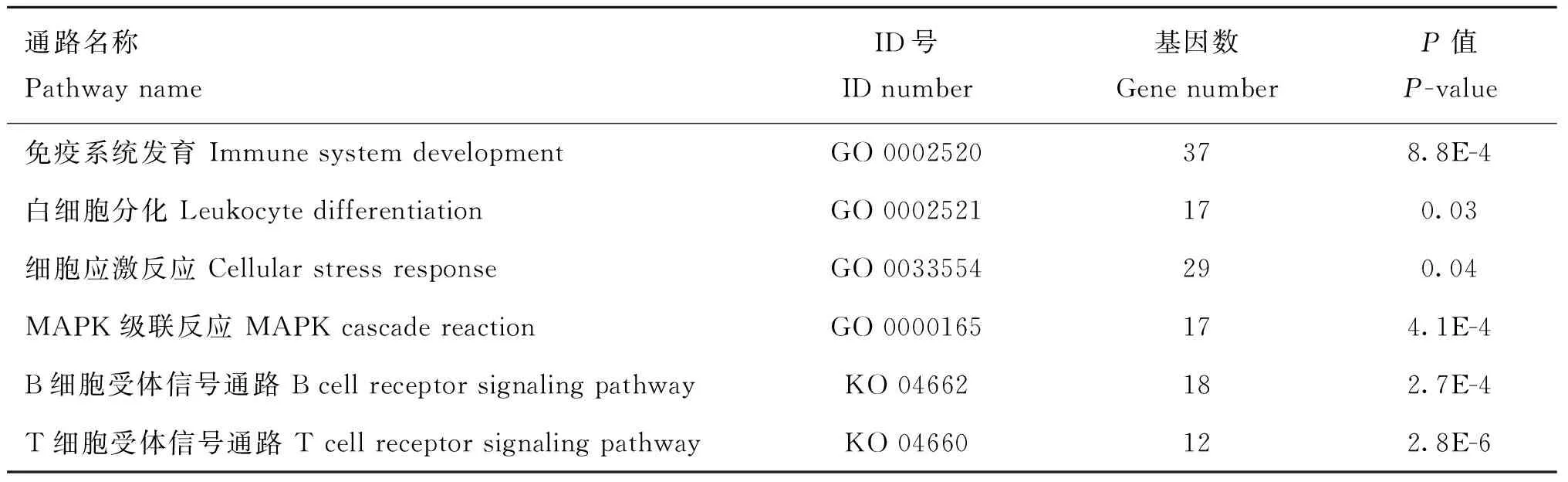
通路名称PathwaynameID号IDnumber基因数GenenumberP值P-value免疫系统发育ImmunesystemdevelopmentGO0002520378.8E-4白细胞分化LeukocytedifferentiationGO0002521170.03细胞应激反应CellularstressresponseGO0033554290.04MAPK级联反应MAPKcascadereactionGO0000165174.1E-4B细胞受体信号通路BcellreceptorsignalingpathwayKO04662182.7E-4T细胞受体信号通路TcellreceptorsignalingpathwayKO04660122.8E-6

紫框、黄框、蓝框分别表示各miRNA的靶基因域,红圈表示这些miRNA所共有的靶基因,调控关系用灰色箭头表示Purple box,yellow box and blue box represents the three miRNAs target genes,respectively.Red circle represents common target genes.Grey arrows represent regulatory relationships图5 miRNA-靶基因删除部分节点后的网络状态Fig.5 Delete a part of the nodes of miRNA-target genes in network
本研究发现MDA含量与miR-1246表达量极显著相关,其原因可能是热应激加速了机体组织的脂质过氧化,并导致其抗氧化能力下降。通过靶基因预测发现,其调控的靶基因中,ENOX2、GCLC、CAV1与机体抗氧化功能有关。在热应激状态下,CAV1表达升高,导致内皮型一氧化氮合酶(Endothelial nitric oxide synthase,eNOS)脱偶联,eNOS出现功能障碍将不再生成NO,促使NO水平下降和超氧阴离子(O2-)增多,自由基水平升高,最终造成机体过氧化[12]。本研究发现热应激下免疫球蛋白IgA、IgG显著降低,炎症因子IL-2极显著降低,可能是热应激影响了机体免疫水平和T淋巴细胞亚群的平衡。本研究中miR-181a和miR-486表达量与免疫指标(IL-2、IgA、IgG)显著相关,这与C.Z.Chen等[13]、Y.B.Ouyang等[14]的结果相似。C.Z.Chen等[13]发现miR-181a在小鼠造血器官差异表达,miR-181a可以调控B细胞发育和调节T细胞受体(TCR)介导的CD4+T细胞抗原反应。Y.B.Ouyang等[14]用生物信息学识别研究发现miR-181a可能会调控热应激蛋白家族(HSP70家族)几个基因成员(如GRP78)的mRNA表达。心肌细胞在缺氧/复养损伤过程中,miR-486表达水平在Toll-like receptor 4的缺少或者 Pam3CSK4治疗过程中有明显增加。同时用慢病毒表达载体转染H9C2肌细胞能显著减缓缺氧/复氧引起的LDH释放[15]。这也与本研究发现的miR-486表达量与LDH含量呈极显著相关存在一定的相似性。通过靶基因预测发现,miR-181a和miR-486可能调控CD38、IL17F、CD4基因的表达与T细胞活化、B细胞分泌和免疫响应等信号通路相关。研究表明CD4+T淋巴细胞约占成熟T淋巴细胞70%,主要为辅助性T细胞,CD4+T细胞分为 TH1和TH2两个功能性细胞亚群。 TH细胞分泌 IL-2、IFN-γ、TNF-β,而 TH2细胞分泌 IL-4、IL-5、IL-6、IL-10等,说明CD4+T细胞通过这些炎症因子,参与免疫反应[16]。综上表明,本研究初步确定了热应激、miRNA及其与机体免疫功能和抗氧化作用的关系,预测了miRNA可能调控的靶基因,但是关于miRNA如何调控目标基因,进而影响机体免疫、抗氧化、代谢等功能的具体机制尚需要更加系统的生物试验来验证。
4 结 论
热应激引起牛血液LDH、MDA、IgA、IgG、IL-2含量及miR-1246、miR-181a和miR-486表达的显著性变化,并且两者变化具有相关性。miR-1246、miR-181a、miR-486在机体热应激状态下参与了调控免疫应答及抗氧化防疫等方面的作用,可作为肉牛抗热应激的分子标记。
[1]DAVIS M S,MADER T L,HOLT S M,et al.Strategies to reduce feedlot cattle heat stress:effects on tympanic temperature[J].JAnimSci,2003,81(81):649-661.
[2]KOVATS R S,HAJAT S.Heat stress and public health:a critical review[J].AnnuRevPublHealth,2008,29(1):41-55.
[3]TAYLOR D D,GERCEL-TAYLOR C.microRNA signatures of tumor-derived exosomes as diagnostic biomarkers of ovarian cancer[J].GynecolOncol,2008,110(1):13-21.
[4]ZHANG B,WANG Q,PAN X,et al.microRNAs and their regulatory roles in animals and plants[J].JCellPhysiol,2007,210(2):279-289.
[5]BASTOS M,ADAO R,NAZMI K,et al.microRNA signatures in total peripheral blood as novel biomarkers for acute myocardial infarction[J].BasicResCardiol,2011,106(1):13-23.
[6]ZHENG Y,CHEN K L,ZHENG X M,et al.Identification and bioinformatics analysis of microRNAs associated with stress and immune response in serum of heat-stressed and normal Holstein cows[J].JMaterSciLett,2014,19(6):973-981.
[7]SRIKANDAKUMAR A,JOHNSON E H.Effect of heat stress on milk production,rectal temperature,respiratory rate and blood chemistry in Holstein,Jersey and Australian milking zebu cows[J].TropAnimHealthProd,2004,36(7):685-692.
[8]杨游,袁志琳,董国忠,等.饲粮中添加脂肪酸钙和烟酸铬对热应激奶牛产奶性能、生理指标及血清生化指标的影响[J].动物营养学报,2012,24(1):145-151.
YANG Y,YUAN Z L,DONG G Z,et al.Dietary calcium soaps of fatty acids and chromium Nicotinate affect lactation performance,physiological and serum biochemical indices of dairy cows under heat stress[J].ChineseJournalofAnimalNutrition,2012,24(1):145-151.(in Chinese)
[9]KADZERE C T,MURPHY M R,SILANIKOVE N,et al.Heat stress in lactating dairy cows:a review[J].LivestProdSci,2002,77(1):59-91.
[10]ARAD Z,MARDER J,EYLATH U,et al.Serum electrolyte and enzyme responses to heat stress and dehydration in the fowl (Gallusdomesticus)[J].CompBiochemPhysiolA:Physiol,1983,74(74):449-453.
[11]李忠浩.热应激对荷斯坦奶牛外周血淋巴细胞凋亡与抗氧化特性的影响[D].南京:南京农业大学,2007.
LI Z H.The influence of heat stress on lymphocyte apoptosis in peripheral blood and antioxidant character of Holstein cows[D].Nanjing:Nanjing Agricultural University,2007.(in Chinese)
[12]KARAA A,KAMOUN W S,CLEMENS M G,et al.Oxidative stress disrupts nitric oxide synthase activation in liver endothelial cells[J].FreeRadicalBiolMed,2005,39(10):1320-1331.
[13]CHEN C Z,LI L,LODISH H F,et al.microRNAs modulate hematopoietic lineage differentiation[J].Science,2005,303(303):83-86.
[14]OUYANG Y B,LU Y,YUE S,et al.miR-181 regulates GRP78 and influences outcome from cerebral ischemiainvitro,andinvivo[J].NeurobiolDis,2012,45(1):555-563.
[15]WANG X,HA T,ZHANG X,et al.Bone marrow stromal cell derived exosomes carrying microrna-486 attenuate H/r-induced cardiac myocyte damageinvitroand I/r-induced myocardial injuryinvivo[J].Circulation,2014,130 (Suppl 2):A12608.
[16]GUPTA S,AGGARWAL S,RASHANRAVAN B,et al.Th1-and Th2-like cytokines in CD4+and CD8+T cells in autism[J].JNeuroimmunol,1998,85(1):106-109.
(编辑程金华)
The Serum Biochemical Indexes and miRNA Expression in Cattle under Heat Stress and Their Correlation Analysis
HU Yu1,CAI Ming-cheng2,WANG Ling1,TAN Lin1,BI Wu1,ZHANG Jia-hui1,ZUO Fu-yuan1*
(1.DepartmentofAnimalScience,RongchangCampusofSouthwestUniversity,Rongchang402460,China;2.InstituteofAnimalGeneticsandBreeding,SichuanAgriculturalUniversity,Wenjiang611130,China)
The aim of the present study was to assess the changes of miRNA expression levels and serum biochemical indexes of cattle in heat stress.Twenty Red Angus bulls with similar body condition and consistent feeding and management selected from Chongqing Improved Beef Cattle Farm were used in the experiment.Blood samples were collected from each bull in heat stress and non heat-stress to analyze miRNA expression levels and serum biochemical indexes.The results showed that the serum concentrations of Cl-(P<0.05) and malondialdehyde (MDA) (P<0.01) and the activities of lactate dehydrogenase (LDH) (P<0.05) were significantly increased in heat stress in comparison with control.Whereas,the activities of total antioxidation (T-AOC) (P<0.05),glutathione peroxidase (GSH-Px) (P<0.05) and superoxide dismutase (SOD) (P<0.01) as well as the contents of IgA (P<0.05),IgG (P<0.05) and interleukin-2 (IL-2) (P<0.01) were remarkably decreased.Meanwhile,the expression levels of miR-181a (P<0.05) and miR-486 (P<0.05) were significantly downregulated and positively correlated with the contents of IgA (P<0.05),IL-2 (P<0.05) and IgG (P<0.01),respectively,but that of miR-1246 were significantly upregulated (P<0.01) and positively correlated with serum contents of MDA (P<0.05).In conclusion,the current results suggested that miR-1246,miR-181a,miR-486 might be involved in regulating the immune response and antioxidation process of cattle in heat stress,and could be as a molecular indicator of anti-heat stress.
heat stress;miRNA;serum biochemical index;correlation
10.11843/j.issn.0366-6964.2016.09.012
2016-04-01
重庆市科技支撑示范工程项目/丰都肉牛产业协同创新与关键技术攻关(jcsf121-2012-01-1);中央高校基本业务费专项资金资助(XDJK2016E086);西南大学荣昌校区青年基金 (20700426)
胡煜(1991-),女,湖南益阳人,硕士生,主要从事动物遗传育种研究,E-mail: huyu_186@163.com
左福元,教授,主要从事反刍动物遗传育种研究,E-mail: zfuyuan@163.com
S823.2
A
0366-6964(2016)09-1840-08
