肺炎链球菌SP2108蛋白的原核表达及免疫原性分析*
2016-11-01骆诗露韩道宾陈泽慧朱杰华
骆诗露,黄 健,韩道宾,陈泽慧,朱杰华,闵 迅
(1.遵义医学院 医学检验系,贵州 遵义 563099;2.遵义医学院附属医院 医学检验科,贵州 遵义 563099)
基础医学研究
肺炎链球菌SP2108蛋白的原核表达及免疫原性分析*
骆诗露1,黄健2,韩道宾1,陈泽慧2,朱杰华2,闵迅2
(1.遵义医学院 医学检验系,贵州 遵义563099;2.遵义医学院附属医院 医学检验科,贵州 遵义563099)
目的 制备纯化的肺炎链球菌(Streptococcuspneumoniae,S.pn)SP2108蛋白,分析其在常见S.pn菌株中的保守性,并评价其作为S.pn候选疫苗的可行性。方法 利用PCR法扩增全长SP2108基因,将其克隆至原核表达载体pCold TF中,转化E.coliBL21(DE3)后IPTG诱导蛋白表达,经Ni-NTA树脂纯化获得高纯度的目的蛋白;将纯化蛋白免疫C57BL/6小鼠制备多克隆抗体,并用间接ELISA检测效价,Western blot鉴定该蛋白在6种常见S.pn菌株的保守性。从Genebank中找出不同S.pn菌株的SP2108蛋白质氨基酸序列,并用ClustalX 2.1软件分析其序列保守性。结果 获得了可溶性形式的SP2108蛋白,该重组蛋白免疫小鼠后可获得高滴度的多克隆抗体;Western blot验证了SP2108 蛋白在6株常见S.pn菌株中均有表达;SP2108蛋白在不同型别S.pn中氨基酸序列保守性为100%。结论 原核表达并纯化了SP2108蛋白,该蛋白保守性高,免疫小鼠后可获得高滴度的多克隆抗体,可能是一种较好的S.pn候选蛋白疫苗。
肺炎链球菌;SP2108蛋白;原核表达;保守性;C57BL/6小鼠
肺炎链球菌(Streptococcuspneumoniae,S.pn)是定植于人体鼻咽部黏膜表面的革兰阳性条件致病菌,可引起肺炎、中耳炎、脑膜炎等疾病,其在65岁以上老年人及5岁以下儿童中具有较高的致病率和致死率[1]。据统计,肺炎居我国5岁以下儿童死因的前五位,在重症肺炎中,约有50%是由S.pn引起[2]。近年来,由于抗生素的滥用及S.pn多重耐药菌株的广泛出现,预防和控制S.pn感染已经进入到疫苗接种阶段[3]。目前上市的S.pn疫苗主要包括23价荚膜多糖疫苗和7价多糖蛋白结合疫苗,前者抗原性弱,主要适用于中老年人及存在高风险的成年人,对2岁以下的幼儿无免疫保护力[4];后者虽能显著减低侵袭性S.pn疾病,但该种疫苗存在血清覆盖范围窄、生产成本高、非疫苗血清型替换等缺点,不利于在发展中国家大规模使用[5]。而S.pn蛋白质疫苗具有免疫原性强、保守性高,制备成本低等优势,其作为现有疫苗的替代品或者补充物已成为了近10年S.pn疫苗研发的主流。
SP2108蛋白是S.pnABC转运系统中的底物结合蛋白,能特异性地结合并转运麦芽糖,从而调节细菌生长及在鼻咽部的定植[6-7]。通过蛋白质组学方法已证实SP2108位于S.pn的表面,它能够刺激经S.pn全菌免疫后的不同品系小鼠的脾细胞及自然暴露S.pn的人体外周血单个核细胞产生IL-17A,且能在S.pn感染早期引起机体CD4+T细胞介导的免疫应答,是一个具有潜力的候选疫苗靶点[8]。本实验主要通过原核表达及纯化SP2108蛋白,将其免疫小鼠制备多克隆抗体,并进一步分析保守性,探讨其作为S.pn候选蛋白疫苗的可行性,为研发新的蛋白疫苗提供理论依据。
1 材料与方法
1.1菌株及质粒大肠杆菌E.coliDH5a、E.coliBL21(DE3)、pCold TF质粒为本课题组实验室保存;NTCC7466(D39,serotype 2)、TIGR4(serotype 4)S.pn标准菌株购自欧洲菌株保存中心;不同血清型S.pn临床菌株 CMCC(B) 31693(serotype 19F) 、CMCC(B)31207(serotype 6B)、CMCC(B)31203(serotype 3)、ATCC (BAA-255) (R6 serotype 2)购自中国医学微生物菌种保存中心。
1.2实验动物C57BL/6小鼠,SPF级,6~8周, 雌性,18~20 g,购自中国人民解放军第三军医大学实验动物中心。
1.3主要试剂蛋白质Marker、 DL 2000 DNA Marker、T4DNA连接酶、PrimerStar高保真DNA聚合酶、限制性内切酶EcoRI/Xho I、DNA纯化试剂盒购自TaKaRa公司;质粒抽提试剂盒购自Omega公司生产;基因组DNA提取试剂盒购自北京天根公司生产;高敏化学发光检测试剂盒购自上海七海复泰生物科技有限公司;HRP标记羊抗鼠IgG二抗购自北京中杉金桥公司;Ni2+-NTA 亲和层析柱购自美国GE Healthcare 公司;其他试剂购自上海生工生物工程技术服务有限公司。
1.4方法
1.4.1引物设计根据GeneBank中SP2108基因序列,用Primer Premier 5.0软件设计上游引物F:5'-CGGAATTCTTATTCACCAAATTTTTGTTTG3';下游引物R:5'-CCGCTCGAGATGTCATCTAAATTTATGAAG-3',下划线部分分别为EcoRI和XhoI酶切位点,引物由上海生工生物工程技术服务有限公司合成。
1.4.2PCR扩增目的基因以细菌基因组DNA提取试剂盒提取D39标准菌株DNA,以此为模板行PCR扩增。扩增条件:98 ℃变性20 s,55 ℃退火15 s,72 ℃延伸95 s,30个循环,72 ℃延伸5 min,4 ℃保存。取5 μL PCR产物行1%琼脂糖凝胶电泳鉴定后用DNA纯化试剂盒进行纯化回收。
1.4.3构建pCold TF- SP2108原核表达载体用限制性内切酶EcoR I和Xho I同时酶切目的基因及质粒载体,纯化后按一定比例混合并加入T4DNA连接酶16 ℃连接过夜,将连接产物转入E.coliDH5α感受态细胞中,用含氨苄西林(100 μg/mL)的LB平板筛选阳性克隆,提取重组质粒行双酶切鉴定,并送南京金斯瑞公司进行测序。
1.4.4重组蛋白的诱导表达及纯化将重组表达质粒转入E.coliBL21(DE3) 感受态中,涂布含氨苄西林(100 μg/mL)的LB平板,37 ℃培养过夜后挑取含有重组表达载体的E.coliBL21(DE3)单个菌落接种于5 mL含氨苄西林(100 μg/mL)的LB培养液中,37 ℃,180 r/min恒温摇床中培养过夜,次日按1∶50比例转接于含同浓度氨苄西林的LB培养液中,同条件继续培养至OD600=0.5左右时,加入诱导剂IPTG(终浓度0.5 mmol/L), 15 ℃,100 r/min, 诱导培养12 h 后离心收集诱导菌,并将其重悬于1×Binding Buffer(300 mmol /L NaCl,10 mmol/L PBS ,pH 8.0)中,经超声破菌离心后分别取上清和沉淀行SDS-PAGE鉴定其表达形式。按照His Bind Column操作说明,将破菌后的上清液转入Ni-NTA亲和层析柱中,经洗涤缓冲液(300 mmol/L NaCl,10 mmol/L PBS,30 mmol/L咪唑,pH 8.0)充分洗柱后,用洗脱缓冲液(10 mmol/LPBS, 300 mmol /L咪唑, pH 8.0)洗脱目的蛋白,SDS-PAGE分析纯度后用PBS进行超滤除Nacl及咪唑。Bradford法进行蛋白质定量,调整浓度为1 μg/μL后分装,-80 ℃保存备用。
1.4.5制备多克隆抗体及检测抗体效价取SP2108 纯化蛋白与等体积Alum 佐剂充分混合后,经皮下多点注射免疫C57BL/6小鼠,共免疫3次,每次间隔14 d,免疫剂量10 μg/只(首次免疫剂量加倍),同时设只注射Alum佐剂阴性对照组。末次免疫后第7天经尾静脉取血,分离血清。用抗原包被液(pH 9.6的碳酸盐缓冲液)调节纯化重组SP2108蛋白浓度为10 μg/mL,加至96孔酶标板(100 μL/孔),4 ℃包被过夜;37 ℃,5%BSA封闭2 h后,用封闭液将小鼠抗SP2108血清从1∶8 000起倍比稀释,37 ℃反应1 h;洗板后,将HRP标记的羊抗鼠IgG用封闭液按1∶5 000稀释,每孔100 μL,37 ℃反应45 min;分别加入显色液A、B各50 μL后37 ℃避光反应30 min,最后加入终止液终止反应,在酶标仪上读取450 nm下的吸光度值。结果判定标准:以待测标本A450 nm/Alum佐剂对照A450 nm≥2.1判为阳性,出现阳性反应的最大稀释倍数为该抗体的滴度。
1.4.6Western Blot检测SP2108蛋白的表达将R6、 2、3、6B、14、19F型的S.pn菌株分别接种于THY液体培养基中,置5% CO237 ℃培养箱中培养至对数生长期时取2 mL菌液离心收集沉淀,PBS洗涤2次,加50 μL 1×SDS-PAGE 蛋白上样缓冲液充分混匀,沸水煮10 min后,室温最高转速离心5 min,取5 μL上清行SDS-PAGE电泳,然后转PVDF膜,经5%脱脂奶粉37 ℃封闭2 h后,加小鼠抗 SP2108血清(1∶2 000稀释)作为一抗,4 ℃摇床上孵育过夜;室温,PBST洗涤3次(10 min/次),加入 HRP标记羊抗鼠IgG(1∶5 000稀释)为二抗,室温摇床上孵育1 h;PBST洗涤3次(10 min/次)后用高灵敏化学发光检测试剂盒进行检测。E.coliBL21(DE3)作阴性对照。
1.4.7分析保守性从Genebank中查找不同型别S.pn的SP2108蛋白质氨基酸序列,用ClustalX 2.1软件分析其序列保守性。
2 结果
2.1SP2108基因的扩增PCR扩增产物行1%琼脂糖凝胶电泳后,可在1 272 bp处见清晰的扩增条带,且无非特异性条带,大小与预期一致(见图1)。

M:DNA Marker 2000; 1-2 SP2108基因扩增产物。图1 SP2108基因PCR扩增
2.2原核表达载体的构建挑取目的基因与pCold TF连接转化E.coliDH5a感受态细胞后的单个菌落行PCR,进一步提取PCR阳性菌落的重组质粒行双酶切鉴定,酶切产物经1.0%琼脂糖凝胶电泳后,可见与SP2108目的基因大小相符的酶切片段,结果见图2。测序结果与GenBank数据库中D39型S.pn菌株的SP2108基因进行比对,序列相符,提示SP2108重组质粒构建成功。
2.3重组蛋白的诱导表达及纯化转化的pCold TF-SP2108-E.coliBL21 (DE3)经 IPTG 诱导后,在相对分子量约105 KD处可见特异蛋白条带,为SP2108蛋白50 KD和pCold TF 55 KD标签蛋白之和,大小与预期相符(图3A中的第4泳道)。该蛋白主要以可溶性形式存在,经 Ni-NTA柱亲和层析纯化后,可获得高纯度的目的蛋白(图3B中的第8泳道) 。
2.4ELISA检测多克隆抗体效价将制备的重组SP2108蛋白免疫C57BL/6小鼠,采用间接ELISA法测定抗SP2108 IgG抗体的效价,其中,对照组血清几乎未检测到抗SP2108抗体,而实验组小鼠血清抗体滴度达1:8.19×106,提示SP2108蛋白能刺激小鼠产生较强的免疫应答。
2.5SP2108蛋白在不同血清型S.pn中的表达情况不同血清型S.pn菌体裂解后的上清行SDS-PAGE电泳后转膜,以抗SP2108小鼠血清为一抗,HRP标记羊抗鼠IgG为二抗进行ECL显色色鉴定,结果示:6 株S.pn菌在分子量约50 KD 处均有特异性反应条带出现,而E.coliBL21未见反应条带(见图 4)。
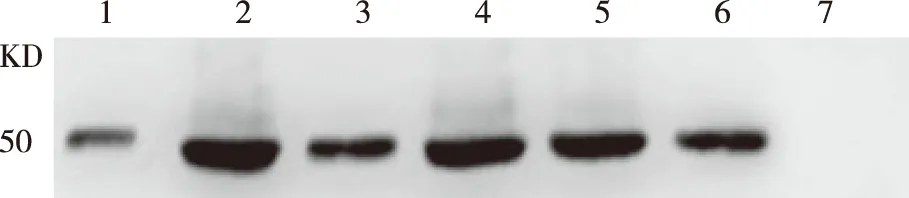
1-7:CMCC(B)31207、CMCC(B)31203、CMCC(B) 31693、TIGR4、ATCC (BAA-255) R6、NTCC7466、E.coli BL21。 图4 6种不同血清型S.pn中 SP2108 蛋白的表达分析
2.6保守性分析从Genebank数据库中查找6种国内流行血清型别(2、7F、14、15B、18A、19A)S.pn菌株中SP2108蛋白的氨基酸序列,通过ClustalX2.1软件对序列行完全比对分析,结果示SP2108蛋白在不同型别S.pn间保守性为100%,提示SP2108蛋白在我国主要流行S.pn菌株间具有较高的保守性(见图5)。

图5 不同血清型别S.pn间SP2108蛋白保守性分析
3 讨论
由于S.pn多糖疫苗和多糖蛋白结合疫苗在临床运用过程中暴露出了诸多缺点,使得S.pn蛋白质疫苗成为了当前研究的热点,而选择理想的蛋白靶点成为了S.pn蛋白疫苗研发的重心。理想的S.pn蛋白选择应包括3个方面:①保守性高,在所有S.pn血清型菌株中都表达;②免疫原性强,能对所有年龄阶段人群均引起免疫保护;③在S.pn表面表达,能在感染早期引起机体免疫应答。目前已经报道了多种S.pn表面毒力蛋白在不同小鼠模型中的保护作用,例如S.pn表面蛋白A(PspA),胆碱结合蛋白(CbpA)、表面粘附素(PasA)等,虽然它们都表达于S.pn表面,但由于其序列保守性不高,变异性大,保护效果较为局限[9-10]。因此,有必要继续筛选理想的S.pn表面毒力蛋白。
ABC转运系统是细菌质膜上转运氨基酸、磷脂、糖和肽等物质的庞大的蛋白质家族 ,是细菌跨膜转运系统的重要组成部分,其与细菌的营养代谢、渗透压维持以及耐药性关系紧密[11]。研究证实,ABC转运系统中Zn2+转运蛋白AdcA/AdcAII通过影响Zn2+平衡而影响S.pn在鼻咽部定植及毒力的发挥[12]。而关于该家族中SP2108 蛋白在细菌毒力方面的报道甚少。因此,本研究以SP2108蛋白为研究对象,成功获得了可溶性形式表达的SP2108 重组蛋白,该蛋白具有很好的免疫原性,ELISA检测其多克隆抗体效价极高,Western Blot鉴定结果示该多克隆抗体可以识别6种不同血清型S.pn菌株中的SP2108蛋白,ClustalX2.1软件分析的蛋白质氨基酸序列保守性也高达100%,初步提示该蛋白不存在抗原表位变异,具有高度的保守性,提示其可能是一个良好的候选蛋白疫苗。
本研究首次制备了纯度较好的SP2108重组蛋白和高滴度的SP2108蛋白抗体,并证实了该蛋白的免疫原性和保守性,为该蛋白疫苗的后期体内、外动物实验奠定实验基础。
[1] Kang C I, Song J H, Kim S H, et al.Risk factors and pathogenic significance of bacteremic pneumonia in adult patients with community-acquired pneumococcal pneumonia[J]. J Infect,2013,66(1): 34-40.
[2] 刘兰. 小儿肺炎患者致病菌耐药分析[J].遵义医学院学报,2011,34(1):51-53.
[3] Xue L, Yao K, Xie G,et al.Serotype distribution and antimicrobial resistance of Streptococcus pneumoniae isolates that cause invasivedisease among Chinese children[J]. Clin Infect DIS, 2010,50(5):741-744.
[4] Li G, Liang Q, Shi J,et al.Safety and immunogenicity of 23-valent pneumococcal polysaccharide vaccine in 2 to 70 year old healthy peoplein China:A phase III double blind, randomized clinical trial[J].Hum Vaccin Immunother,2015,11(3): 699-703.
[5] Weinberger D M, Malley R, Lipsitch M. Serotype replacement in disease after pneumococcal Vaccination[J]. Lancet ,2011,378(9807): 1962-1973.
[6] Paton J C, Ogunniyi A D. Evicting the pneumococcus from its nasopharyngeal lodgings[J]. Cell Host Microbe,2011,9(2):89-91.
[7] Shelburne S A, Davenport M T, Keith D B, et al.The role of complex carbohydrate catabolism in the pathogenesis of invasive streptococci[J]. Trends Microbiol,2008,16(7): 318-325.
[8] Moffitt K L, Gierahn T M, Lu Y J,et al.T(H)17-based vaccine design for prevention of Streptococcus pneumoniae colonization[J].Cell Host Microbe,2011,9(2):158-165.
[9] He X, Mc Daniel L S. The genetic background of Streptococcus pneumoniae affects protection in mice immunized with PspA[J].FEMS Microbiol Lett,2007,269(2): 189-195.
[10] Darrieux M, Goulart C, Briles D,et al.Current status and perspectives on protein-based pneumococcal vaccines[J]. Crit Rev Microbiol,2015,41(2): 190-200.
[11] Ghimire-Rijal S, Lu X, Myles D A,et al.Duplication of genes in an ATP-binding cassette transport system increases dynamic range while maintaining ligand specificity[J].J Biol Chem,2014,289(43):30090-30100.
[12] Plumptre C D, Eijkelkamp B A, Morey J R,et al.AdcA and AdcAII employ distinct zinc acquisition mechanisms and contribute additively to zinc homeostasis in Streptococcus pneumoniae[J].Mol Microbiol, 2014,91(4): 834-851.
[收稿2016-05-11;修回2016-07-12]
(编辑:王静)
Prokaryotic expression and conservative analysis of SP2108 protein fromStreptococcuspneumoniae
LuoShilu1,HuangJian2,HanDaobin1,ChenZehui2,ZhuJiehua2,MinXun2
(1.Department of Labroatory Medicine,Zunyi Medical University, Zunyi Guizhou 563099, China; 2.Department of Labroatory Medicine, Affiliated Hospital of Zunyi Medical University, Zunyi Guizhou 563099, China)
Objective To obtain purified pneumococcal SP2108 protein, and analyse its conservatism in common ofstreptococcuspneumoniae. Its feasibility as a candidate vaccine was evaluated as well.Methods The full length SP2108 gene was amplified by PCR and then subcloned into the prokaryotic expression vector TF pCold. Recombinant protein SP2108 was expressed and purified from the host bacteria of BL21(DE3). C57BL/6 mice were immunized with purified protein to produce polyclonal antibodies. The antibody titers were determined by indirect ELISA. And then the polyclonal antibodies were used to analyze the expression and conservation of SP2108 in six different types ofS.pnstrains. The amino acid sequence conservation was analyzed by ClustalX2.1 software.Results The soluble form of SP2108 protein was successfully prepared. And specific polyclonal antibodies were obtained and were used to confirm the conservatism of SP2108 protein in 6 different strains ofS.pn. The conservative of SP2108 proteins among different types ofS.pnstrain was 100%.Conclusion SP2108 protein were successful expressed inE.coliand was purified. The protein is highly conserved,which may be a ideal candidate forS.pnvaccine.
Streptococcuspneumoniae; SP2108 protein; prokaryotic expression; conservation;C57BL/6 mice
国家自然科学基金资助项目(NO:81460317);贵州省联合基金资助项目(NO:黔科合LH字[2014]7553)。
闵迅,男,博士,教授,硕士生导师,研究方向:病原微生物分子致病机制,E-mail:2815400619@qq.com。
R378.12
A
1000-2715(2016)04-0382-05
