聚乙二醇诱导金钗石斛原生质体融合条件的初步探索*
2016-11-01吴贵英储士润郑明辉
吴贵英,祝 飞,沈 访,储士润,李 林,郑明辉
(1.遵义医学院 第一临床学院,贵州 遵义 563099;2.遵义医学院 细胞生物学教研室,贵州 遵义 563099;3. 遵义医学院 寄生虫教研室,贵州 遵义 563099)
基础医学研究
聚乙二醇诱导金钗石斛原生质体融合条件的初步探索*
吴贵英1,祝飞1,沈访1,储士润2,李林2,郑明辉3
(1.遵义医学院 第一临床学院,贵州 遵义563099;2.遵义医学院 细胞生物学教研室,贵州 遵义563099;3. 遵义医学院 寄生虫教研室,贵州 遵义563099)
目的 在原生质体融合实验中筛选PEG分子量、工作浓度及孵育时间的最佳水平,为系统建立起金钗石斛原生质体融合技术体系奠定实验基础。方法 研究采用药用品质优良的贵州赤水金钗石斛与茎粗生长快的云南瑞丽金钗石斛原生质体为材料,采取单因素分析法,研究不同的聚乙二醇(PEG)分子量、浓度及孵育时间对原生质体融合率的影响。结果 PEG的分子量对原生质体融合率有显著的影响。当分子量为3 350 Da,原生质体融合率最高,为18.32%;PEG浓度为40%时,原生质体融合率最高,为18.81%;孵育时间为25 min时,原生质体融合率最高,为18.62%。结论 采用分子量为3 350 Da的PEG在浓度为40%的条件下孵育25 min时,获得的原生质体融合率最高,为18.81%。
金钗石斛;原生质体;聚乙二醇;融合率
金钗石斛(DendrobiumnobileLindl.)是我国传统名贵中药,为兰科(Orchidaceae)石斛属(Dendrobium)多年生附生草本植物[1]。其性微寒,味甘,用于热病伤津、口干烦渴、病后虚热、目暗不明、萎缩性胃炎、浅表性胃炎、慢性结肠炎等病症,是石斛明目丸、石斛浸膏溶液、石斛清胃散等制剂的重要成分[2]。现代药理研究证实金钗石斛具有治疗白内障、增强肠蠕动、免疫调节、降血糖、抗肿瘤、抗氧化、抗疲劳等作用[3-5]。此外,金钗石斛花姿优美,清香宜人,是著名的观赏花卉[6]。然而由于自身的生物学特性、生态环境的破坏、过度采挖等原因,金钗石斛野生资源日渐枯竭,已被我国列为二类珍稀濒危保护植物和珍稀濒危的中药品种,具有自然突变和优良中药性状的株系更是稀缺。因此,金钗石斛的遗传资源亟待开发利用和拓展,从拓展资源中筛选出药性成分高、中药性状好、产业化潜力大的株系,不仅有助于药性遗传品质的筛选、改良、基因工程等后续研究,还有望直接应用于生产实践,转化成经济产值。
通过杂交和倍性育种方式,可以改良植物的遗传性状,拓展其遗传资源。聚乙二醇(polyethylene glycol,PEG)细胞融合技术是常被用诱导植物细胞杂交和增加染色体组倍性最行之有效的技术方法之一。该方法具有试剂制备容易、细胞活性稳定、不需特别的仪器设备、操作方便等优点,现已成为研究细胞遗传、基因定位和培育生物新品种的重要手段[5],并普遍用于生物医药、遗传等研究领域[7]。PEG的分子质量、浓度及其孵育时间等因素是影响实验结果的最重要因素[8],本研究选用药物性状优良、源自于贵州赤水的金钗石斛和茎粗生长快的云南瑞丽金钗石斛幼嫩叶片为材料,分别酶解纯化获得原生质体后用PEG诱导这两种基因型的金钗石斛原生质体融合。比较分子量、浓度及孵育时间对PRG所诱导原生质体融合率的影响,以期筛选出PEG诱导金钗石斛原生质体融合的最适条件,为系统建立金钗石斛的原生质体融合技术体系奠定实验基础。
1 材料与方法
1.1实验材料为本实验室组培的贵州赤水金钗石斛与云南瑞丽金钗石斛幼苗的幼嫩叶片。
1.2实验试剂纤维素酶(Cellulase R-10)、果胶酶(Pectolyase Y-23)、牛血清白蛋白(BSA)、2-(N-吗啡啉)乙磺酸(MES)、荧光素双醋酸酯(FDA)为Solarbio公司产品,离析酶(Macerozyme R-10)为日本Yakult产品,聚乙二醇(PEG)为Sigma产品,其它生化试剂为国产的分析纯试剂。
1.3实验器材BS-2E恒温振荡培养箱(常州冠军仪器制造有限公司),细胞计数板(上海萃华生物科技有限公司),XD-203倒置荧光显微镜(南京江南永新光学有限公司)。
1.4实验方法
1.4.1原生质体分离
1.4.1.1预处理金钗石斛组培苗在黑暗条件下培养12 h后,取叶龄35 d的无菌苗第2~3片叶[9],分别切除叶柄和叶边缘,横向将叶片剪成1 mm左右的条,放置0.95 mol/L甘露醇溶液中,在4 ℃环境中暗处理1 h。
1.4.1.2酶液配备1 mL MES(200 mmol,pH5.7) +2.5 mL KCl(80 mmol)+5 mL甘露醇(0.8 mol) +100 mg纤维素酶+40 mg果胶酶+50 mg离析酶,无菌水定容成10 mL。55 ℃水浴10 min,冷却至室温后,再加入1 mL BSA(10 mg/mL)+400 μL CaCl2(250 mmol),用0.45 μm滤器将混合液过滤至培养皿中。
1.4.1.3酶解将预处理好的叶片放入配好的酶解液中,在摇床上黑暗处理4 h即可释放出原生质体,期间可通过倒置显微镜观察原生质体解离情况。
1.4.1.4原生质体纯化将获得的原生质体溶液经200目的细胞筛过滤,收集滤液,500 rpm离心5 min后,用洗液(5.94 g/L KCl+1.48 g/L CaCl2+1.1 g/L MES+100 g/L甘露醇)溶解沉淀物,反复离心3~5次可纯化原生质体。
1.4.1.5培养将纯化的原生质体置于培养液(1/2 MS+1.1 g/L MES+200 g/L土豆+30 g/L蔗糖+100 g/L葡萄糖+1.48 g/L CaCl2+100 g/L甘露醇+1.0 g/L BSA)中,室温下100 rpm摇床中暗培养2 h,用FDA对纯化的原生质体进行活力检测。
1.4.1.6原生质体活力率测定取20 μL纯化后原生质体滴在细胞计数板上,在明视野下观察原生质体总数。依据FDA和有活力的原生质体中的酯酶作用可释放出荧光素,并在蓝光激发下能发出黄绿色的荧光的原理来鉴定有活力的原生质体[10],分别计数原生质体总数和有活力的原生质体数3次,取平均值。原生质体的活力率=(被染色的原生质体数/原生质体总数)×100%。
1.4.2原生质体融合
1.4.2.1PEG溶液配置(以PEG浓度为40%为例)800 mg PEG-X +600 μL CaCl2(280 mmol)+ 600 μL葡萄糖(0.1%),X为PEG的分子量。
1.4.2.2PEG诱导原生质体融合将活力大于70%、浓度大于1.0×106个/g的贵州赤水和云南瑞丽金钗石斛两种原生质体按相同细胞数加入培养皿中,总原生质体和PEG溶液按2∶1体积分别滴入上述配制的PEG溶液,室温下进行融合。
细胞融合PEG分子量选择:在室温下,分别用分子量为1 500、3 350、4 000、6 000 Da的PEG作促溶剂进行融合,重复4次,分别在最适合的PEG浓度(40 %)和孵育时间(25 min)取融合后的细胞统计融合率。
细胞融合PEG浓度选择:在室温下,PEG浓度分别为36%、38%、40%、42%、44%,重复4次,分别在最适合的PEG分子量(3 350 Da)和孵育时间(25 min)取融合后的细胞统计融合率。
细胞融合孵育时间选择在室温下加入PEG,混匀后作用一定时间,本实验设置了5个时间,即11、12、13、14、15 min,再滴加与PEG等体积的CaCl2(浓度为200 mmol)混匀后,各自静置培养10、11、12、13、14 min(孵育时间为PEG作用时间+高钙助融时间),每个孵育时间重复4次,分别在最适合的PEG分子量(3 350 Da)和PEG浓度(40 %)取融合后的细胞统计融合率。
1.4.2.3洗涤将融合后的原生质体转入离心管中,500 rpm离心5 min,倒掉上清后加入洗液(5.94 g/L KCl+1.48 g/L CaCl2+1.1 g/L MES+100 g/L甘露醇)洗涤沉淀,如此反复离心洗涤沉淀3~5次即可获得去掉了PEG融合剂的原生质体。
1.4.2.4融合细胞的鉴定与计数细胞观察与计数同1.4.1.6。

2 结果
2.1不同分子量PEG对金钗石斛原生质体融合的影响在PEG浓度为40%和融合时间为25 min的条件下,PEG不同分子量对金钗石斛原生质体融合的影响(见表1)。随着PEG分子量的增加,融合率从1 500 Da的8.04%增加到3 350 Da时的18.32%。但当PEG的分子量增加到4 000或6 000 Da时,融合率均低于18.32%。说明3 350 Da是PEG诱导金钗石斛原生质体融合最佳的PEG分子量。
2.2不同浓度PEG对金钗石斛原生质体融合的影响在PEG分子量为3 350 Da和融合时间为25 min的条件下,PEG浓度为36%~40%时,原生质体融合率从12.79%增加到18.81%。当PEG浓度高于40%原生质体融合率则降低,说明PEG40%浓度是PEG诱导金钗石斛原生质体融合的最佳浓度(见表1)。
表1不同PEG分子量、浓度和孵育时间下的金钗石斛原生质体融合率
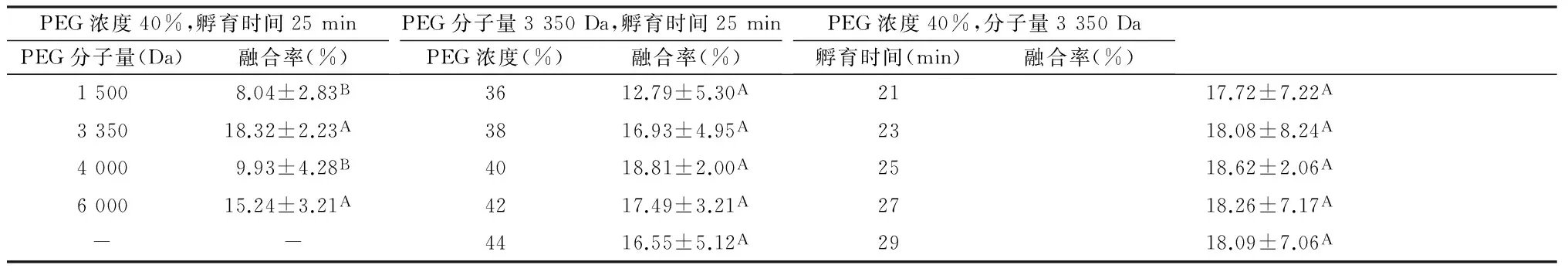
PEG浓度40%,孵育时间25minPEG分子量(Da)融合率(%)PEG分子量3350Da,孵育时间25minPEG浓度(%)融合率(%)PEG浓度40%,分子量3350Da孵育时间(min)融合率(%)15008.04±2.83B3612.79±5.30A2117.72±7.22A335018.32±2.23A3816.93±4.95A2318.08±8.24A40009.93±4.28B4018.81±2.00A2518.62±2.06A600015.24±3.21A4217.49±3.21A2718.26±7.17A--4416.55±5.12A2918.09±7.06A
不同大写英文字母表示同列数据在0.01水平有统计学意义。
2.3PEG不同孵育时间对金钗石斛原生质体融合的影响在PEG浓度为40%和PEG分子量为3 350 Da的条件下,原生质体融合率从孵育21 min的17.72%增到25 min的18.62%。当孵育时间进一步延长而原生质体融合率又逐渐降低。说明孵育25 min是最佳孵育时间(见表1)。
3 讨论
PEG可以破坏和干扰各类细胞的膜结构,使两细胞相互接触部位的膜脂双层中磷脂分子发生疏散,进而使其结构发生重排,再加上膜脂双层的相互亲合以及彼此间表面张力的作用,引起相邻的重排质膜在修复时相互合并在一起,进而导致两细胞的胞质沟通、融合。PEG可与水分子借氢键结合,在高浓度的PEG溶液中自由水消失,导致细胞脱水而发生质膜结构的变化,引起细胞融合,为了发挥PEG促进细胞融合的效力,必须采用较高浓度的PEG溶液,但在高浓度PEG溶液下,细胞可能因脱水而受到显著的破坏。
有研究发现细胞的融合率与PEG的相对分子质量及其质量分数呈正比[11],但PEG的分子量越小,融合率越低;PEG的分子量越大,对细胞的毒性就越大。然而本实验用4种不同分子量的PEG(即1 500、3 350、4 000、6 000 Da)作为影响因素,选用4种不同分子量的PEG,其对应的融合率差异显著,证明PEG的分子量对金钗石斛的融合率有着显著性的影响,是影响原生质体融合的关键因素之一。综上可以看出,选用适宜分子量的PEG能促进金钗石斛原生质体的融合效率。
前人的研究表明,PEG浓度对原生质体融合起一定影响[12]。PEG浓度较低使原生质体融合率较低,随着浓度增加,虽然原生质体的融合几率增加,但浓度的增加也使得更多的融合子受到毒害,浓度过高会导致原生质体皱缩甚至中毒,融合子的存活率降低[13]。本研究表明:PEG浓度对融合率无显著影响。但当PEG浓度增加到为40%时,原生质体融合率最高,当PEG浓度继续增加,原生质体融合率就逐渐降低。故40%是PEG诱导金钗石斛原生质体融合的最佳浓度。
有研究报道随着融合时间的延长,融合率反而有所下降,这可能是因为PEG作用时间过长,对细胞毒害太大,导致了更多融合细胞变形甚至破裂所致。本研究发现,当孵育时间从21 min到25 min时原生质体的融合率略有升高,25 min到29 min时略有下降,故此随时间推移原生质体的融合率未发生显著变化,这与马云等[5]、王惠等[14]、赵彦禹等[15]的研究结果一致。
本研究对PEG诱导金钗石斛原生质体融合的研究,采用药用品质优良的贵州赤水金钗与茎粗生长快的云南瑞丽金钗石斛幼苗的幼嫩叶为材料,采取单因素分析的方法,摸索不同分子量的PEG、不同PEG浓度及PEG不同孵育时间对原生质体融合率的最佳条件。结果显示PEG诱导细胞融合受很多因素的影响,只要控制好分子质量、调节适当的浓度和孵育时间范围,就能获得较高的细胞融合率。当然,对于其他不同影响因素,其最适融合条件之间的差别还有待于进一步研究探讨。
[1] 李静婷,牛磊,侯玉杰.金钗石斛的快速繁殖研究[J].湖北农业科学,2014,53(9):2181-2184.
[2] 王琳,叶庆生,刘伟.金钗石斛研究概况[J].亚热带植物科学,2004,33(2):73-76.
[3] 杨虹,王顺春,王峥涛,等.铁皮石斛多糖的研究[J].中国药学杂志,2004,39(4):254-256.
[4] 张晓敏,孙志蓉,陈龙,等.金钗石斛的化学成分和药理作用研究进展[J].中国现代应用药学,2014,31(7):895-899.
[5] 马云,何昆,王晓玉,等.PEG诱导鸡红细胞融合影响因素探讨[J].德州学院学报,2011,27(2):54-58.
[6] 周俊.石斛的历史、分布与功能[J].中国药学杂志,2013,48(19):1609.
[7] 张晓红,夏光敏,陈永喆.青苗碱谷与高冰草的体细胞杂交及杂种性质鉴定[J].山东大学学报:理学版,2005,40(5):107-112.
[8] 陈文强,王进,邓百万,等.秦巴山区黑木耳主要栽培种内原生质体分离与融合[J].食品与生物技术学报,2014,33(8):856-864.
[9] 蔡肖,康向阳.小青杨叶肉原生质体分离条件的研究[J].中国农学通报,2011,27(10):18-22.
[10] 黄纯农.用FDA-PI双色荧光法鉴定大麦原生质体活性[J].细胞生物学杂志,1988,10(3):133-135.
[11] 严镇钧,张小兵.聚乙二醇介导细胞融合的优化条件探究[J].湖北师范学院学报:自然科学版,2014,34(1):14-19.
[12] 赵小强,马晖玲,周万海,等.草地早熟禾原生质体培养与融合[J].核农学报,2010,24(4):737-743.
[13] 江力,黄健威,慈凌坤,等.茶树菇与鸡腿菇原生质体融合及再生[J].食品科学,2011,32(1):141-144.
[14] 王惠,郭峰,关超,等.PEG介导细胞融合最适条件的探讨[J].动物医学进展,2012,33(12):145-148.
[15] 赵彦禹,张艳华,冯照军.鸡红细胞融合最适条件的探讨[J].生物磁学,2006,6(1):43-44.
[收稿2016-04-20;修回2016-06-10]
(编辑:王静)
The priminary study of screening the optimum condition during the protoplast fusion inDendrobiumnobilewithpolyethylene glycol
WuGuiying1,ZhuFei1,ShenFang1,ChuShirun2,LiLin2,ZhengMinghui3
(1.The First Clinical College of Zunyi Medical University, Zunyi Guizhou 563099, China; 2.Department of Cell Biology of Zunyi Medical University, Zunyi Guizhou 563099, China; 3. Department of Parasite of Zunyi Medical University, Zunyi Guizhou 563099, China)
Objective To systemically construct the protocol of protoplast fusion inDendrobiumnobileLindl, the optimum levels both of molecular weight and concentration of polyethylene glycol (PEG)and of incubation time were screened during the fusion process.Methods In the current study, twoD.Nobilelandraces were applied as the material. One was originated from Chishui County of Guizhou Province with higher medical quality; another was from Ruili City of Yunnan Province with faster growing and larger stem diameter. The single factor analysis method was adopted as the experimental design and the protoplast fusion rate was selected as the criterion to screen the optimum levels of PEG molecular weight, PEG concentration and incubation time during the fusion experiment.Results The molecular weight of PEG significantly affected the protoplast fusion rate. The rate got the highest value as 18.32%, 18.81% 18.62%, when the molecular weight of PEG was 3 350 Da, PEG concentration was 40% and the incubation time was 25 min, individually.Conclusion The protoplast fusion rate could reach the highest value of 18.81% under the conditions of the PEG molecular weight was 3 350 Da, the concentration was 40% and the incubation time was 25 min.
Dendrobiumnobile; protoplast; polyethylene glycol; fusion rate
贵州省中药现代化科技产业研究开发专项(NO:黔科合ZY字[2013]3002);贵州省科技厅、遵义医学院、遵义市科技局联合基金重点项目(NO:黔科合LH字[2014]7549);贵州省教育厅2014年大学生创新创业训练计划项目(NO:201410661007);遵义医学院2013年大学生创新创业训练计划项目(NO:院发[2013]6524);遵义医学院招标项目(NO:F-611、F-551)。
郑明辉,男,博士,副教授,研究方向:中药材遗传育种,E-mail:ivying0209@hotmail.com。
R394.2
A
1000-2715(2016)04-0362-04
