腹壁切口疝大鼠动物模型的建立与评价*
2016-11-01张仕斌雷凤琴杨胜波
张仕斌,雷凤琴,杨胜波
(1.遵义医学院 实验动物中心,贵州 遵义 563099;2.遵义医学院 人体解剖学教研室,贵州 遵义 563099)
基础医学研究
腹壁切口疝大鼠动物模型的建立与评价*
张仕斌1,雷凤琴1,杨胜波2
(1.遵义医学院 实验动物中心,贵州 遵义563099;2.遵义医学院 人体解剖学教研室,贵州 遵义563099)
目的 建立大鼠腹壁切口疝小动物模型,为腹壁疝修补术及疝补片材料评估提供材料和方法。方法 将12只成年雄性SD大鼠随机分为两组(一期修复组和二期修复组),每组6只,均以下腹部正中部位切除3 cm × 2 cm全层腹壁组织的方法建立切口疝模型,其中一期修复组于建模后直接用补片修复,二期修复组于建模1周后切开原切口再用补片修复,两组均使用商业化聚丙烯补片对切口进行无张力修复评估。术后每天观察动物有无伤口感染及疝复发等并发症,两组均于补片修补术30 d后处死动物,取补片连同周围组织作大体及组织病理学观察。结果 一期修复组术后恢复良好,外观无可见并发症;二期修复组在术后1周表现出典型的切口疝,经修复后愈合良好,未发生伤口感染、疝复发等并发症;组织病理学表明补片与周围组织生物相容性良好,两组间在炎症反应、纤维增生和新生血管生成方面无明显差异。结论 大鼠腹部切除3 cm × 2 cm全层腹壁组织制作切口疝模型操作简便、重复性好,可为腹壁疝修补术及疝补片材料的评估提供简单有效的小动物模型。
切口疝;SD大鼠;动物模型
腹壁疝是腹部外科常见病症,临床上多采用补片以无张力修补的方式进行治疗。随着材料学的发展,各种疝补片材料及手术方式被用于腹壁疝修复重建的研究当中[1-3]。腹壁疝动物模型在各种疝修复手术及补片材料的评估中具有不可替代的作用。目前,腹壁疝模型的建立多采用大动物制作切口疝的方式进行[4-7],但缺乏成本更低、操作简便的小动物模型以供研究所需。本研究探索通过在大鼠腹部切除全层腹壁组织的方式制备小动物腹壁疝模型,并对这一模型的可靠性和价值进行评价,希望制作出简单有效、重复性好的腹壁疝小动物模型。
1 材料与方法
1.1实验动物及分组SPF级成年雄性SD大鼠12只,由重庆第三军医大学实验动物中心提供[实验动物生产许可证编号:SCXK(渝)2012-0005]。根据手术时间的不同将动物随机分为一期修复组和二期修复组,每组6只。
1.2方法术前12 h禁食,自由饮水,每只大鼠以3%戊巴比妥钠按0.1 g/kg的剂量腹腔注射麻醉,麻醉生效后固定于手术台,腹部剃毛后用2%碘酊消毒,75%酒精脱碘,铺无菌手术巾,下腹部正中行纵切口切开皮肤长约4 cm,钝性分离皮肤与肌肉组织后切除3 cm×2 cm大小腹壁全层组织以造成腹壁缺损。一期修复组在切除腹壁组织后直接用商业化聚丙烯补片修复腹壁缺损,补片大小为3.5 cm×2.5 cm,将补片覆盖缺损区,补片4周与缺损边缘腹壁组织缝合,最后缝合皮肤(见图1)。二期修复组在切除腹壁组织后直接缝合皮肤,1周后再次手术,大鼠麻醉、备皮后按原切口切开,暴露疝囊和疝环口,再采用一期修复组相同的方式进行切口疝修补。
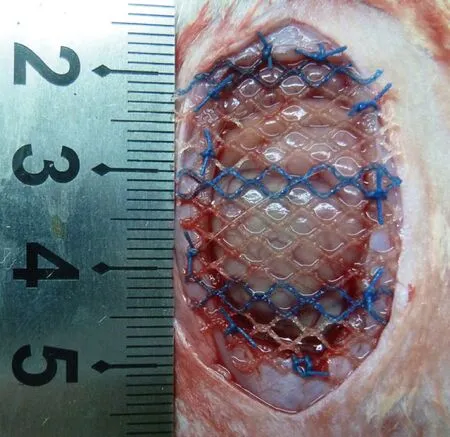
切除3 cm×2 cm全层腹壁组织后用聚丙烯网片修补图1 大鼠切口疝建模与补片修补
1.3指标观察①大体观察:手术后每天观察有无切口感染、疝复发及动物死亡等;②组织病理学检查:两组均在补片修补术后30 d处死动物,取补片及周围组织常规制作病理切片,HE染色,置光镜下观察。
2 结果
2.1大体观察结果两组在手术过程中及术后均无动物死亡;一期修复组手术后均恢复良好,无切口感染,无皮下肿及疝复发(见图2);二期修复组在制模后第2天开始腹部切口处出现隆起,第7天时均形成典型的切口疝(见图3),经补片无张力修复后均恢复良好,无切口感染,无皮下肿及疝复发;补片修补术后30 d解剖取样发现,两组动物在补片材料与腹腔内肠系膜组织等有轻度或中度粘连(见图4),但均可钝性分离。
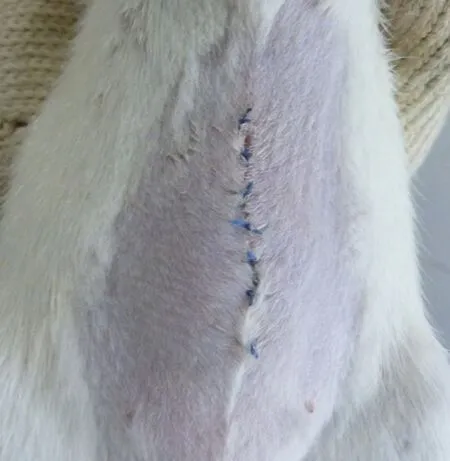
图2 大鼠切口疝模型一期修复组手术后7 d腹部外观正常
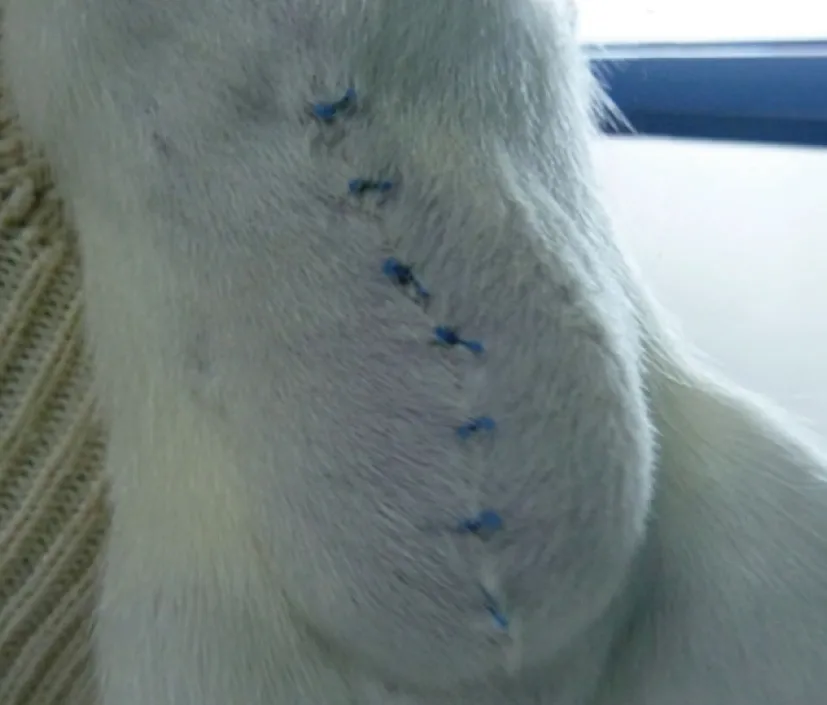
图3 大鼠切口疝模型二期修复组建模后7 d腹部形成典型切口疝
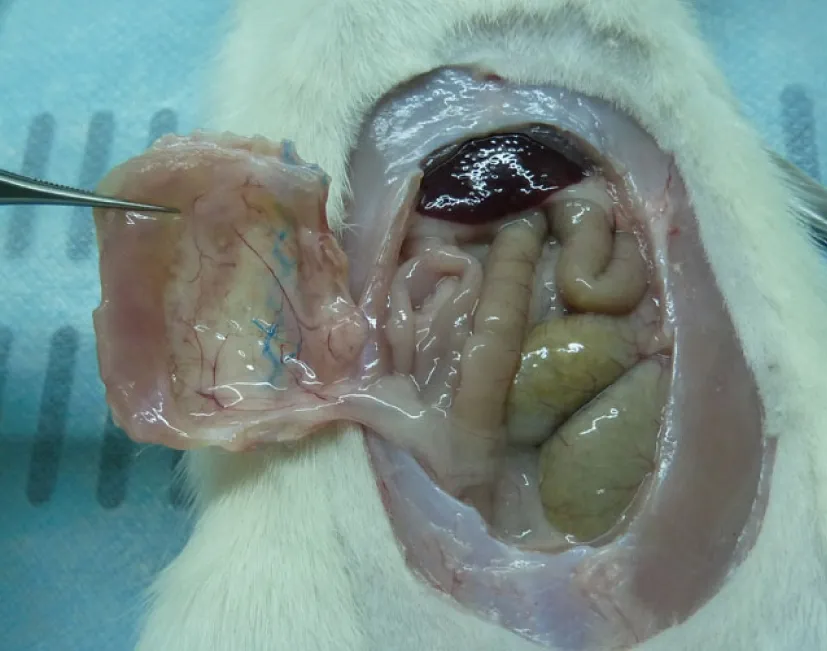
图4 切口疝模型大鼠手术修复30 d后补片材料与肠系膜组织轻度粘连
2.2病理结果如图5所示,手术30 d后病理结果显示聚丙烯网片材料周围有较多的巨噬细胞,同时周边有增生的成纤维细胞、胶原沉积及新生的薄壁毛细血管,散在分布有中性粒细胞浸润。两组间病理结果无明显差异。结果表明手术30 d后组织重建良好,组织反应主要以慢性炎症反应为主。
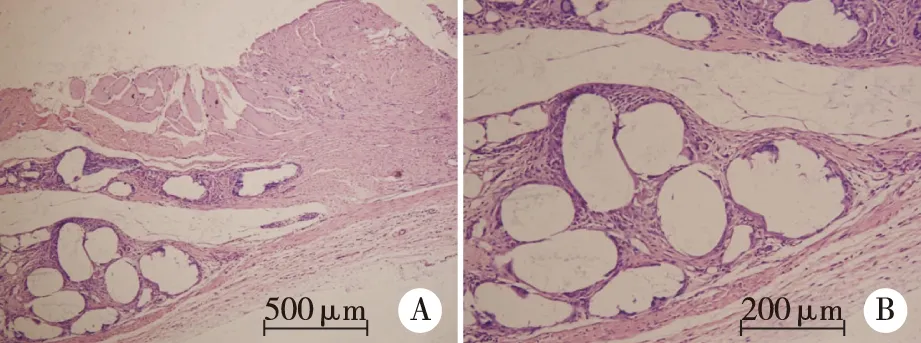
A:HE×100;B:HE×200。图5 聚丙烯补片材料与周围组织组的组织学形态
3 讨论
动物模型在各种疝补片材料及其修补手术的评估和应用研究中具有重要的作用。目前,腹壁疝动物模型的建立大多采用实验猪和兔等大动物制作切口疝的方式[4-7],缺乏成本更低、操作简便的小动物模型。本研究通过在大鼠腹部切除3 cm×2 cm全层腹壁组织,再使用商业化聚丙烯补片对腹壁缺损进行无张力修复评估,结果表明这一制作切口疝小动物模型的方法操作简便,成功率高且可重复性好。
腹壁疝动物模型的建立需要切除合适大小的腹壁组织[4]:切除腹壁组织过小,手术后愈合过程中因肌肉形成皱缩瘢痕填补腹壁缺损而使内脏组织不易突出,疝形成的成功率不高;切除腹壁组织过大,疝包块突出明显,但动物术后恢复较差且易死亡;只有切除合适大小的腹壁组织,才能既保证动物的存活同时也获得稳定的模型。已有实验研究表明,实验猪和兔等切口疝大动物模型均以切除3 cm×3 cm大小腹壁组织为宜[4-7]。由于大鼠体型小,不足以切除3 cm×3 cm大小的腹壁组织,但大鼠腹壁组织相比大动物要薄,其抗张力也较弱,因此,本研究以尽可能大的面积切除了3 cm×2 cm腹壁组织,在本研究的二期修复组,所有动物均形成了典型的切口疝且动物无死亡。
腹壁疝动物模型的建立,主要应用是为了评估各种疝补片材料或修补手术的实际效果。在相关实验研究中,实验猪及兔等腹壁疝大动物模型的建模方法相对成熟,其模型的建立及应用多采用一期修复的方法,即在切除腹壁组织后直接手术修补,不需对动物是否形成疝再进行观察和评估。本研究为了探索大鼠腹壁疝模型建立的合适方法,实验增加了二期修复组,以观察和评估切除腹壁组织后大鼠成疝的实际情况。结果表明,大鼠腹部切除3 cm×2 cm腹壁组织后1周内均可形成典型的切口疝。本研究还比较了二期修复组与一期修复组在手术30 d后解剖大体观察及病理检测的情况,两组间并无明显差异。因此,以上结果表明,疝模型的建立方法一经评估合适,在实际应用疝模型评估疝补片或修补手术的实验研究中,确实没有必要采用二期修复的方法,而直接采用一期修复的方法既简单有效,又缩短了实验周期。
补片材料植入机体后引起的组织学反应一般分为四期:术后7 d内为急性炎症反应期,主要特点是炎症细胞增多,同时伴有血管增生和肉芽组织形成等强烈的炎症反应;二期为术后7~14 d,具有较多巨噬细胞和肉芽组织;三期为术后14~28 d,急性炎症反应消失,转为组织细胞和巨噬细胞增多的慢性炎症反应;四期为术后28 d后,组织重建基本完成,在被较厚纤维组织包裹的补片外表面存在巨噬细胞[8]。本研究使用的聚丙烯网片是目前临床上使用广泛的一类商业化疝补片,具有价格便宜,易于操作且炎症反应较轻、有利于新生血管生成及组织重建等优点[3, 9-10]。本研究检测了疝模型大鼠植入聚丙烯网片30 d后的组织反应情况,发现网片周围组织重建良好,仍存在以慢性炎症为主的异物反应,其结果与文献报道基本相符。
[1] Klinge U, Weyhe D. Hernia surgery: minimization of complications by selection of the "correct mesh"[J]. Chirurg, 2014,85(2):105-111.
[2] Bellows C F, Smith A, Malsbury J, et al. Repair of incisional hernias with biological prosthesis: a systematic review of current evidence[J]. American Journal of Surgery,2013,205(1):85-101.
[3] Bilsel Y, Abci I. The search for ideal hernia repair; mesh materials and types[J]. International Journal of Surgery, 2012,10(6):317-21.
[4] 陈思宇, 赵渝, 蒙喜云, 等. 家兔腹壁疝模型建立及其判定标准的探索研究[J]. 重庆医科大学学报,2014,38(9):1321-1324.
[5] 邓美海, 林楠, 胡昆鹏, 等. 猪切口疝模型的建立及使用生物型补片修补的研究[J]. 中华实验外科杂志,2008,25(10):1260-1261.
[6] 杨硕, 申英末, 钟杏霞,等. 感染型猪腹壁切口疝模型的建立和聚丙烯复合脱细胞基质材料新型补片耐受感染能力的实验研究[J]. 中华疝和腹壁外科杂志:电子版,2014(5):7-10.
[7] 张荣, 吴氢凯, 罗来敏. 丝蛋白涂层轻质聚丙烯网片对兔腹壁疝模型组织学反应的影响[J]. 国际妇产科学杂志,2012,39(3):281-283.
[8] Kaupp H A, Matulewicz T J, Lattimer G L, et al. Graft infection or graft reaction [J].Archives of Surgery, 1979,114(12):1419-1422.
[9] Procter L, Falco E E, Fisher J P, et al. Abdominal wall hernias and biomaterials[J]. Bioengineering Research of Chronic Wounds, 2008(1):425-447.
[10] Cozad M J, Grant D A, Bachman S L, et al. Materials characterization of explanted polypropylene, polyethylene terephthalate, and expanded polytetrafluoroethylene composites: Spectral and thermal analysis[J]. Journal of Biomedical Materials Research Part B Applied Biomaterials, 2010,94(2):455-462.
[收稿2016-05-12;修回2016-06-20]
(编辑:王静)
Establishment and evaluation of a rat model of abdominal incision hernia
ZhangShibin1,LeiFengqin1,YangShengbo2
(1.Laboratory Animal Center, Zunyi Medical University, Zunyi Guizhou 563099, China;2.Department of Human Anatomy, Zunyi Medical University, Zunyi Guizhou 563099, China)
Objective To establish a stable and effective small animal model of abdominal incision hernia.Methods Adult male SD rats underwent full-thickness abdominal wall tissues resection by size of 3 cm×2 cm to establish the incisional hernia model and were randomly divided into two groups including one-stage operation group and second-stage operation group. The incisional hernias were repaired with polypropylene meshes in the one-stage operation and second-stage operation respectively.The complication of infection of incisional wound and recurrence of hernia were investigated each day after operation. Thirty days later, all the rats were sacrificed and the full-thickness sections of abdominal wall were evaluated by macroscopical examination and histological observation.Results There were no visible complications in the one-stage operation group. In the second-stage operation group, the typical incisional hernia were observed one week after model establishment, and there were no complications such as infection of incisional wound or recurrence of hernia after repaired.Histopathological examination showed no significant differences between two groups.Conclusion Removal of abdominal wall tissues by size of 3 cm×2 cm in rat can build a stable and effective small animal model of abdominal incision hernia.
abdominal incision hernia; SD rat; animal model
国家自然科学基金资助项目(NO:31540031)。
杨胜波,男,教授,硕士生导师,研究方向:骨骼肌运动生理与周围神经损伤,E-mail:yangshengbo8205486@163.com。
R33-3
A
1000-2715(2016)04-0378-04
