载牛血清白蛋白壳聚糖微球的制备及其体外释药特性评价
2016-10-31李思阳朱吉人孔庆新
李思阳,朱吉人,孔庆新,王 洋
(1.江苏食品药品职业技术学院,江苏淮安 223003;2.东北林业大学,黑龙江哈尔滨 150040)
载牛血清白蛋白壳聚糖微球的制备及其体外释药特性评价
李思阳1,朱吉人1,孔庆新1,王洋2,*
(1.江苏食品药品职业技术学院,江苏淮安 223003;2.东北林业大学,黑龙江哈尔滨 150040)
目的:优化载牛血清白蛋白壳聚糖微球的制备工艺,并考察其体外释药特性,从而提高蛋白药物的稳定性,控制其释放速度,延长药物作用时间,提高药物生物利用度。方法:以高分子天然材料壳聚糖为载体,以离子凝胶法制备载牛血清白蛋白壳聚糖微球,通过单因素实验和正交实验设计优化制备工艺,并考察其体外释放特性。结果:扫描电子显微镜观察载牛血清白蛋白壳聚糖微球具有明显的球状结构;其最佳制备工艺为:壳聚糖分子量为300 ku、三聚磷酸钠浓度为10 mg/mL、壳聚糖浓度为3 mg/mL、牛血清白蛋白用量为30 mg,制备的微球载药率可达30.13%,体外释放可持续48 h,累积释放率达到70%,具有良好的缓释效果。结论:载牛血清白蛋白壳聚糖微球具有较高的载药量,缓释效果明显,为壳聚糖作为药物缓控释载体的进一步研究提供依据。
壳聚糖,牛血清白蛋白,微球,制备,释放
多肽及蛋白类物质在治疗、诊断各种疾病方面发挥着重要作用,但由于大多数蛋白类药物存在稳定性差,半衰期短,生物利用率较低等缺陷,因此限制了其临床应用[1]。因此,这类药物在修饰结构、改进剂型、新型药物载体系统以及给药方式改变等方向的研究成为关注的热点[2]。
微球(Microspheres)是一种骨架型的微粒,是液体或固体类药物分散和(或)溶解于高分子材料中,其粒径大小通常在1~250 μm之间,呈类球形或球形微粒[3-5]。微球作为一种新型缓释载体传递系统,具有靶向作用、降低机体免疫反应以及药物在靶组织中可以维持较高的浓度等特点,不仅在多肽和蛋白质药物给药系统研究方向上突显优越性[6],而且在食品领域也有广泛的应用,如固定化酶[7]、食品微生物检验[8]等。
壳聚糖是甲壳素脱乙酰衍生物,是一种带正电荷的直链多糖,具有生物黏附性和生物相容性好、毒性低、同时兼有较强的粘附作用[9-11]。因此,使用具有负载、靶向、缓释、控释等作用的壳聚糖作为药物载体材料具有天然的优势[12-14]。
本研究以壳聚糖为载体,以离子凝胶法制备载牛血清白蛋白壳聚糖微球,优化其制备工艺,探讨其体外释放特性,使其达到一种长期平稳缓释的效果,为其他多肽及蛋白质类药物壳聚糖微球的研究提供借鉴。
1 材料与方法
1.1材料与仪器
壳聚糖(分子量3、50、300、1000 ku)济南海得贝海洋生物工程有限公司;牛血清白蛋白(批号:1074)MP生物医学;其他试剂均为市售分析纯。
FEI QUANTA 200扫描电子显微镜美国FEI公司;DG5033A型酶联免疫检测仪南京华东电子集团医疗装备有限责任公司;5810R型离心机德国eppendorf公司;Vortex-6型旋涡混合器江苏海门其林贝尔仪器制造有限公司。
1.2实验方法
1.2.1牛血清白蛋白标准曲线的绘制考马斯亮蓝G-250染液的配制:将3 mg考马斯亮蓝G-250溶于1.25 mL 95%乙醇,加入2.5 mL浓磷酸,待染料充分溶解后,用滤纸过滤,定容至25 mL,备用。
精密称取20 mg牛血清白蛋白粉末置于1.5 mL离心管,以1 mL去离子水溶解,摇匀即得浓度为20 mg/mL的牛血清白蛋白标准溶液,将其稀释至成0.2 mg/mL的牛血清白蛋白标准溶液。将0.2 mg/mL的牛血清白蛋白标准溶液分别稀释至0、0.04、0.08、0.12、0.16 mg/mL系列对照品溶液。取3份上述浓度的牛血清白蛋白标准溶液50 μL分别置于96孔板同一排相邻孔中,分别加入200 μL考马斯亮蓝G-250备用染液,充分振荡,于10 min内用酶标仪测定595 nm处吸光度A[15-16]。以牛血清白蛋白浓度为横坐标,吸光度为纵坐标绘制标准曲线。
1.2.2载牛血清白蛋白壳聚糖微球的制备将醋酸溶液稀释至1%,加一定量壳聚于1%的醋酸溶液中,充分搅拌至壳聚糖完全溶解,即配制成一定浓度的壳聚糖醋酸溶液。取配制的壳聚糖醋酸溶液20 mL置于50 mL离心管中,加入一定量牛血清白蛋白粉末,充分搅拌至牛血清白蛋白完全溶解。然后,室温高速搅拌下缓慢滴加一定浓度的三聚磷酸钠溶液4 mL,反应1 h,得到载牛血清白蛋白壳聚糖微球混悬液。将该混悬液10000 r/min离心3 min,取上清备用。再用去离子水洗涤沉淀三次,烘干称重,即成功制备载牛血清白蛋白壳聚糖微球。
1.2.3载药率的测定将“1.2.2中”得到的上清分别定容,以不加牛血清白蛋白制备空白壳聚糖微球获得的上清做空白对照,用2.1的方法测595 nm处吸光度,计算上清牛血清白蛋白的质量,计算载药率。
载药率(%)=[(Wa-Ws)/W总]×100
Wa:投药量;Ws:上清液中含药量;W总:载药微球总质量,即沉淀质量。
1.2.4扫描电子显微镜观察称取适量微泡沉淀样品于离心管中,加入少量去离子水,涡旋,使沉淀分散均匀,取50 μL悬浊液置于铝片上,涂抹均匀,喷金,在扫描电镜图像在12.5 kV、9.5 mm工作距离的阳离子加速电压下扫描图像。
1.2.5载牛血清白蛋白壳聚糖微球单因素实验
1.2.5.1壳聚糖分子量对载牛血清白蛋白壳聚糖微球成球性的影响分别选取分子量为3、50、300 1000 ku的壳聚糖分别制备浓度为5 mg/mL的醋酸壳聚糖溶液20 mL,分别加入2 mg牛血清白蛋白,充分搅拌至牛血清白蛋白完全溶解。在室温高速搅拌下,向上述溶液中分别缓慢滴加浓度为10 mg/mL的三聚磷酸钠溶液4 mL,搅拌反应1 h。
1.2.5.2壳聚糖和三聚磷酸钠浓度对载牛血清白蛋白壳聚糖微球成球性的影响制备浓度分别为1、2.5、5、7.5、10 mg/mL的醋酸壳聚糖溶液20 mL。向上述不同浓度醋酸壳聚糖溶液中分别加入2 mg牛血清白蛋白,充分搅拌至牛血清白蛋白完全溶解。在室温高速搅拌下,分别向上述不同浓度牛血清白蛋白醋酸壳聚糖溶液中缓慢滴加浓度分别为2.5、5、10、15、20、30 mg/mL的三聚磷酸钠溶液4 mL,搅拌反应1 h。
1.2.5.3牛血清白蛋白用量对载牛血清白蛋白壳聚糖微球载药率的影响用分子量为50 ku的壳聚糖制备浓度为5 mg/mL的醋酸壳聚糖溶液,分别加入质量为2、5、10、15、20、30 mg牛血清白蛋白粉末,充分搅拌至牛血清白蛋白完全溶解。高速搅拌下缓慢滴加浓度为10 mg/mL三聚磷酸钠溶液4 mL,继续搅拌反应1 h。按“1.2.3项下内容”测载药率(n=3)。
1.2.6正交实验根据单因素实验结果,以载牛血清白蛋白壳聚糖微球载药率为考察指标,选取影响载牛血清白蛋白壳聚糖微球成球性及载药率的壳聚糖分子量、壳聚糖浓度、三聚磷酸钠浓度以及牛血清白蛋白用量4个因素,各取3个水平,进行L9(34)正交实验设计(表1),以确定载牛血清白蛋白壳聚糖微球的最佳制备工艺,并进行验证实验。
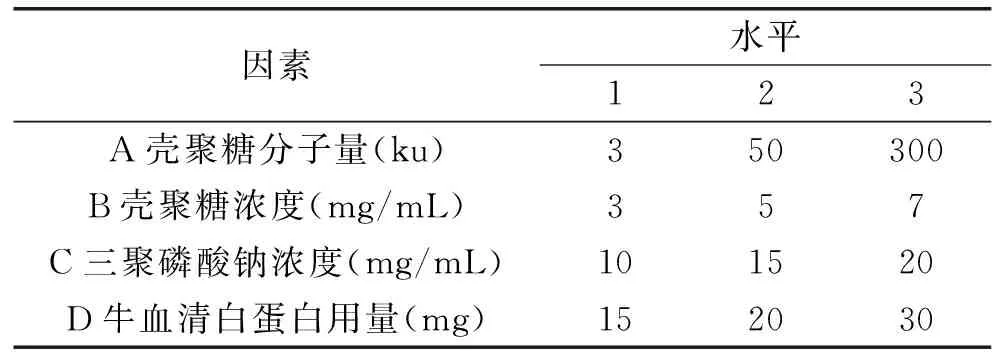
表1 L9(34)正交实验因素水平表
1.2.7体外释药特性评价
1.2.7.1牛血清白蛋白PBS标准曲线绘制精密称取5 mg 牛血清白蛋白粉末,PBS缓冲液定容至25 mL,得到0.2 mg/mL母液。母液用PBS溶液分别稀释至0.02、0.04、0.06、0.08、0.1 mg/mL系列对照品溶液。取3份上述浓度的牛血清白蛋白对照品溶液50 μL分别置于96孔板同一排相邻孔中,分别加入200 μL考马斯亮蓝G-250备用染液,充分振荡,于10 min内用酶标仪测定595 nm处吸光度A[15-16]。以牛血清白蛋白浓度为横坐标,吸光度为纵坐标绘制标准曲线。

表4 分子量300 ku壳聚糖及三聚磷酸钠浓度对成球性的影响
1.2.7.2体外释放精密称取5 mg载牛血清白蛋白冻干粉末样品于10 mL离心管中,加入5 mL去离子水,待涡旋混匀后,吸取1 mL溶液于透析袋内密封。透析袋置于25 mL PBS(pH7.4)释放介质中,用于模拟人体内环境,37 ℃恒温培养箱中磁力搅拌,在0、0.5、1、1.5、2、2.5、3、4、5、6、8、10、12、18、24、36、48 h时间点分别取3 mL释放液并补充相同体积的新鲜释放液。用酶标仪测定595 nm处吸光度,通过“1.2.7.1”标准曲线计算出释放液中牛血清白蛋白的含量,计算出累积释放率。
2 结果与讨论
2.1牛血清白蛋白标准曲线
以牛血清白蛋白浓度C为横坐标,吸光度A为纵坐标绘制标准曲线,得到标准曲线方程:y=5.1724x+0.043,R2=0.9928,结果表明,牛血清白蛋白在0~0.16 mg/mL浓度范围内线性关系良好。
2.2载牛血清白蛋白壳聚糖微球单因素实验
2.2.1壳聚糖分子量对载牛血清白蛋白壳聚糖微球成球性的影响壳聚糖分子量对载牛血清白蛋白壳聚糖微球成球性的影响结果如表2,可以看出,相同浓度壳聚糖醋酸溶液,随着壳聚糖分子量的升高,壳聚糖醋酸溶液越黏稠,产生的壳聚糖微球颗粒越大。由于分子量为1000 ku的壳聚糖溶液粘度过大,不适合制备小粒径的壳聚糖微球,所以壳聚糖分子量取3、50、300 ku较适宜。
2.2.2壳聚糖和三聚磷酸钠浓度对载牛血清白蛋白壳聚糖微球成球性的影响由于壳聚糖分子量越大,同一浓度壳聚糖醋酸溶液越黏稠,所以取分子量为3、300 ku的壳聚糖分别做壳聚糖浓度对载牛血清白蛋白壳聚糖微球成球性的影响实验,结果见表3,表4。

表3 分子量3 ku壳聚糖及三聚磷酸钠浓度对成球性的影响
由表3可以看出,壳聚糖浓度与三聚磷酸钠浓度均较低时,无微球生成;壳聚糖浓度与三聚磷酸钠浓度均较高时,产生大量微球。壳聚糖浓度为1 mg/mL时,无论三聚磷酸钠浓度为多少,都无微球生成。三聚磷酸钠浓度小于等于5 mg/mL时,无论分子量为3 ku的壳聚糖浓度为多少,都无微球生成。所以分子量为3 ku的壳聚糖浓度取2.5~10 mg/mL,三聚磷酸钠浓度取10~30 mg/mL制备载牛血清白蛋白壳聚糖微球比较合适。
由表4可以看出,随着壳聚糖浓度和三聚磷酸钠浓度的升高,产生的微球越多,微球的颗粒越大。当分子量为300 ku的壳聚糖浓度为1 mg/mL时,无论三聚磷酸钠浓度为多少,都无微球生成;当壳聚糖浓度为10 mg/mL时,醋酸壳聚糖溶液粘稠,形成的微球颗粒较大。当三聚磷酸钠浓度为2.5 mg/mL时,无论分子量为300 ku的壳聚糖浓度为多少,都无微球生成;当三聚磷酸钠浓度为30 mg/mL时,形成的微球颗粒较大。所以分子量为300 ku的壳聚糖浓度取2.5~7.5 mg/mL,三聚磷酸钠浓度取5~20 mg/mL制备载牛血清白蛋白壳聚糖微球比较合适。
综上,壳聚糖浓度范围取2.5~7.5 mg/mL,三聚磷酸钠浓度范围取10~20 mg/mL。
2.2.3牛血清白蛋白用量对载牛血清白蛋白壳聚糖微球载药率的影响当牛血清白蛋白的用量较低时,随着牛血清白蛋白用量的增加,载药量会逐渐提高,然而,由于壳聚糖的有效负载量有限,因此当牛血清白蛋白的用量达到一定量时,即使继续增加其用量,载药率也不会增加。其具体结果见图1。

图1 牛血清白蛋白用量对载牛血清白蛋白壳聚糖微球载药率的影响Fig.1 The effect of bovine serum albumin concentration on the drug loading rate of bovine serum albumin chitosan microspheres
由表1可以看出,随着牛血清白蛋白用量的加大,载牛血清白蛋白壳聚糖微球载药率也增大,当其增加至40 mg后,载药量变化不明显。
2.3正交实验结果
根据单因素实验结果,选取影响载牛血清白蛋白壳聚糖微球成球性及载药率的壳聚糖分子量、壳聚糖浓度、三聚磷酸钠浓度以及牛血清白蛋白用量4个因素,各取3个水平(表5),进行L9(34)正交实验设计,结果见表5。
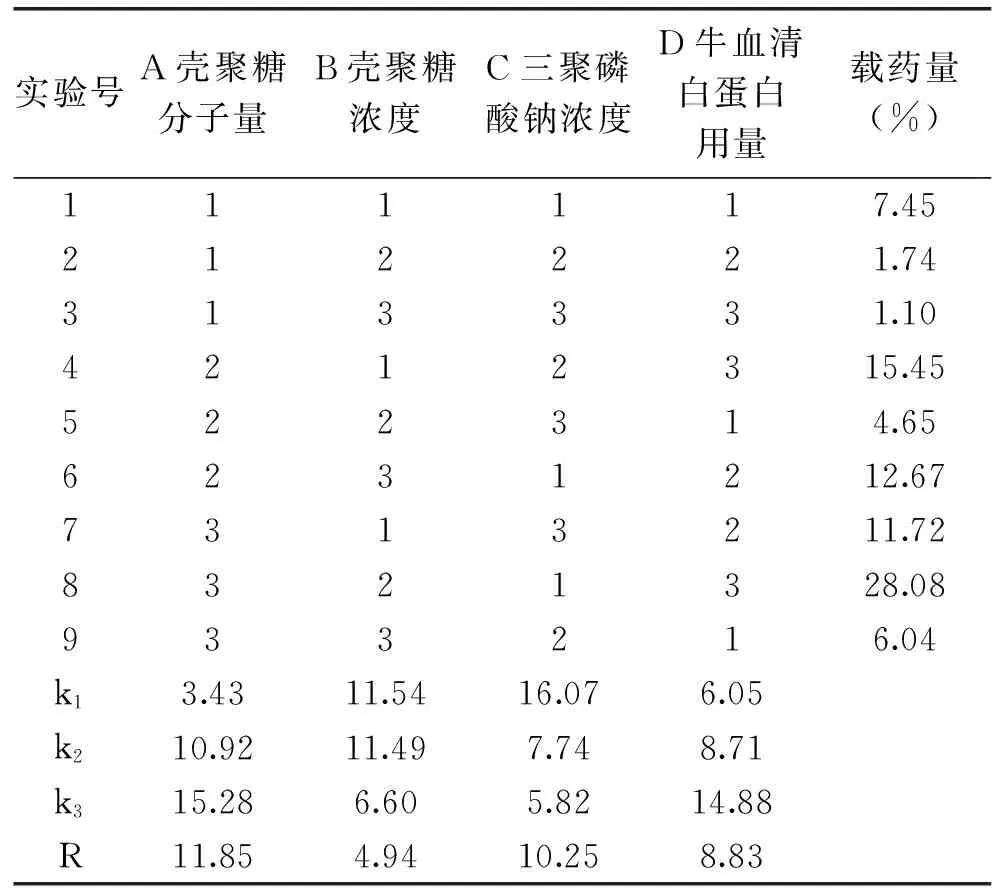
表5 L9(34)正交实验设计表及结果
由表5可知,这4个因素对载牛血清白蛋白壳聚糖微球载药率的影响顺序为A>C>D>B,即壳聚糖分子量>三聚磷酸钠浓度>牛血清白蛋白用量>壳聚糖浓度。因此,最优组合为A3B1C1D3,即壳聚糖分子量为300 ku、壳聚糖浓度为3 mg/mL、三聚磷酸钠浓度为10 mg/mL、牛血清白蛋白用量为30 mg。在此条件下,进行验证实验,得到的载药率可达30.13%。
2.4扫描电子显微镜观察图像
扫描电镜图像见图2,载牛血清白蛋白壳聚糖微球具有明显的球状结构,表面光滑,粒径大小在2 μm左右。

图2 载牛血清白蛋白壳聚糖微球扫描电镜图像Fig.2 The SEM images of bovine serum albumin chitosan microspheres
2.5体外释药特性评价
2.5.1牛血清白蛋白PBS标准曲线以牛血清白蛋白浓度C为横坐标,吸光度A为纵坐标绘制标准曲线,得到标准曲线方程:y=5.775x+0.0105,R2=0.9999,结果表明,牛血清白蛋白在0.02~0.1 mg/mL浓度范围内线性关系良好。
2.5.2体外释放从图3中可以看出,空白对照组游离的牛血清白蛋白释放较快,约4 h累积释放率超过了85%,12 h后基本释放完全,累计释放率达到99%,而载牛血清白蛋白壳聚糖微球12 h累计释放率为60%左右,且持续缓慢释放,48 h后,累积释放率接近70%,且仍然继续释放。这一结果充分证实了载牛血清白蛋白壳聚糖微球明显的缓释效果和持续释放特性。
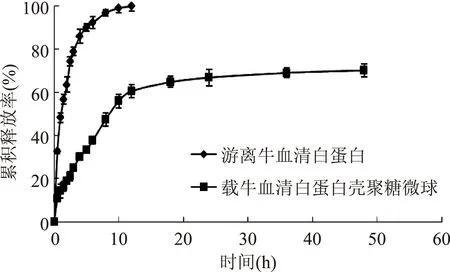
图3 载牛血清白蛋白壳聚糖微球体外释放图Fig. 3 In vitro release of bovine serum albumin chitosan microspheres
3 结论
随着科学的不断发展,许多蛋白质药物进入临床阶段,但蛋白质药物生物利用率较低,稳定性差,半衰期短,需要频繁给药,对患者生理和心理上造成很大负担;通过将蛋白类药物制成微球,使其发挥缓释、控释作用,已成为近年来开发蛋白类药物缓控释制剂的研究的方向[17-18]。本研究以高分子材料壳聚糖为载体,运用离子凝胶法成功制备载牛血清白蛋白壳聚糖微球。研究发现,壳聚糖分子量、三聚磷酸钠浓度以及壳聚糖浓度对载牛血清白蛋白壳聚糖微球成球性有较大影响,牛血清白蛋白加入量对微球载药率有影响。通过单因素实验与正交实验,研究制备载牛血清白蛋白壳聚糖微球的最佳方法,结果显示,载药率随壳聚糖分子量的增加、壳聚糖浓度的降低、三聚磷酸钠浓度的降低、牛血清白蛋白用量的增加而增加。
此外,通过体外释放实验表明,载牛血清白蛋白壳聚糖微球能够在体外持续缓慢释放,具有明显的缓释效果和持续释放特性,该研究为以壳聚糖作为药物缓控释载体的进一步研究提供依据,为蛋白类药物壳聚糖微球的研究提供借鉴。
[1]陆春燕,龙伟,温露,等. 载牛血清白蛋白PLGA微球的包封率测定及体外表征[J]. 海峡药学,2014,26(9):141-143.
[2]Sanchez A,Tobio M,Gonzalez L,et al. Biodegradable micro-and nanoparticles as long-term delivery vehicles for interferon-alpha[J]. Eur J Pharm Sci,2003,18(18):221-229.
[3]柳昌武,曾淼洋,童张法,等. 辣椒碱-壳聚糖/海藻酸钠微球的制备与体外释药研究[J]. 中成药,2014,36(3):620-622.
[4]李思阳,孔庆新,王洋. 载10-羟基喜树碱超声微泡的制备表征及其体外超声成像特性[J]. 中成药,2014,36(10):49-53.
[5]陈玉玺,浦益琼,张彤,等. 难溶性小分子药物微球体内外释放及相关性研究进展[J]. 中成药,2015,35(12):2721-2725.
[6]文庆怡,张光宇,周晓峰,等. 去甲斑蝥素-N-乳糖酰壳聚
糖/丝素蛋白微球在兔体内的抗肿瘤作用[J]. 中国新药杂志,2014,23(9):1075-1080.
[7]吴巧丽,张少凡,孙洋,等. 食品安全级固定化载体-壳聚糖微球制备的条件[J]. 食品与机械,2012,28(1):26-28.
[8]金娜,孔先利,林敏,等. 基于核酸适体微球的沙门氏菌检测方法研究[J]. 食品工业科技,2015,36(13):321-324.
[9]Tian X,Yin HZ,Zhang SC,et al. Bufalin loaded biotinylated chitosan nanoparticles:an efficient drug delivery system for targeted chemotherapy against breast carcinoma[J]. Eur J Pharm Biopharm,2014,87(3):445-453.
[10]孙川,梁云星,郑颖,等. 受体介导的主动靶向壳聚糖衍生物递药载体的研究进展[J]. 中国新药杂志,2015,24(22):2584-2588.
[11]王坦,胡志海,彭敏,等. 胺乙基壳聚糖接枝胶原蛋白肽的制备及其性能[J]. 武汉大学学报,2015,62(1):51-58.
[12]林晓洁,张华,金少钢,等. 盐酸青藤碱壳聚糖纳米粒的制备及体外释放性能的研究[J]. 中国实验方剂学,2011,17(4):22-25.
[13]何黎黎,邓 黎,林芸竹. 红景天苷壳聚糖纳米粒的制备及其体外释放性能研究[J]. 中草药,2013,44(5):552-556.
[14]曹力凡,周纲,杨建设,等. 盐析法制备小檗碱壳聚糖纳米载药微球[J]. 中国实验方剂学,2014,20(1):5-8.
[15]郑彩虹,梁文权,虞和永. 海藻酸-壳聚糖-聚乳酸羟乙醇酸复合微球的制备及其对蛋白释放的调节[J]. 药学学报,2005,40(2):182-186.
[16]汪家政,范明. 蛋白质技术手册[M]. 北京:科学出版社,2000:38-55.
[17]刘占军,张卫国,于九皋,等. 负载紫杉醇壳聚糖纳米粒的制备、表征与释药性能[J]. 中国组织工程研究与临床康复,2009,13(3):493-495.
[18]袁金芳,郭保林,张晓丽,等. pH、离子强度敏感性壳聚糖水凝胶的合成及其对辅酶A的控制释放[J]. 功能材料,2007,38(1):36-38.
Preparation of bovine serum albumin chitosan microspheres and evaluation of its drug release characteristicsinvitro
LI Si-yang1,ZHU Ji-ren1,KONG Qing-xin1,WANG Yang2,*
(1.Jiangsu Food & Pharmaceutical Science College,Huaian 223003,China; 2.Northeast Forestry University,Harbin 150040,China)
objective:To optimize the preparation technology of bovine serum albumin chitosan microspheres and investigate the drug release characteristicsinvitro,in order to improve the stability of protein drugs,control the drug release rate,prolong the time of drug action and improve the bioavailability of drugs. Methods:Natural polymer chitosan were used as the material,the bovine serum albumin chitosan microspheres were prepared by ionic gelation method,the single factor test and orthogonal design were used to optimize the technology of preparation,and the characteristics of the study were also investigatedinvitrorelease. Results Laser scanning microscope was for encapsulation of the bovine serum albumin chitosan microspheres. The best preparation technology were chitosan molecular of 300 ku,the concentration of sodium tripolyphosphate of 10 mg/mL,the concentration of chitosan of 3 mg/mL,the amount of bovine serum albumin of 30 mg. Under this condition,the microsphere drug loading rate was 30.13%,and theinvitrorelease studies showed that 70% of BSA was released from the bovine serum albumin chitosan microspheres in the first 48 h which confirmed a good sustained-release effect and sustained release characteristics. Conclusion:The bovine serum albumin chitosan microspheres with high drug-loading content and obvious slow release effect can provide the basis for further research.
chitosan;bovine serum albumin;microspheres;preparation;release
2015-06-26
李思阳(1987-),男, 硕士研究生,研究方向:新型载药系统,E-mail:253595136@qq.com。
王洋(1971-),女,博士,教授,主要从事药剂学和植物次生代谢研究,E-mail:ywang@nefu.edu.cn。
江苏省大学生实践创新项目(201513104007Y)。
TS201.2
A
1002-0306(2016)17-0157-05
10.13386/j.issn1002-0306.2016.17.022
