甘肃地区绵羊MHC-DRB1基因第2外显子多态性与乳房炎的相关性分析
2016-10-31张小丽宋晓育马小军陈富强
张小丽,宋晓育,马小军,2,*,陈富强,张 晨,张 欣
(1.甘肃农业大学 动物医学院,甘肃 兰州 730070;2. 甘肃省草食动物生物技术重点实验室,甘肃 兰州 730070)
甘肃地区绵羊MHC-DRB1基因第2外显子多态性与乳房炎的相关性分析
张小丽1,宋晓育1,马小军1,2,*,陈富强1,张晨1,张欣1
(1.甘肃农业大学 动物医学院,甘肃 兰州 730070;2. 甘肃省草食动物生物技术重点实验室,甘肃 兰州 730070)
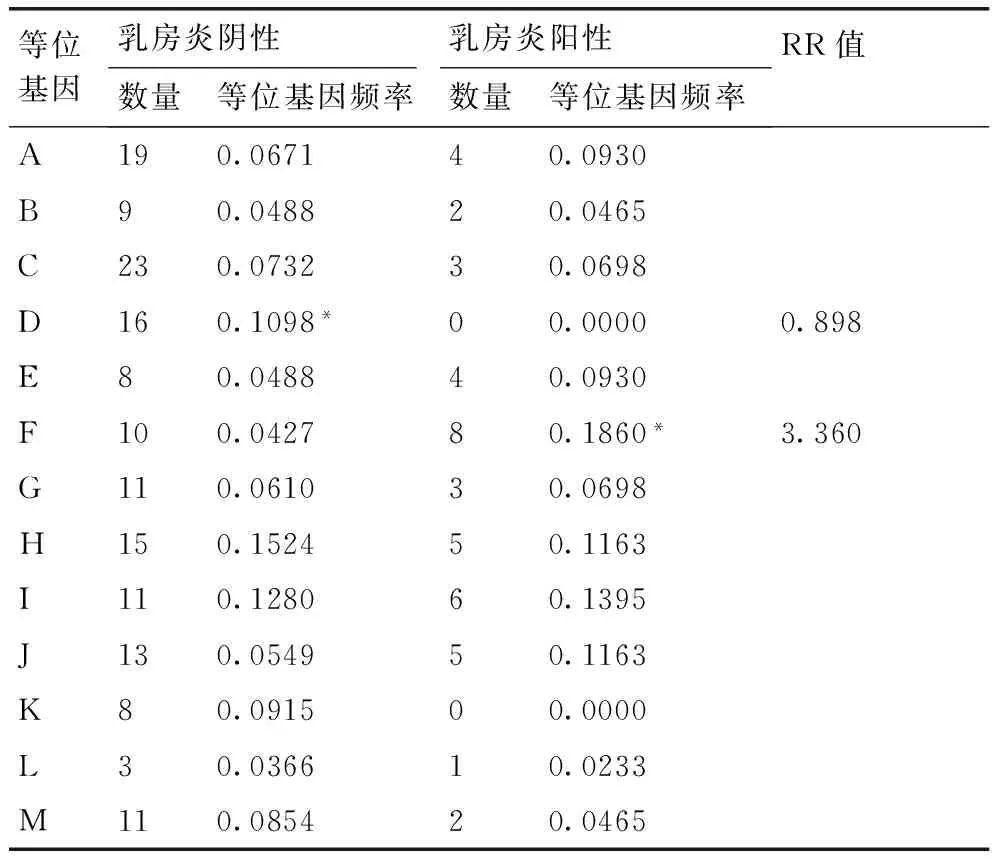
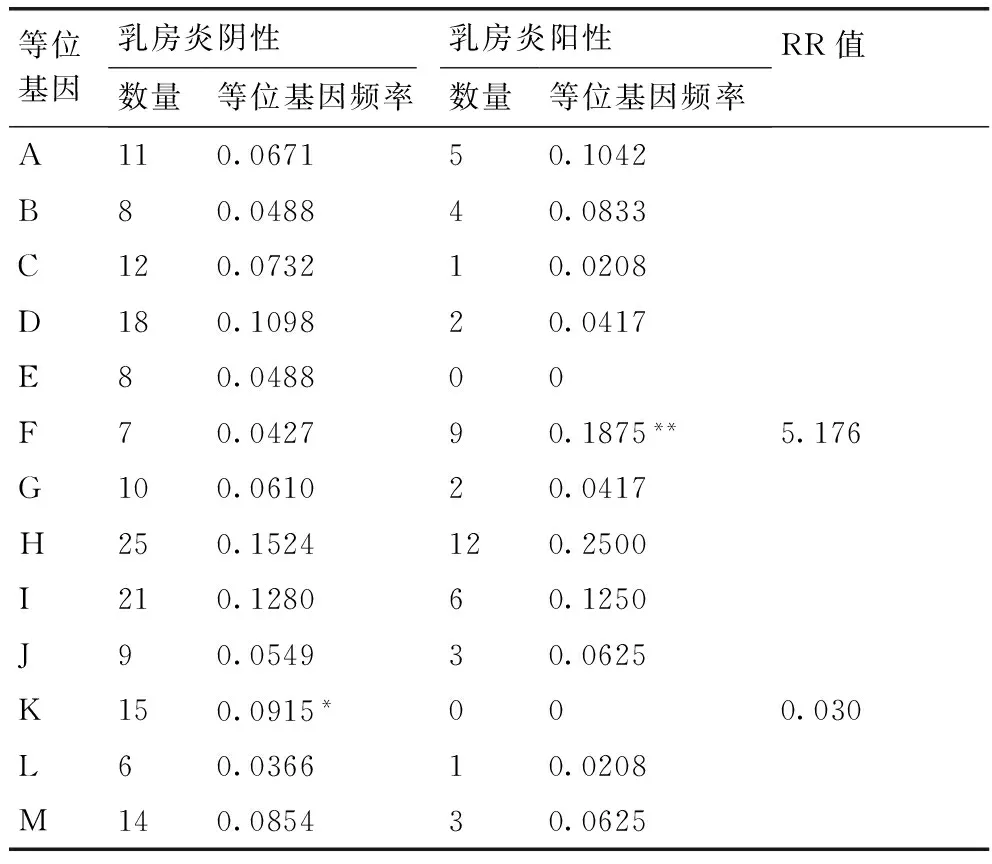
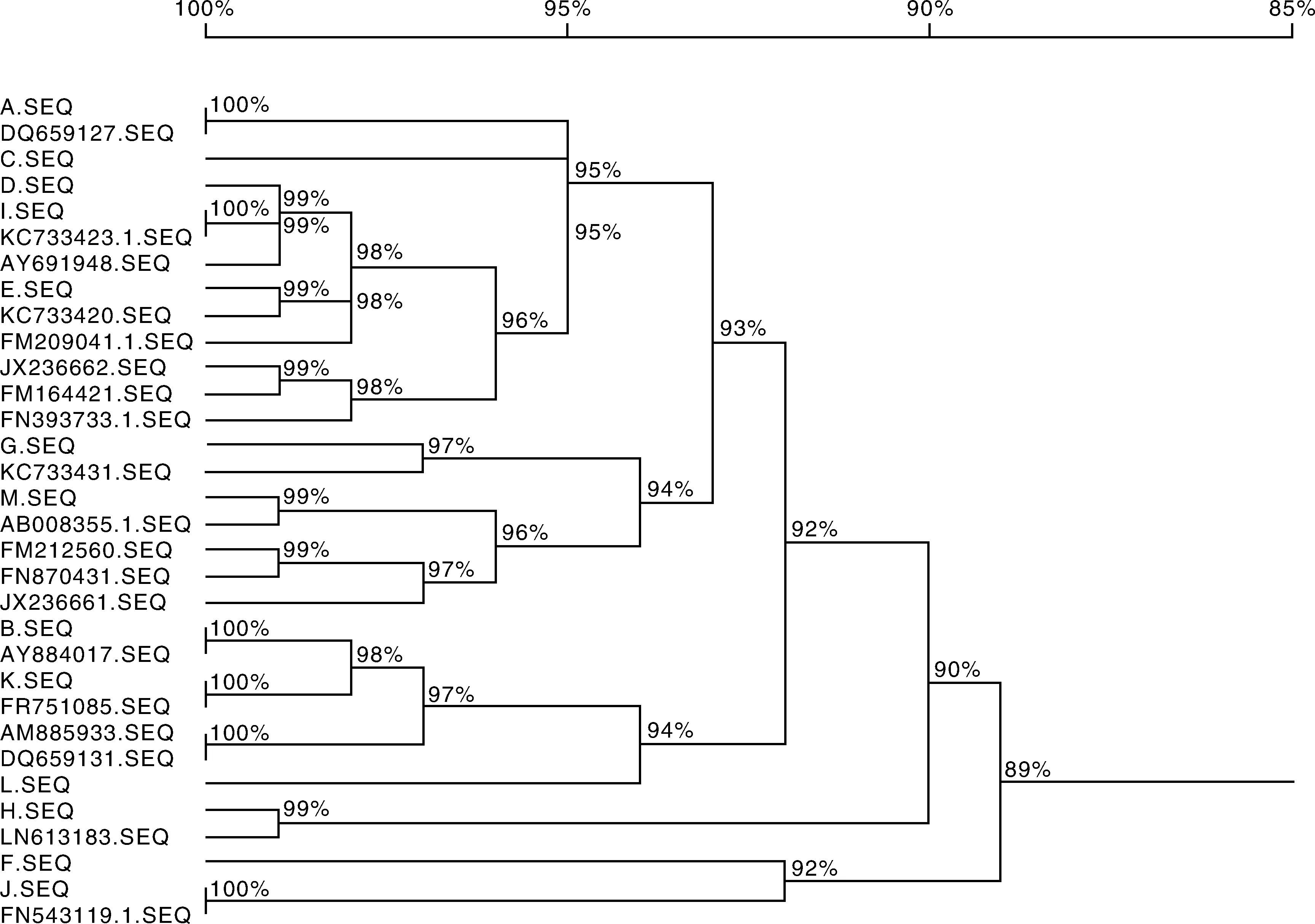
为研究甘肃地区绵羊MHC-DRB1基因第2外显子基因多态性与绵羊乳房炎的相关性,采用PCR-SSCP方法检测了200只甘肃高山细毛羊和212只小尾寒羊(其中各有43只和48只乳房炎阳性)MHC-DRB1第2外显子基因多态性,分析了群体内各等位基因与绵羊乳房炎的关联性。结果表明,两个品种绵羊群体的MHC-DRB1第2外显子共检测到13个等位基因,具有高度多态性(PIC>0.5),且偏离了哈德温伯格平衡定律(P<0.01)。两个品种绵羊乳房炎阴性和阳性个体的13个单倍型序列的差异显著性检验和相对危险值(RR值)计算发现,甘肃细毛羊中等位基因D(0.01 甘肃高山细毛羊;小尾寒羊;MHC-DRB1第二外显子;PCR-SSCP;乳房炎 绵羊乳房炎临床型及隐性乳房炎的发病原因很多,主要是由病原微生物经乳头口侵入乳头管引起的乳腺组织感染,其他疾病,如结核病、布氏杆菌病、巴氏杆菌病等,也可引发本病。目前,对于绵羊隐性乳房炎的发生关注较少,但它会使患病母羊产乳量降低,甚至不能产乳,造成羔羊死亡;另一方面许多羊因本病而被淘汰,尤其是坏疽性乳房炎的发病率和死亡率更高,造成严重的经济损失。所以用分子遗传来筛选出与乳房炎抗性较高的绵羊群体,成为控制绵羊乳房炎疾病的另一切入点。 主要组织相容性复合物(major histocompatibility complex,MHC)是在脊椎动物中发现的能够编码免疫球蛋白受体并具有高度多态性的基因群[1]。MHC基因的产物不仅能够在各种细胞表面表达,而且可以控制免疫细胞间的相互作用[2]。绵羊白细胞抗原(ovine lymphocyte antigen, OLA)为绵羊的MHC,位于绵羊第20号染色体上,由classⅠ,classⅡ,classⅢ三类基因组成,具有高度多态性和连锁不平衡性。大量研究证明绵羊的MHC主要是classⅡ类分子可以递呈外源性物质给T细胞,调控免疫应答反应作用,而OLA-MHC的classⅡ类分子的DR和DQ亚区的DRB和DQB两个基因位点所编码的抗原在免疫中发挥重要作用,尤其是编码抗原功能区的第二外显子,其多态性和遗传学在机体保护自我对抗疾病感染中发挥重要作用。大量有关DRB1第二外显子的多态性的研究证实,绵羊的MHC-DRB1具有丰富多态性[3-4]。目前国内外已有研究表明绵羊MHC-DRB1与绵羊的抗线虫感染[5]、布鲁氏菌病[6]、肺腺癌[7]、山羊流产[8]、包虫病[9]等疾病密切相关。MHC抗原与奶牛乳房炎密切相关,但目前国内外还未见涉及绵羊MHC-DRB1基因与乳房炎相关性的研究报道。本研究拟借鉴奶牛乳房炎抗性分子标记的研究成果,以MHC-DRB1基因为研究对象,采用PCR-SSCP方法对乳房炎阴性和阳性的甘肃细毛羊和小尾寒羊的MHC-DRB1基因第二外显子的多态性和乳房炎疾病的感染情况进行分析,筛选绵羊乳房炎抗性分子标记,探讨MHC-DRB1基因与绵羊乳房炎的遗传易感关系,并将其与绵羊乳房炎临床发病情况进行相关性分析,为建立绵羊乳房炎抗性分子标记体系提供基础资料。 1.1材料 采集甘肃地区绵羊血液样本412份,包括43份甘肃高山细毛羊乳房炎阳性样本、48份小尾寒羊乳房炎阳性样本和157份甘肃高山细毛羊、164份小尾寒羊乳房炎阴性样本。在颈静脉采集血液10 mL,装入内有1 mL灭菌ACD抗凝剂的10 mL灭菌离心管,并用冰盒带回实验室,置于-20 ℃冰箱冻存备用。 1.2方法 1.2.1基因组DNA提取 采用常规实验室的酚/氯仿[10]提取法,从血样中提取基因组DNA并溶解于TE缓冲液,在1%琼脂糖凝胶电泳检测后,放于-20 ℃冰箱保存备用。 1.2.2引物设计及PCR扩增 引物设计参照文献并结合GenBank上的序列(NM_001123402)设计:上游引物:5′-ATCCTCTCTCTGCAGCACATTTCC-3′;下游引物:5′-TTTAAATTCGCGCTCACCTCGCCGCT-3′。扩增目的片段约为300 bp。引物由上海生工生物工程有限公司合成。 PCR扩增体系:总体积25 μL,其中上下游引物各1 μL,模板DNA 2 μL,灭菌双蒸水8.0 μL,2×Taqmix 13.0 μL。PCR反应条件:预变性95 ℃,5 min;变性95 ℃,30 s;退火55 ℃,45 s;延伸72 ℃,45 s,33个循环;最后延伸72 ℃ 10 min。4 ℃保存,PCR产物用1.5%的琼脂糖凝胶电泳检测。 1.2.3PCR产物的SSCP检测 取2.0 μL PCR产物,8 μL变性上样缓冲溶液,含98%去离子甲酰胺、0.03%二甲苯青、0.025%溴酚蓝、0.5 mol·L-1EDTA(pH 8.0),98 ℃变性10 min,然后迅速放于冰上10 min。12%非变性聚丙烯酰胺凝胶(Arc∶Bis=39∶1),4 ℃,160 V条件下,电泳24 h,银染显色法结束后拍照判型。 1.2.4OLA-DRB1第2外显子克隆测序 SSCP分析之后,选取不同基因型个体PCR扩增胶回收产物克隆,克隆选用公司克隆试剂盒并转入DH5α菌株,阳性菌液送至金唯智生物科技有限公司测序。 1.2.5乳房炎的判定 将采集的乳汁送中国农业科学院兰州畜牧与兽医研究所,采用小型体细胞自动计数仪检测,以40万个·mL-1为阈值,体细胞数大于40万个·mL-1的则判定为隐性乳房炎。 1.2.6数据统计分析 采用SPSS 17.0计算甘肃地区绵羊各个基因型的频率、等位基因频率;用POPGNE计算纯合度(Ho)、杂合度(He)和有效等位基因数(Ne);用PIC软件计算多态信息含量(PIC);用MEGA 5.0进行核苷酸序列及氨基酸序列比对,DNAMAN进行NJ进化树的构建。 2.1PCR扩增结果 对采集的412只绵羊DRB1基因第2外显子进行PCR扩增,片段大小为300 bp,经1.5%琼脂糖凝胶电泳检测发现,目的条带清晰,无杂带(图1),可以进行下一步SSCP检测。 M: Maker; 1-6: PCR产物图1 DRB1第2外显子PCR扩增结果Fig.1 PCR products of DRB1 gene exon 2 2.2PCR-SSCP检测结果 PCR产物进行SSCP检测发现,412只甘肃地区绵羊个体中共检测到13个等位基因,其电泳条带从1条到3条不等,分别命名为等位基因A,B,C…M(图2)。 2.3DRB1第2外显子核苷酸位点变异类型与多态性 对412份甘肃绵羊和小尾寒羊DRB1基因第2外显子的13个等位基因序列分析发现,13个等位基因中存在59个变异位点,占核苷酸分析位点19.67%,其中转换位点22个,占变异位点37.29%,包括A/G转换14个、T/C转换8个;颠换25个,占变异位点42.37%,包括A/C颠换8个、A/T颠换5个、G/C颠换8个、G/T颠换2个、C/G和C/A颠换共存2个,转换和颠换共存位点12个(图3)。大量的核苷酸位点改变导致氨基酸发生改变(图4)。 图2 MHC-DRB1第二外显子SSCP检测结果Fig.2 Electrophoresis map of MHC-DRB1 gene exon 2 by PCR-SSCP 2.4甘肃高山细毛羊和小尾寒羊DRB1基因第2外显子遗传信息 遗传杂合度(He)、有效等位基因数(Ne)、多态信息含量(PIC)是评价群体遗传变异的重要指标。两个绵羊品种的DRB1基因第2外显子的遗传多态性如表1所示,PIC>0.5,为高度多态。 图3 MHC-DRB1基因第2外显子等位基因核苷酸序列比对结果Fig.3 Nucleotide sequence alignment of MHC-DRB1 gene exon 2 alleles 表1DRB1第二外显子遗传多态性分析 Table 1The genetic polymorphisms ofDRB1 gene exon 2 品种纯合度Ho杂合度He有效等位基因数Ne多态信息含量PIC甘肃细毛羊0.08600.914011.34260.9049小尾寒羊0.09220.907810.60500.8982 注:0.25 2.5甘肃细毛羊和小尾寒羊DRB1第2外显子与乳房炎相关性分析 两个绵羊品种的DRB1基因第2外显子的等位基因频率见表2、表3。结果表明,两个品种绵羊乳房炎阳性个体中均不存在等位基因K,而等位基因E在甘肃细毛羊乳房炎阳性个体中存在,等位基因D只在小尾寒羊乳房炎阳性个体中出现。将乳房炎阴性和阳性绵羊等位基因频率进行差异显著性分析(t检验)和相对危险值计算,结果表明,甘肃细毛羊中等位基因D(0.01 乳房炎阴性和阳性小尾寒羊差异显著性和相对危险值分析结果显示(表3),等位基因K(0.01 2.6DRB1基因第2外显子进化树分析 为了解这两个绵羊种群DRB1基因第2外显子的等位基因与其他相应等位基因之间的遗传关系,利用DNAMAN软件对其DRB1基因第2外显子序列进行NJ树构建(图5),用作构建系统发育树的序列是(括号内为GenBank登录号):等位基因MHC-DRB1C1 (DQ659127),*0702(FM209041),*1303(FR751085),MHC-DRB1L(AY884017),*1301(AM885933),*0701(KC733423),*1203(AY691948),*1402(FN393733),*1403(JX236662),1401(FM164421),*1503(FN870431),*1502(FM212560),*1901(KC733431),*07(KC733420),*2601(LN613183),*0901(FN543119),*09(AB008355),*0806(JX23666)。图5显示DRB1-A与MHC-DRB1C1(DQ659127)聚合在一起,自展值(bootstrap value)为100%,等位基因I与*0701(KC733423)和*1203(AY691948)聚合在一起,自展值为99%,等位基因B与MHC-DRB1L(AY884017)、等位基因K和*1303(FR751085)聚合在一起,自展值为98%,等位基因F与J和*0901(FN543119)聚合在一起,自展值为92%。以上自展值均很高,表明该聚类分析具有较高的可靠性;同时,根据系统树上标记的自展值,可以把整个聚类图分为两大支,除了等位基因J和*0901聚为一支外,其他等位基因聚在另外一支上。根据聚类图也可以看出,本研究发现的等位基因在2个分支中均有分布,表明甘肃地区的2个绵羊群体与其他绵羊品种在DRB1基因等位基因上的差异较小,同源性较高。 表2乳房炎阴性和阳性甘肃细毛羊DRB1基因第2外显子等位基因频率 Table 2Allele frequencies of theDRB1 gene exon 2 in infected mastitis and healthy Gansu alpine fine-wool sheep 等位基因乳房炎阴性乳房炎阳性数量等位基因频率数量等位基因频率RR值A190.067140.0930B90.048820.0465C230.073230.0698D160.1098*00.00000.898E80.048840.0930F100.042780.1860*3.360G110.061030.0698H150.152450.1163I110.128060.1395J130.054950.1163K80.091500.0000L30.036610.0233M110.085420.0465 注:乳房炎阴性与阳性甘肃细毛羊DRB1相同等位基因间,*表示差异显著 0.01 表3乳房炎阴性和阳性小尾寒羊DRB1基因第2外显子等位基因频率 Table 3Allele frequencies of theDRB1 gene exon 2 in infected mastitis and healthy Small Tail Han sheep 等位基因乳房炎阴性乳房炎阳性数量等位基因频率数量等位基因频率RR值A110.067150.1042B80.048840.0833C120.073210.0208D180.109820.0417E80.048800F70.042790.1875**5.176G100.061020.0417H250.1524120.2500I210.128060.1250J90.054930.0625K150.0915*000.030L60.036610.0208M140.085430.0625 注:乳房炎阴性与阳性小尾寒羊DRB1相同等位基因间,**表示差异极显著P<0.01。 图5 MHC-DRB1基因第2外显子核苷酸序列的NJ树Fig.5 Neighbor-joining trees of gene MHC-DRB1 nucleotide sequences 根据调查,甘肃省规模化羊场母羊患临床型乳房炎的比例平均为10%~15%,隐性乳房炎发病比例更高,给养羊业带来了严重的经济损失。虽然通过药物治疗等措施,可在一定程度上控制绵羊乳房炎,但不能从根本上完全消除。从遗传本质上提高绵羊抗乳房炎的能力,从分子遗传水平上实施抗病育种,从而筛选出动物抗病品系和培育出抗病动物是控制和减少疾病发生的有效途径之一,而经历大自然残酷的生物进化准则选拔出来的抗性品类,具有高度的安全性。 MHC基因是脊椎动物多态性最高的基因之一,其遗传基础是等位基因的点突变,即核苷酸发生替换[11]。大量绵羊MHC-DRB1基因第2外显子的研究也证明了该基因具有高度多态性[12]。Jugo等[13]对 Latxa和Karrantar羊的MHC-DRB1第2外显子多态性的研究,发现了12个等位基因;Ballingall等[14]在400只Valachian 绵羊的DRB1第2外显子中发现了25个等位基因;Arrieta等[15]采用PCR-SSCP方法分析Laxta 绵羊的MHC-DRB1第2外显子遗传多态性,检测到了19个等位基因;王佳泰等[16]在对河西绒山羊的MHC-DRB1第2外显子基因研究中,发现了26个等位基因、71个核苷酸多态位点。Mona等[17]、Rao等[18]认为环境特别是病原的压力是导致动物MHC具有高度多态性的主要因素。本研究首次采用PCR-SSCP方法,发现甘肃细毛羊和小尾寒羊两个群体的MHC-DRB1基因外显子2具有丰富的遗传多态性,共检测到13个等位基因和59个核苷酸变异位点,PIC含量均大于0.5,表现高度多态。这可能与甘肃地区以及所采集的两个绵羊群体所处的严酷环境有关,从而形成了其适应性强、抗病能力强的特性。 大量研究证明,MHC基因与家畜的多种疾病存在强相关,已成为抗病育种首选的基因标记[19-20]。有研究报道MHC的部分等位基因与奶牛的乳房炎存在密切相关[21]。高树新等[22]采用PCR-SSCP技术,在检测并分析了9种中国荷斯坦牛 BoLA-DQA基因第2外显子基因的基因型、15种BoLA-DRB3基因第2外显子基因的基因型和3种单体型后发现,DQA-B/DRB3-C,DQA-G/DRB3-F两种单体型可能与奶牛乳房炎易感性有关。张夫千等[23]对荷斯坦牛的DRB3基因外显子2研究发现,其与乳房炎有相关性。本研究结果表明,不同等位基因个体间对乳房炎的抗性和易感性存在差异。在相同的饲养管理以及防疫条件下,等位基因D在甘肃细毛羊乳房炎阳性个体中出现较少(0.01 [1]KLEIN J, SATTA Y, OHUIGIN C. The molecular descent of the major histocompatibility complex[J].AnnualReviewsofImmunology,1993,11:269-295. [2]余智勇,彭林泽,申红,等. 绵羊MHC的研究现状[J].贵州畜牧兽医,2006,30(4):12-14. [3]黄燚娜,唐宜俊,张金松,等. 云南半细毛羊和杜泊羊MHC-DRB1基因PCR-RFLP多态性分析[J]. 畜牧与兽医,2012,44(2):38-42. [4]HERRMANN L M, BROWN W C, LEWIS G S, et al .Identification and phylogenetic analysis of 15 MHC class ⅡDRB1 β1expressed alleles in a ewe-lamb flock[J].Immunogenetics, 2005, 57(11):855-863. [5]SAYERS G, GOOD B, HANRAHAN J P, et al. Major histocompatibility complexDRB1 gene its role in nematode resistance in Suffolk and Texel sheep breeds[J].Parasitology, 2005, 131(3):403-409. [6]陈月娥,苟亚峰,周璐,等.中国美利奴羊MHC-DRB1基因exon2 SNPs 及其与布鲁氏菌病易感性的相关性[J].中国畜牧兽医,2014,50(1):15-20. [7]LARRUSKAIN A, MINGUIJON E, GARCIA E K, et al. MHC classicⅡDRB1 gene polymorphism in the pathogenesis of Maedi-Visna and pulmonary adenocarcinoma viral diseases in sheep[J].Immunogenetics,2010,62(2):75-83. [8]王佳泰,王继卿,马小军,等.河西绒山羊GOLA-DRB1基因第2外显子变异特征分析[J].生物技术通报,2011(12):132-138. [9]贾斌,申红,余志勇,等.多浪羊和中国美利奴羊MHC-DRB1基因多态性与包虫病的遗传易感性[J].中国人兽共患传染病学报,2007,23(10):1004-1008,1012. [10]刘云芳,高建峰,潘晓亮. 绵羊全血中微量DNA的提取[J].石河子大学学报(自然科学版),1997,1(2):136-138. [11]陈芳芳,潘玲,耿照玉,等.MHC分子多态性的起源、演变和抗病机理[J].畜牧兽医学报,2010,41(9):1061-1067. [12]于辉,李彬,李华,等. SLA与免疫抗病的研究进展[J].中国畜牧杂志,2009, 45(5):60-65. [13]JUGO B M, VICARIO A . Single-strand conformational polymorphism and sequence polymorphism of MHC-DRBin Latxa and Karrantzar sheep: implications for Caprinae phylogeny[J].Immunogenetics, 2000, 51: 887-897. [14]BALLINGALL K T, FARDOE K, MCKEEVER D J. Genomic organisation and allelic diversity within coding and non-coding regions of the Ovar-DRB1 locus[J].Immunogenetics,2008,60(2): 95-103. [15]ARRIETA I, GARCIA-ETXEBARRIA K, JUGO B M. Optimization of the MHC Ovar-DRB1 gene typing[J].TissueAntigens,2006,67(3):222-228. [16]王佳泰,王继卿,胡江,等. 河西绒山羊GOLA-DRB1基因第二外显子变异特征分析[J]. 生物技术通报, 2011(12):132-138. [17]MONA S, CRSTANELLO B, BANKHEAD D S, et al. Disentangling the effects of recombination, selection and demography on the genetic variation at a major histocompatibility complex class Ⅱ gene in the alpine chamois[J].MolecularEcology, 2008, 17(18):4053-4067. [18]RAO X, COSTA AI, VAN B D. A comparative study of HLA binding affinity and ligand diversity: implications for generating immunodinant CD8+T cell responses[J].JournalofImmunology,2009, 182 (3):1526-1532. [19]NAGAOKA Y, KABEYA H, ONUMA M, et al .Ovine MHC class ⅡDRB1 alleles associated with resistance or susceptibility to development of bovine leukemia virus-induced ovine lymphoma[J].CancerResearch,1999,59(4):975-981. [20]HERRMANN-HOESING L M, WHITE S N, MOUSEL M R, et al . Ovine progressive pneumonia provirus levels associate with breed and Ovar-DRB1[J].Immunogenetics,2008,60(2):749-758. [21]赵福斌,李建斌,王洪梅,等. MHC基因与奶牛乳房炎相关性的研究进展[J].中国奶牛,2007(7):31-32. [22]高树新,许尚忠,李金泉,等. BOLA-DQA、DRB3*exon2多态性及其与奶牛乳房炎的关联分析[J].畜牧兽医学报,2006,37(4):317-320. [23]张夫千,郑小敏,唐大伟,等.荷斯坦牛BOLA-DRB3基因多态性及其与乳房炎抗性关系分析[J].畜牧兽医学报,2007,38(2):115-119. (责任编辑张韵) Analysis of polymorphism of MHC-DRB1 gene and the correlation to mastitis of sheep in Gansu ZHANG Xiao-li1,SONG Xiao-yu1,MA Xiao-jun1,2,*, CHEN Fu-qiang1, ZHANG Chen1, ZHANG Xin1 (1.CollegeofVeterinaryMedicine,GansuAgriculturalUniversity,Lanzhou730070,China; 2.GansuKeyLaboratoryofHerbivorpousAnimalBiotechnology,Lanzhou730070,China) To investigate the polymorphism of ovine major histocompatibility complex ⅡDRB1 (MHC-DRB1)and the genetic susceptibility to mastitis, the polymorphism ofDRB1 gene exon 2 in 200 Gansu alpine fine-wool sheep and 212 Small Tail Han sheep (43 and 48 sheep in those groups were diagnosed as mastitis) was analyzed by PCR-SSCP techniques. The correlation of the alleles and mastitis were analyzed. It was found that theDRB1 gene exon 2 had 13 alleles, MHC-DRB1 showed high polymorphism (PIC>0.5) and was significantly deviant from Hardy-Weinberg equilibrium (P<0.01). Allele frequencies between healthy sheep and infected sheep with mastitis and the relative risk (RR) value confirmed that, allele D (0.01 Gansu alpine fine-wool sheep; Small Tail Han sheep; MHC-DRB1 gene exon 2; PCR-SSCP; mastitis 10.3969/j.issn.1004-1524.2016.02.07 2015-07-02 甘肃省农业生物技术研究与应用开发项目(GNSW-2011-22);甘肃农业大学动物医学院教研产学创新基金(GYCX-KX010) 张小丽(1971—),女,甘肃定西人,博士,副教授,研究方向为动物微生物免疫与抗病。E-mail:zhxl228 @qq.com ,马小军,E-mail: maxj@gsau.edu.cn S858.26 A 1004-1524(2016)02-0221-07 张小丽,宋晓育,马小军,等. 甘肃地区绵羊MHC-DRB1基因第2外显子多态性与乳房炎的相关性分析[J].浙江农业学报,2016,28(2): 221-227.1 材料与方法
2 结果与分析




3 讨论
