万变不离其宗
——高三二轮复习电化学原理选择题答题技巧
2016-10-31马强
马强
(甘肃省华亭县第一中学)
万变不离其宗
——高三二轮复习电化学原理选择题答题技巧
马强
(甘肃省华亭县第一中学)
高三二轮复习时,普通班学生由于不自信、对原电池原理理解不到位和审题能力差等诸多因素,在模拟考试中“电化学原理”部分失分较为严重。如果掌握一定的答题技巧会在这一类选择题中提高得分几率。主要依据原电池原理,对电解池原理进行信息筛选和答案选择。
二轮复习;电化学;选择题;技巧
高三二轮复习时间紧、任务重,通过复习练习和模拟考练,发现普通班级的学生在电化学专题部分得分率很低。首先,这与近几年的试题特点有关,这类考题突出考查学生对电化学概念的理解及应用,其中新型电池出现较多,难度较大。其次,经调查分析,在学生中还普遍存在以下原因:(1)不自信。认为电化学习题难度大、思维要求高,要想在这个考点上得分是不可能的,所以放弃或者随便选择答案碰运气。(2)原理理解不到位。对于电化学专题的基本原理(原电池原理,电解池原理)没有理解,不能灵活运用,选择题给出的选项不能确定其正误,导致失分。(3)审题能力差、粗心。基本原理都已掌握,但由于粗心或者较差的审题能力,导致把题意读错而误选答案。针对以上出现的问题,个人认为,要想在此考点上得分,应该树立自信,培养自己良好的做题习惯,掌握一定的答题方法和技巧。现通过近几年高考试题的分析整理,重点介绍电化学专题选择部分的答题方法和技巧。
一、依据原电池原理
原电池与生活联系紧密,一般出题角度会从生活中取材,让学生提取有用信息,找准切入点很关键。原电池基本原理为“还正氧负”,工作时电解质溶液中阳离子移向正极,阴离子移向负极。负极为较活泼金属,易失去电子(锂电池中Li为负极)。转化问题,紧扣原理,判断正确选项。
例一:(1)(2014·全国理综II化学卷)2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是()
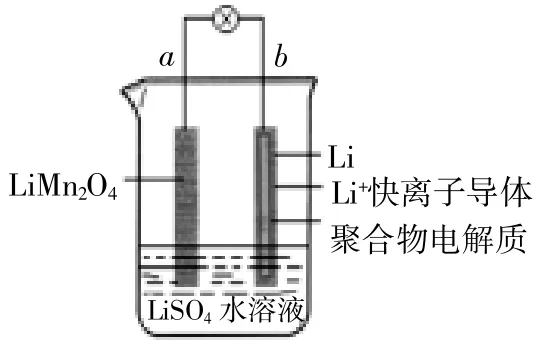
A.a为电池的正极
B.电池充电反应为LiMn2O4=Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中的Li+从b向a迁移
此题的切入点为:电池放电时,电解质溶液中的阳离子移到a极放电,则材料中Li的化合价没有变化。所以C的叙述错误。本题答案为C。由此推断,a是原电池的正极,A正确;电极反应中电极b是原电池的负极,电极反应式为Li-e-=Li+,电极a是原电池的正极,电极反应为式Li1-xMn2O4+xLi++xe-=LiMn2O4。根据正负极的电极反应可知,电池充电反应为LiMn2O4=Li1-xMn2O4+xLi,B正确;放电时,溶液中Li+从b向a迁移,D正确。
(2)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)下列说法错误的是()
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq)
C.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
D.电池工作时,电子由正极通过外电路流向负极
此题用熟悉的“锌—锰碱性电池”为入口,又用学生较陌生的总反应式为干扰,考查学生熟练运用原电池原理的能力。考生若掌握原电池中电子流向则很容易得到答案,为D;若将重心放在电极反应式的分析上,则既耗时又不易得分。
不难看出,这两道题重心都在4个选项的正误判断上,要求考生对每道选项都要进行分析,这类选择相对耗时较多。为了将时间缩到最短,先依据原理把确定的错误选项排除,选项中出现的复杂或陌生的电极反应或总反应式,一般放在最后处理,当其他选项能确定正误后,答案即出;若其他选项都正确或错误,则该反应式即为答案。
二、依据电解池原理
电解池相对原电池难度较大,电解池是通过电能转化成化学能,也就是利用电能强制性地发生氧化还原反应。所以,电解池基本原理为“还阴氧阳”,工作时若为惰性电极电解,则电解质溶液中阳离子移向阴极,阴离子移向阳极,再根据离子的放电顺序确定电极反应;若有金属作阳极,则是金属先失电子溶解。书写电极反应式时,在考虑溶液中阴、阳离子放电顺序的同时,也要注意电极本身的反应,电极产物与溶液中的离子发生的反应。如,铅蓄电池中铅放电生成的Pb2+与溶液中的SO42-反应生成PbSO4。
例二:工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是()

A.碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少C.为了提高Ni的产率,电解过程中需要控制废水的pH
D.若将图中阳离子膜去掉,将A、B两室合已知:①Ni2+在弱酸性溶液中发生水解②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)。
并,则电解反应总方程式发生改变
首先根据题意C正确;再根据电解原理,碳棒与电源正极相连,是电解池的阳极,OH-放电产生O2,为平衡A中的电荷,Na+通过阳离子膜移向B中;同理,C中镀镍铁棒为阴极,Ni2+放电,为了平衡电荷,Cl-也移向B中,使B中NaCl溶液的浓度不断增大,B选项错误。A,D选项经分析正确。
电解池除了考查电极反应,总反应之外,还会根据离子生成,移动判断离子浓度,pH值等,考查范围较广,难度较大。学生需要依据电解池原理,再根据具体题设要求进行分析就可以了。
三、电化学知识的综合应用
电化学综合应用是将原电池和电解池原理糅合在一起进行考查,考查内容一般是二次电池放电和充电时的知识点,综合性强。学生通过高三强化复习已经清楚放电过程等同于原电池,充电过程相当于电解池。

A.放电时负极反应为:3Zn-6e-+6OH-=3Zn(OH)2
B.充电时阳极反应为:2Fe(OH)3-6e-+10OH-=2FeO42-+8H2O
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
放电是原电池原理,正极FeO42-得到电子生成2Fe(OH)3,正极反应2FeO42-+6e-+8H2O=2Fe(OH)3+10OH-,放电时每转移3 mol电子,正极有1mol K2FeO4被还原,同时正极附近溶液的碱性增强;负极反应3Zn-6e-+6OH-=3Zn(OH)2;充电是电解原理,阳极反应为2Fe(OH)3-6e-+10OH-=2FeO42-+8H2O,阴极反应为3Zn(OH)2+ 6e-=3Zn+6OH-。故选C。
通过以上试题解析,我们不难发现,新型电池背后所应用的原理基本是不变的,所以,只要我们在平时加强基础知识的复习和记忆,理解和掌握原电池与电解池原理,再通过习题的训练与总结,找出解题技巧,这类考点就会成为我们有效的得分点。另外,要特别强调:理综考试中拿下选择题也就胜利了一半,六分之一的选择题是绝对不能马虎对待的!
吴瑞蓝,衷明华.高考命题热点之电化学[J].江西化工,2015(2).
·编辑杨国蓉
