枸杞多糖对小鼠脑缺血再灌注损伤的保护作用及其抗氧化应激的机制研究
2016-10-31葛建彬卢红建宋新建陈丹丹
葛建彬, 卢红建, 宋新建, 李 梅, 陈丹丹, 吴 锋
枸杞多糖对小鼠脑缺血再灌注损伤的保护作用及其抗氧化应激的机制研究
葛建彬1,2,卢红建1,宋新建1,李梅2,陈丹丹3,吴锋3
目的探讨枸杞多糖(lycium barbarum polysaccharides,LBP)对缺血再灌脑损伤小鼠的保护作用及其可能的机制。方法通过颈总动脉栓线造成大脑中动脉缺血,缺血2 h后将栓线拔出以实现大脑中动脉血流再灌注,形成小鼠短暂性大脑中动脉阻塞(transient middle cerebral artery occlusion,tMCAO)模型,观察LBP(25 mg/kg,50 mg/kg和100 mg/kg)对小鼠脑梗死范围,脑含水量,神经症状的影响,采用Westernblot法检测缺血大脑皮质NOX4蛋白的表达,采用DHE染色法检测脑组织中ROS的生成,采用分光光度计检测缺血侧脑组织匀浆SOD活力,GSH-Px活力,及MDA含量。结果LBP对缺血再灌注小鼠神经症状有明显的改善作用,能明显降低脑梗死范围和脑含水量。Westernblot结果显示:小鼠缺血再灌后,缺血侧大脑皮质NOX4蛋白水平明显增高,LBP能显著降低NOX4蛋白水平。DHE染色显示,LBP能显著降低缺血再灌后ROS的生成。LBP能升高SOD和GSH-Px活力,降低MDA含量。结论LBP对缺血再灌注小鼠脑损伤有明显保护作用,该作用可能与其抑制脑缺血再灌注引起的氧化应激损伤有关。
枸杞多糖;脑缺血;氧化应激;NOX4;ROS
脑梗死(cerebralischemia,CI),是临床常见病和多发病,具有极高的病死率和致残率,且近年来有年轻化的趋势,在发展中国家是第二或第三位导致个体死亡的原因,严重危害人类健康[1]。
枸杞多糖(lycium barbarum polysaccharides,LBP)是从茄科植物枸杞的成熟果实中提取而得的一种水溶性蛋白杂多糖,是枸杞的主要活性成分之一,具有调节免疫、抑制肿瘤、延缓衰老、降血脂、降血糖等多种药理作用[2]。最近Gao等[3]的研究表明,LBP通过调节海马神经元的凋亡和再生,从而提高脑外伤大鼠的认知能力;Yang等[4]亦报道,LBP通过保护血脑屏障对脑缺血再灌注引起的脑损伤产生保护作用,提示LBP在神经系统损伤中可能发挥重要作用。本实验采用线栓法建立小鼠局灶性脑缺血再灌注损伤模型,观察LBP对脑缺血再灌注损伤的保护作用及对氧化应激的影响,以探讨其治疗缺血性脑卒中的作用机制。
1 材料与方法
1.1实验动物健康6周龄ICR小鼠,清洁级,雄性,体质量20~25 g,由南通大学实验动物中心提供。
1.2药物与试剂枸杞多糖(LBP,宁夏沃福百瑞生物食品工程有限公司);尼莫地平注射液(拜耳医药);2,3,5-氯化三苯基四氮唑(TTC,国药集团化学试剂有限公司);NOX4(CellSignalingTechnology公司);β-actin(Sigma公司);SOD,GSH-Px,MDA试剂盒均购于南京建成生物工程研究所。
1.3主要仪器体视显微镜(SZM45,宁波舜宇),UV-2501PC紫外可见分光光度计(日本岛津),电子天平(AL104,Mettler-Toledo公司),超声细胞破碎仪(Sonics&Meterials公司),蛋白定量仪(Biorad公司),电泳仪(powerPAC2000,Biorad公司),共聚焦荧光显微镜(C1SL,Nikon公司),离心机(MicroCL21R,ThermoScientific,德国)。
1.4实验分组将实验小鼠随机分为6组,每组30只,分别为假手术组、MCAO模型组、LBP大剂量组(100 mg/kg)、LBP中剂量组(50 mg/kg)、LBP小剂量组(25 mg/kg)和尼莫地平组(4 mg/kg)组。各组动物腹腔注射给药,1次/d,连续7 d,末次给药1 h后进行手术。假手术组和模型组每次注射等量生理盐水,其余实验步骤与LBP干预组相同。
1.5小鼠脑缺血再灌注损伤(MCAO)模型的制备参考Longa等[5]的方法,制备小鼠脑缺血再灌注模型:用4%水合氯醛(350 mg/kg)将小鼠腹腔注射麻醉,仰卧位固定,注意保持呼吸通畅。酒精棉球颈部消毒,用手术剪沿颈中打开1 cm左右的切口。在体视显微镜下钝性分离下颌下腺,游离右侧颈总动脉、颈外动脉及颈内动脉,颈总动脉上用一丝线扎紧。在颈外动脉与颈总动脉分叉处用丝线打一松结,将颈外动脉远端用丝线结扎,用一烧红的手术镊将颈外动脉熔断游离;用丝线将颈内动脉扎紧,用显微眼科手术剪刀将颈外动脉剪一小孔,将线栓通过小孔向下插入至颈外动脉,松开颈内动脉上的线结,将线栓缓慢向颈内动脉方向插入,直至感到阻力时即止,为防止出血,将颈外动脉上线结扎紧。颈部伤口常规缝合。缺血2 h后,将线栓拔出,使动脉血重新流通24 h。假手术组手术步骤同前,不插入线栓。术后将动物置于室温25~28 ℃,自由饮水、进食。
1.6神经症状评分小鼠脑缺血再灌注24 h后,采用Longa(0-4分)5分制[5]对小鼠的神经功能缺损进行评分:0分:活动正常,无神经功能障碍者;1分:左前肢不能完全伸直;2分:爬行时向左转圈者;3分:爬行时向左侧倾倒;4分:意识丧失,不能行走者。
1.7脑梗死体积的测定小鼠脑缺血再灌注24 h后,断头取脑,迅速置于-20 ℃冰箱中冷冻20 min后取出,去除嗅球、小脑和低位脑干,在操作台上将脑组织由前向后行2.0 mm厚的连续5片冠状切片,将脑片置于1%的TTC(0.1 ml,1 mol/L KH2PO4)磷酸盐缓冲液中,37 ℃避光温浴30 min。用扫描仪按顺序扫描染色后的脑片,采用计算机软件系统测量脑梗死面积,并计算脑梗死区占大脑总体积的百分比。
1.8脑含水量测定小鼠脑缺血再灌注24 h后,快速断头取脑,称取左右大脑半球湿重,置于电热恒温干燥箱中110~115 ℃烘烤至恒重,称取干重。计算脑含水量,计算公式为:含水量=(湿质量-干质量)/湿质量×100%。
1.9WesternBlotting检测将取好的小鼠大脑缺血侧皮质组织置于0.8 ml细胞裂解液中,低温下超声匀浆。离心机中12000 r/min、4 ℃离心10 min,分取上清液,置于-20 ℃冰箱中保存备用。取上述处理过的1 μl溶液,采用BCA法测定各组蛋白含量,用配置好的细胞裂解液按比例调整蛋白浓度。样品中加入上样缓冲液,混合均匀后于95 ℃变性处理5 min。上样,安排β-actin参照,SDS-PAGE电泳,电压110 V,分离蛋白质。电泳结束后,取出凝胶置于转移缓冲液中平衡,凝胶上的蛋白转移到硝酸纤维素膜上。转膜结束后,用TBST溶液洗膜,常温封闭1 h。封闭结束后,TBST溶液洗膜,将膜放入塑料袋中,按0.1 ml/cm2加入一抗溶液(NOX4,β-actin,1∶1000,5%脱脂牛奶溶液),混匀后将塑料袋中的气泡去除,用封膜机封口,置于4 ℃中过夜。次日取出硝酸纤维素膜,用TBST溶液漂洗3次,每次10 min。在膜上加入荧光二抗(1∶20000,用5%脱脂牛奶稀释),室温下杂交炉中轻轻振荡1 h,取出膜,PBS溶液中洗膜3次,每次10 min。用Odyssey Western Blot机器扫描获取Western条带图片。
1.10DHE染色法检测脑组织中ROS配置染色工作液:将染色液(ReagentB)置入冰槽里融化,稀释液(ReagentC)置于室温预热。吸取500 μl染色液(ReagentB)至1.5 ml离心管,再加入500 μl稀释液(ReagentC),混合均匀,避光放置。小鼠脑组织用冰冻切片机切成20 μm厚的脑片,加上20 μl预冷的清理液(ReagentA),铺满整个切片表面。小心移去切片上的清理液(ReagentA),加上20 μl室温预热的染色工作液,铺满整个切片表面,置于37 ℃培养箱里孵育20 min。小心移去切片上的染色液,加上20 μl清理液(ReagentA),小心移去切片上的清理液(ReagentA),封片。激光共聚焦荧光显微镜下观察和摄片。
1.11脑组织SOD、GSH-Px及MDA的测定小鼠脑缺血再灌注24 h后,将各组小鼠断头处死,快速于冰浴上取出全脑,去掉嗅球、小脑和低位脑干,将小鼠缺血侧脑组织以冰水预冷的生理盐水制成10%脑组织匀浆。按照试剂盒说明书方法,分别测定SOD活力、GSH-Px活性及MDA含量。
2 结 果
2.1LBP对脑缺血再灌注小鼠脑梗死范围的影响缺血再灌24 h后,假手术组小鼠脑组织没有梗死灶,与假手术组比较MCAO组脑组织梗死百分比显著升高;与MCAO组相比,给药组LBP(100 mg/kg、50 mg/kg)组及尼莫地平组脑梗死范围明显减小(P<0.01,P<0.05,P<0.05),提示LBP对小鼠缺血再灌注脑损伤有保护作用(见图1)。
2.2LBP对脑缺血再灌注小鼠神经功能缺损的影响缺血再灌24 h后,假手术组小鼠行为正常,无神经功能缺损症状。MCAO组小鼠均出现明显的神经行为缺陷症状,给药组LBP(100 mg/kg、50 mg/kg)及尼莫地平组能明显减轻小鼠神经症状(P<0.05,P<0.05,P<0.05),提示LBP对缺血再灌注小鼠神经损伤有明显改善作用(见表1)。
2.3LBP对脑缺血再灌注小鼠脑含水量的影响缺血再灌24 h后,与假手术组比较MCAO组小鼠脑含水量明显升高(P<0.01),给药组LBP(100 mg/kg、50 mg/kg)及尼莫地平组与MCAO组比较脑含水量明显降低(P<0.05,P<0.05,P<0.05),提示LBP能够抑制缺血再灌注损伤引起的脑水肿(见表1)。
2.4LBP对脑缺血再灌注小鼠大脑皮质NOX4蛋白表达的影响小鼠脑缺血再灌注24 h后,与假手术组相比,MCAO组小鼠大脑皮质缺血区NOX4蛋白表达明显增高。LBP(100 mg/kg、50 mg/kg、25 mg/kg)剂量组NOX4水平较MCAO组显著降低(P<0.01)。提示LBP能够抑制缺血损伤小鼠大脑皮质NOX4表达的增高(见图2)。
2.5LBP对小鼠缺血侧脑组织ROS含量的影响DHE染色结果显示,小鼠脑缺血再灌注24 h后,与假手术组相比,MCAO组小鼠大脑皮质缺血区ROS含量明显增高,LBP(100 mg/kg、50 mg/kg、25 mg/kg)剂量组ROS水平较MCAO组显著降低(P<0.01)。提示LBP能够抑制缺血损伤小鼠大脑皮质ROS的生成。(见图3)。
2.6LBP对小鼠缺血侧脑组织匀浆SOD活性的影响与假手术组相比,MCAO组小鼠脑组织匀浆SOD活力明显降低(P<0.01),LBP(100 mg/kg、50 mg/kg、25 mg/kg)剂量组及尼莫地平组与MCAO组相比SOD活力明显增高(P<0.01,P<0.01,P<0.05,P<0.01),提示LBP能提高缺血再灌小鼠脑组织SOD活力(见表2)。
2.7LBP对小鼠缺血侧脑组织匀浆GSH-Px活力的影响与假手术组相比,MCAO组小鼠脑组织匀浆GSH-Px活力明显降低(P<0.01),LBP(100 mg/kg、50 mg/kg、25 mg/kg)剂量组和尼莫地平组与MCAO组相比GSH-Px活力明显增高(P<0.01,P<0.01,P<0.05,P<0.01),提示LBP能提高缺血再灌小鼠脑组织GSH-Px活力(见表2)。
2.8LBP对小鼠缺血侧脑组织匀浆MDA含量的影响与假手术组相比,MCAO组小鼠脑组织匀浆MDA含量明显升高(P<0.01),LBP(100 mg/kg、50 mg/kg)剂量组及尼莫地平组与MCAO组相比MDA含量明显降低(P<0.01,P<0.05,P<0.05),提示LBP能降低缺血再灌小鼠脑组织MDA含量(见表2)。

表1 LBP对脑缺血再灌注小鼠神经功能缺损和脑含水量的影响±s)
*P<0.05,**P<0.01 vs vehicle

表2 LBP对小鼠缺血再灌注后SOD、GSH-PX、MDA的影响
*P<0.05,**P<0.01 vs vehicle

图1LBP(100 mg/kg、50 mg/kg)组及尼莫地平组脑梗死范围较模型组减小(P<0.01)
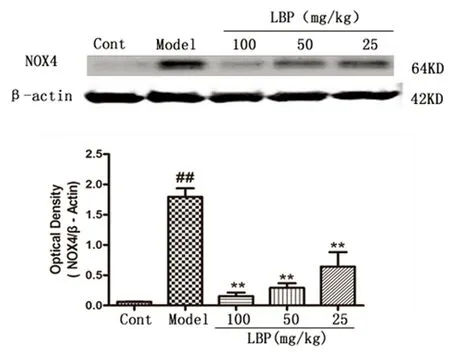
图2LBP降低小鼠脑缺血再灌注24 h大脑皮质NOX4水平,与假手术组比较##P<0.01,与模型组比较**P<0.01

A:假手术组;B:模型组;C:LBP 100 mg/kg组;D:LBP 50 mg/kg组;E:LBP25 mg/kg组
3 讨 论
在缺血性脑血管病的治疗中,恢复缺血区的血流或加强对缺血区的血流供应是减轻缺血对中枢神经系统细胞结构和功能损伤的必要条件。但是,大量研究表明,如果脑血流的疏通和恢复超过一定的时间点,不仅不能改善缺血引起的组织损伤和功能障碍,反而会造成神经损伤进一步加重,这种现象即缺血再灌注损伤。抑制再灌注损伤是治疗缺血性脑血管病的重要环节[6,7]。本研究采用小鼠短暂性局灶性大脑中动脉阻塞模型观察LBP对脑缺血再灌注损伤的作用,结果显示LBP不但能够改善缺血再灌注损伤小鼠的神经功能障碍,而且能减小脑梗死体积,降低脑水肿的程度,说明LBP干预对小鼠脑缺血再灌注损伤具有保护作用。
脑缺血后,炎症、凋亡、氧化应激、兴奋性毒性等多种因素相互作用,相互影响,从而加剧神经损伤的发生、发展[8]。近年来的研究表明,氧化应激反应在脑缺血再灌注损伤中起核心作用,脑缺血时,氧化应激及其产生的超氧阴离子、羟自由基等活性氧自由基(reactive oxygen species,ROS)损害是急性脑缺血损伤的重要机制[9,10]。NADPH氧化酶是超氧阴离子专有催化酶,在氧自由基的产生过程中起着重要作用。NADPH氧化酶类有多种形式的亚单位复合体,脑组织中主要的NADPH氧化酶为其亚型NOX2,NOX4,NOX5等。在脑组织中,NOX4在内皮细胞、神经元和胶质细胞中均有表达。研究表明,当局灶性脑缺血发生时,NOX4的表达明显上升,导致ROS的生成增多[11]。本实验结果显示,LBP能够显著下调缺血再灌引起的小鼠大脑皮质NOX4表达的增高,从而抑制脑组织中ROS的生成,对小鼠脑缺血再灌注损伤产生保护作用。
脑缺血时产生的大量ROS过度消耗了机体内源性抗氧化酶,导致多种酶的表达和活性发生改变,如SOD、GSH-Px、CAT等。抗氧化酶活性的降低,使脑组织清除ROS的能力下降,过量蓄积的ROS可引起脂肪氧化,蛋白质氧化和DNA损伤,能量代谢衰竭,甚至细胞死亡[12]。MDA是ROS攻击生物膜中多不饱和脂肪酸引发脂质过氧化反应的最终产物,其含量的变化间接地反映了氧自由基含量的变化及其对组织的损伤程度。本实验结果显示,LBP能明显抑制缺血再灌损伤小鼠脑组织中ROS的生成,升高SOD活力和GSH-Px活力,减少MDA含量,提示LBP可能通过减少自由基的生成,增强机体清除自由基能力,抑制脂质过氧化反应,而减轻脑组织的损伤。
[1]Schmidt A,Wellmann J,Schilling M,et al. Meta-analysis of the efficacy of different training strategies in animal models of ischemic stroke[J]. Stroke,2014,45(1):239-247.
[2]Cheng J,Zhou ZW,Sheng HP,et al. An evidence-based update on the pharmacological activities and possible molecular targets of Lycium barbarum polysaccharides[J]. Drug Design,Development and Terapy,2015,9:33-78.
[3]Gao J,Chen C,Liu Y,et al. Lycium barbarum polysaccharide improves traumatic cognition via reversing imbalance of apoptosis/regeneration in hippocampal neurons after stress[J]. Life Sciences,2015,121:124-134.
[4]Yang D,Li SY,Yeung CM,et al. Lycium barbarum extracts protect the brain from blood-brain barrier disruption and cerebral edema in experimental stroke[J]. PLoS One,2012,7(3):e33596.
[5]Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20:84-91.
[6]Eltzschig HK,Eckle T. Ischemia and reperfusion-from mechanism to translation[J]. Nat Med,2011,17:1391-1401.
[7]Nagy K,Domoki F,Bari F. Ischemic preconditioning in the brain[J]. Ideggyogy Sz,2005,58:305-313.
[8]Zhang J,Fang X,Zhou Y,et al. The Possible Damaged Mechanism and the Preventive Effect of Monosialotetrahexosylganglioside in a Rat Model of Cerebral Ischemia-Reperfusion Injury[J]. J Stroke Cerebrovasc Dis,2015,24(7):1471-1478.
[9]Ozkul A,Akyol A,Yenisey C,et al. Oxidative stress in acute ischemic stroke[J]. J Clin Neurosci,2007,14(11):1062-1066.
[10]Liu P,Zhao H,Wang R,et al. MicroRNA-424 protects against focal cerebral ischemia and reperfusion injury in mice by suppressing oxidative stress[J]. Stroke,2015,46(2):513-519.
[11] Chen H,Song YS,Chan PH. Inhibition of nadph oxidase is neuroprotective after ischemia-reperfusion[J]. J Cereb Blood Flow Metab,2009,29:1262-1272.
[12]Liu Y,Zhang L,Liang JG. Activation of the Nrf2 defense pathway contributes to neuroprotective effects of phloretin on oxidative stress injury after cerebral ischemia/reperfusion in rats[J]. Journal of the Neurological Sciences,2015,351:88-92.
Neuroprotection of LBP on a mouse model of transient focal cerebral ischemia and its protective mechanisms of inhibiting oxidative stress
GEJianbin,LUHongjian,SONGXinjian,etal.
(TheSecondPeople’sHospitalofNantong,Nantong226002,China)
ObjectiveTo observe the protective effects of lycium barbarum polysaccharides (LBP) on cerebral ischemia-reperfusion injury in mice and explore its mechanism. MethodsCerebral ischemia-reperfusion injury in mice was induced by middle cerebral artery occlusion. The neurological outcome,infarct size and water contents were evaluated. Western blotting was used to evaluate the protein levels of NOX4.DHE staining was used to evaluate levels of ROS. SOD and GSH-Px activity,MDA levels of ischemia cerebral tissue were determined by spectrophotometry using commercial kits. ResultsLBP markedly improved neurologic deficits,and decreased infarct size and edema at 24 h after reperfusion in mice. Western blot analysis indicated that LBP markedly down-regulated the protein level of NOX4. DHE staining indicated that LBP decreased the levels of ROS in ischemic cortex 24 h after reperfusion. SOD activity and GSH-Px activity in LBP groups was higher,and MDA level in LBP groups were significantly lower than those in vehicle group.ConclusionLBP has protective effects on cerebral ischemia-reperfusion injury in mice,and this effect may be associated with inhibiting oxidative stress induced by cerebral ischemia-reperfusion.
LBP;Cerebral ischemia;Oxidative stress;NOX4;ROS
1003-2754(2016)09-790-05
2016-03-15;
2016-09-03
国家自然科学基金青年项目(No.31500822);南通市社会事业科技创新与示范计划项目(No.HS2013020)
(1.南通市第二人民医院,江苏 南通 226002;2.苏州大学药理教研室,江苏 苏州 215123;3.南通大学药理教研室,江苏 南通 226001)
吴锋,Email:cuileish@163.com
R743
A
