高效液相色谱法测定马铃薯中GA3含量
2016-10-29许立兴崔新仪关文强王艳斌
雷 静,许立兴,崔新仪,关文强,*,李 宁,王艳斌
(1.天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津300134;2.天津农学院园艺系,天津300384)
高效液相色谱法测定马铃薯中GA3含量
雷静1,许立兴1,崔新仪2,关文强1,*,李宁2,王艳斌1
(1.天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津300134;2.天津农学院园艺系,天津300384)
建立了高效液相色谱法测定马铃薯中赤霉素(GA3)含量的方法。采用反相C18色谱柱,以甲醇∶水=3∶7(V∶V)为流动相,流速1.0 mL/min,进样量20μL,检测波长为235 nm。GA3的平均回收率为99.13%,方法检出限为0.09mg/kg,定量限为0.12mg/kg。该方法操作简单,可快速、准确地分离和测定马铃薯中的GA3含量。
高效液相色谱法;赤霉素;马铃薯;检测
马铃薯块茎在萌芽前需经历一段时间的休眠期。在马铃薯的休眠期内,即使块茎处于一个适宜发芽的条件下也不会发芽[1]。马铃薯块茎休眠期的长短受诸多因素的影响,其中内源激素含量对块茎的休眠与萌发起着主导性的作用[2-6]。赤霉素为一大类植物激素,其中使用最广和研究最多的是GA3,其对于打破马铃薯休眠,促进马铃薯块茎萌发具有重要作用[7]。植物内源赤霉素在马铃薯中含量甚微,激素类似物干扰组分多,且其对温度等条件极为敏感,因而准确测定其含量比较困难。
植物内源赤霉素的主要测定方法有免疫分析法、气相色谱法(GC)、高效液相色谱法(HPLC)和色谱-质谱联用法。其中免疫分析法主要是酶联免疫法(ELISA)和放射免疫法(RIA)。ELISA法选择性高、灵敏度强,并且操作简便,但对于植物激素进行定量分析时,测定结果的准确性和重现性差,因此并未得到广泛使用。RIA法灵敏度高,能够达到nmol或pmol的检测水平,但测定时需125I和3H等放射性同位素。由于放射性同位素的稳定性差,并且对操作者会造成身体损害,因此RIA法已较少使用。GC法需要被测物具有较低的极性和气化温度,但赤霉素的挥发性较差,需对其进行一系列复杂的衍生化处理后才能进行GC分析,繁琐的样品前处理增加了工作量,不利于大批量检测[8]。色谱-质谱联用法测定结果准确且重复率高,但样品净化过程较为复杂,测定成本相对较高[9]。HPLC法是比较理想的植物内源赤霉素的分析方法,具有较强的专一性,且重复性好,现已在多种植物激素的分析中得到应用[10-12]。
目前马铃薯中GA3的提取大多采用80%甲醇提取后,经旋转蒸发法浓缩,其提取过程复杂,且用时较长,不利于快速测定马铃薯中GA3的含量[13-14]。HPLC法在测定内源赤霉素时,经常会出现分离效果差、峰形不良及拖尾严重等问题,因此选择合适的GA3提取方法和色谱条件尤为重要。本试验采用高效液相色谱法对马铃薯块茎中的GA3含量进行测定,建立灵敏、简单、快速的马铃薯中GA3含量的测定方法,以期为进一步研究马铃薯萌芽过程中的GA3代谢与调控奠定基础。
1 材料与方法
1.1材料与设备
1.1.1材料与试剂
马铃薯,品种为大西洋,由天津市西青区辛口镇第六埠村脱毒马铃薯微型种薯繁育基地提供;GA3标样,纯度≥98%,由美国Sigma公司生产;甲醇(色谱纯),由天津康科德化学试剂公司生产;1,2-二氯乙烷(色谱纯),由天津市津科精细化工研究所生产;冰乙酸(色谱纯),由天津市赢达稀贵化学试剂厂生产;浓盐酸(分析纯),由天津市化学试剂批发公司生产;试验用水为娃哈哈纯净水。
1.1.2仪器与设备
LC-20A日本岛津高效液相色谱仪(LC-20T二元梯度泵,SPD-M20A检测器,SIL-20A自动进样器),SPE C18固相萃取柱(规格:500 mg,6 mL),TUBE-MILL control试管研磨机,FD8-4西盟国际真空冷冻干燥机,Extrapid柱-盘式手动固相萃取仪,BDSThermo C18反相色谱柱。
1.2方法
1.2.1处理方法
马铃薯采收后立即运送至天津商业大学冷库,16℃愈伤一周后贮藏于10℃冷库中,每45 d取样进行测定。测定时将马铃薯从冷库中取出,每6个马铃薯为一组,用削皮器去皮(2mm左右)后切成1 cm3的方块混匀,取部分样品真空冷冻干燥72 h,取出后用试管研磨机粉碎,装入175mm×130mm×0.12mm规格的聚乙烯自封袋中密封保存,于-28℃冰箱中备用。试验重复3次。
1.2.2标准品的制备
精密称取GA3标准品5.0mg于5mL棕色容量瓶中,用50%的甲醇溶解后稀释至刻度,制得浓度为1mg/mL的溶液作为标准储备液,于-20℃冰箱中避光保存。
1.2.3样品前处理
马铃薯赤霉素的提取参照Pan等[11]的方法并稍作改动。称取真空冷冻干燥后的马铃薯粉末2.00 g(相当于鲜样7.50 g),加入10mL丙醇∶水∶浓盐酸= 2∶1∶0.002(V∶V∶V)的混合溶液,于4℃下振荡30min,加入10mL二氯乙烷,4℃下振荡30min后于4℃、12 000 r/min条件下离心15min,取下清液,并向残渣中加入2mL二氯乙烷,二次离心,合并下清液为粗提液。将粗提液真空冷冻干燥(-80℃,12 h),所得残留物加入5mL磷酸盐缓冲液(0.01mol/L,pH=3.5)中溶解,经预活化的C18柱(6mL甲醇活化后用6mL 80%甲醇平衡)过滤,以1mL的80%甲醇进行洗脱,并收集全部洗脱液,真空冷冻干燥后用流动相溶解残渣并定容至1mL,溶液经0.45μm滤膜过滤,滤液用于HPLC测定。
1.2.4色谱条件
BDSThermo C18反相色谱柱(250mm×4.6mm,5μm);流动相为甲醇∶水=3∶7(V∶V);流速:1.0mL/min;进样量:20μL;波长:235 nm;柱温:30℃。
1.2.5试验方案设计
1.2.5.1流动相的筛选
分别以甲醇∶水(用乙酸调节pH=3)=5∶5(V∶V)、4∶6(V∶V)、3∶7(V∶V)以及甲醇∶水=5∶5(V∶V)、4∶6(V∶V)、3∶7(V∶V)为流动相,在流速为1.0mL/min,进样量为20μL,检测波长为205 nm,柱温为30℃的色谱条件下对GA3标准品(10μg/mL)进行分离,筛选最佳流动相。
1.2.5.2流速的筛选
分别以0.8、1.0、1.5mL/min为流速,在流动相为甲醇∶水=3∶7(V∶V),进样量为20μL,检测波长为205nm,柱温为30℃的色谱条件下对马铃薯样品中的GA3进行分离检测,筛选最佳流速。
1.2.5.3波长的选择
分别以205、215、225、235 nm为检测波长,在流动相为甲醇∶水=3∶7(V∶V),流速为1.0mL/min,进样量为20μL,柱温为30℃的色谱条件下对马铃薯样品中的GA3进行分离检测,筛选最佳检测波长。
1.2.5.4内源激素的定性分析
将1.0mg/mLGA3储备液稀释至10μg/mL的标准溶液,采用“1.2.4”中的色谱条件对GA3标准溶液进行分离检测。
1.2.5.5标准曲线及检出限
向基质中分别加入浓度为3、10、20、30、40μg/mL的标准品,以基质加标浓度为横坐标,峰面积为纵坐标进行标准曲线的绘制。将GA3的标准品溶液逐级稀释后进样,根据3倍信噪比的峰响应值,计算出此方法检出限;根据10倍信噪比的峰响应值,得出定量限。
1.2.5.6回收率的测定和实际样品分析
按“1.2.3”所述方法进行马铃薯块茎中的GA3提取,并按照“1.2.4”中的色谱条件进行测定,在已测样品中加入2μg/g及4μg/g的标准品,测定GA3含量,计算加标回收率。利用“1.2.3”中的提取方法以及“1.2.4”中的色谱条件,分别对0、45、90 d的马铃薯样品进行GA3的提取测定。
2 结果与分析
2.1流动相的选择
流动相筛选试验发现,以甲醇∶水(用乙酸调节pH=3)=5∶5(V∶V)、4∶6(V∶V)、3∶7(V∶V)为流动相,对GA3标准品(10μg/mL)进行测定,分离效果不理想。由图1可以看出,选用不同比例的甲醇-水作为流动相,对GA3标准品进行分离,结果发现,以甲醇∶水= 5∶5(V∶V)或者4∶6(V∶V)为流动相时,色谱峰不能实现彻底分离(图1A,图1B);而以甲醇∶水=3∶7(V∶V)为流动相时,液相色谱峰尖锐,且分离度高,重复性好(图1C)。因此本试验以甲醇∶水=3∶7(V∶V)为流动相。
2.2流速的选择
试验共考察了0.8、1.0、1.5mL/min三个流速,比较其对GA3样品分离效果的影响。通过检测发现,当流速为0.8mL/min时,GA3的保留时间为7.196min;当流速为1.5 mL/min时,GA3的保留时间缩短至3.615min,但受到样品中杂质的干扰,出现杂质峰与目标峰重叠现象严重的问题;当流速为1.0mL/min时,GA3的保留时间为5.424min,此时,杂质峰和目标峰可实现有效分离。经过筛选最终确定测定的最佳流速为1mL/min。
2.3波长的选择
由图2可见,在205 nm(图2A)、215 nm(图2B)、225 nm(图2C)检测波长下样品中杂质干扰性较强,不能实现GA3的有效分离;235 nm(图2D)下分离度最好,目标峰与样品中的杂峰均分离良好,色谱峰形对称。
2.4内源激素的定性分析
采用“1.2.4”中的色谱条件对GA3标准品进行分离。结果表明,GA3的保留时间为(5.424±0.072)min。
2.5标准曲线及检出限
为了减少基体效应的影响,本试验采用试样基体加标法绘制标准曲线来减小基质的干扰,结果如图3所示。经计算得出GA3的标准曲线回归方程为:y=3 386.5x+2 619.7,相关系数R2=0.999 1,线性关系良好,符合分析要求。该方法检出限为0.09mg/kg,定量限为0.12mg/kg。
2.6回收率的测定和实际样品分析
由表1可见,加标后回收率分别为100.50%和97.75%,相对标准偏差分别为1.54%和3.57%。GA3的平均回收率为99.13%,平均相对标准偏差为2.56%,符合定量分析的要求,并且数据误差小,说明上述样品提取方法及色谱测定条件是可行的。
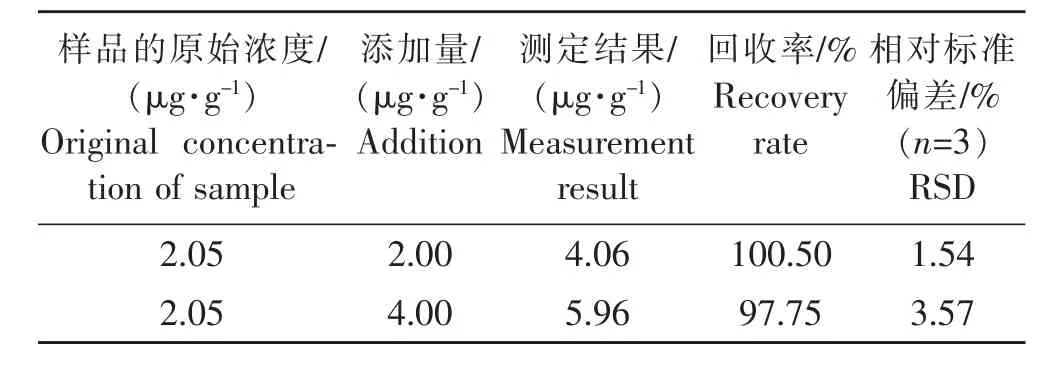
表1 GA3加标回收率Table 1 Standard addition recovery rate of GA3
马铃薯贮藏期间GA3的变化见图4。由图4可以看出,马铃薯中GA3含量随贮藏时间的延长呈先上升后下降的趋势,周长艳[15]对4种窖藏方式下马铃薯中GA3变化情况进行了研究,结果表明,4种窖藏方式下马铃薯中GA3含量均呈先上升后下降的趋势,这与本试验结果相似。马铃薯在休眠期时,GA3含量随贮藏时间的延长逐渐升高,当含量升高至一定的阈值时会引起马铃薯块茎休眠解除[7]。本试验测定马铃薯中GA3含量最高为3.52μg/g,最低为2.04μg/g。
3 结论
本试验采用高效液相色谱法对马铃薯中的GA3含量进行检测。结果表明,在以甲醇∶水=3∶7(V∶V)为流动相,流速1.0 mL/min,进样量20μL,检测波长为235 nm,柱温为30℃条件下能实现马铃薯中GA3的有效分离,方法检出限为0.09mg/kg,定量限为0.12mg/kg。该方法能满足马铃薯贮藏过程中GA3变化的检测要求,为进一步研究马铃薯中的激素代谢奠定了基础。
[1]SUTTLE JC.Involvementofendogenous gibberellins in potato tuberdormancyand earlysproutgrowth:acriticalassessment[J]. JournalofPlantPhysiology,2004,161(2):157-164.
[2]ITTERSUM M K V.Relation between growth conditions and dormancyofseed potatoes.3.Effectsof light[J].PotatoResearch,1992,35(4):377-387.
[3]ITTERSUM M K V,SCHOLTE K.Relation between growth conditions and dormancy of seed potatoes.2.Effects of temperature[J].Potato Research,1992,35(4):365-375.
[4]JIZL,WANGSY.Reduction ofabscisic acid contentand induction ofsprouting in potato,Solanum tuberosum L.by thidiazuron[J].Journal of Plant Growth Regulation,1988,7(1):37-44.
[5]DONNELLY D J.COLEMANW K,COLEMAN SE.Potato microtuberproduction and performance:A review[J].American JournalofPotatoResearch,2003,80(2):103-115.
[6]DOGONADZEM Z,KORABLEVA N P,PLATONOVA T A,et al.Effect of gibberellin and auxin on the synthesis of abscisic acid and ethylyne in buds of dormant and sprouting potato tuber[J].Prikladnaia Biokhimiia IMikrobiologiia,2000,36(5):588-591.
[7]刘悦善,李 成,王东霞,等.加工型马铃薯品种微型薯种薯贮藏期内源激素含量、阈值和休眠期相关性分析[J].中国农业科学,2015,48(2):262-269.
[8]符继红,孙晓红,王吉德,等.植物激素定量分析方法研究进展[J].科学通报,2010,55(33):3163-3176.
[9]梁晓静,高 健,徐有明.高效液相色谱法测定毛竹种子萌发过程中GA3含量的变化[J].安徽农业大学学报,2011,38(4):496-499.
[10]王若仲,曹 庸.亚种间杂交稻内源激素的高效液相色谱测定法[J].色谱,2002,20(2):148-150.
[11]闫师杰,郭李维,吴彩娥,等.高效液相色谱法同时测定鸭梨种子中3种内源激素[J].分析化学,2010,38(6):843-847.
[12]PAN X,WELTIR,WANG X.Simultaneous quantification of major phytohormones and related compounds in crude plant extracts by liquid chromatography-electrospray tandem mass spectrometry[J].Phytochemistry,2008,69(8):1773-1781.
[13]程建新,毕 阳,田世龙,等.高效液相色谱法同时测定马铃薯块茎中的GA3、IAA和ABA含量[J].甘肃农业大学学报,
2013,48(2):26-29.
[14]程建新.CIPC对马铃薯块茎的抑芽效果及部分机理的研究[D].兰州:甘肃农业大学,2012:1-47.
[15]周长艳.不同贮藏条件下马铃薯生理特性的研究[D].呼和浩特市:内蒙古农业大学,2010:1-46.
Determ ination of Gibberellin Acid in Potato by High Performance Liquid Chromatography
LEIJing1,XU Li-xing1,CUIXin-yi2,GUANWen-qiang1,*,LINing2,WANG Yan-bin1
(1.Tianjin Key Laboratory of Food Biotechnology,CollegeofBiotechnology and Food Sciences,Tianjin University of Commerce,Tianjin 300134,China;2.Tianjin AgriculturalCollege,DepartmentofHorticulture,Tianjin 300384,China)
A high performance liquid chromatographic(HPLC)method was developed for the determination of gibberellin acid(GA3)in potato.The chromatographic separation was carried out on a reverse phase C18 column using methanol∶water=3∶7(V∶V).The flow ratewas1.0mL/min,the sample injection volumewas 20μL,and the detection wavelength was235 nm.The average recovery ofGA3was99.13%.The limitofdetectionwas0.09mg/kg,and the limit ofquantitywas0.12mg/kg.It showed a simple and convenientmethod for rapid,accurate separation and determination gibberellin acid in potato.
high performance liquid chromatography;gibberellin acid;potato;determination
S532
A
10.3969/j.issn.1009-6221.2016.04.022
国家自然科学基金项目(31271949)
雷静(1991—),女,汉族,硕士在读,研究方向:农产品加工与贮藏。
关文强,博士,教授,研究方向:农产品加工与贮藏。
2016-05-26
