薏仁米储藏过程中陈化机理的研究
2016-10-29杨凤仪卢红梅代来鑫常冬妹白成松贾青慧
杨凤仪,卢红梅,*,陈 莉,代来鑫,常冬妹,白成松,贾青慧
(1.贵州大学酿酒与食品工程学院,贵州贵阳 550025;2.贵州大学贵州省发酵工程与生物制药重点实验室,贵州贵阳 550025;3.贵州大学化学与化工学院,贵州贵阳 550025)
薏仁米储藏过程中陈化机理的研究
杨凤仪1,卢红梅1,*,陈莉1,代来鑫1,常冬妹2,白成松2,贾青慧3
(1.贵州大学酿酒与食品工程学院,贵州贵阳 550025;2.贵州大学贵州省发酵工程与生物制药重点实验室,贵州贵阳 550025;3.贵州大学化学与化工学院,贵州贵阳 550025)
以兴仁薏仁米为试材,采用厚度为0.08mm的PE自封袋包装,研究其在温度4~24℃ 、相对湿度74%~86%储藏条件下感官、理化、微生物、菌落总数、脂肪酸组成及含量、挥发性物质组成及含量和生化指标的变化。结果表明,随着储藏时间的延长,薏仁米色泽逐渐变暗变黄,储藏60 d时开始出现哈败味,形态变化从储藏120 d开始,时间越长薏仁米长虫现象越明显,劣变及哈败味越严重;薏仁米在储藏过程中,水分含量基本保持不变;脂肪酸值、过氧化值和菌落总数总体呈上升趋势,与之对应的薏仁米长虫、劣变及哈败味越严重;饱和脂肪酸含量呈上升趋势,不饱和脂肪酸含量呈下降趋势;丙二醛含量与过氧化物酶活性呈负相关关系。从薏仁米储藏期间感官及理化性质变化,结合挥发性物质与理化、生化指标的相关性分析得出:薏仁米储藏过程中的陈化主要与醇类、酯类物质的氧化、分解,醛类、酸类物质的形成相关,也与脂类氧化降解密切相关。脂肪酸值与过氧化值可作为判断薏仁米陈化的主要指标。
薏仁米;陈化机理;品质变化;储藏
薏仁米,别名川谷、草珠子、菩提珠、沟子米、慧苡仁,据《中国药典》收载,其为禾本科植物薏苡(Coix lacryma-jobi L.var.ma-yuen(Roman)Stapf)的干燥成熟种仁[1],具有健脾渗湿、除痹止泻、清热排脓、抗癌、降血糖、免疫调节等功效。但长期以来,薏仁米作为小品种的杂粮作物,未能被充分重视与利用,与大多粮食相比,薏仁米在储藏中更易陈化劣变,不仅食用、加工品质降低,还易产生安全问题。
国家粮食行业协会于2012年7月授予贵州省兴仁县“中国薏仁米之乡”的称号,兴仁薏仁米被确定为“国家地理标志保护产品”以及“兴仁薏仁米”地理标志证明商标获得注册后,贵州省薏仁米产业迎来了新的发展机遇与动力。兴仁县委、县政府建成了全省唯一的薏仁米产业园,实现了兴仁薏仁米产业链的延伸及产品的精深加工。
目前,国内外对薏仁米的研究大多集中在其营养价值[2-3]、药理作用[4-7]及产品开发上[8-10],而关于薏仁米陈化机理及品质变化的研究还鲜有报道。本研究以贵州省兴仁县产纯种小薏仁米为试材,分析在自然条件下储藏的薏仁米各理化、生化指标和脂肪酸组成及其含量的变化,重点探讨挥发性物质及其与各指标间的相关性,以期找到能反映薏仁米储藏品质的指标和薏仁米陈化变质的机理,指导薏仁米产业的生产实践。
1 材料与方法
1.1材料与设备
1.1.1材料与试剂
薏仁米为贵州兴仁县产纯种小薏仁米,购于贵州兴仁县贵州兴诚华英食品有限公司。PE自封袋(厚度为0.08mm),购于贵阳林城包装印刷设计有限公司。
磷酸氢二钾、磷酸二氢钾、盐酸、酚酞、三氯甲烷、乙醇、甲醇、硫代巴比妥酸、三氯乙酸、氯化亚铁、石油醚、氢氧化钾、硫氰酸钾、过氧化氢、愈创木酚等试剂均为分析纯。
1.1.2仪器与设备
7890A-5975C气相色谱-质谱联用仪,80-2电动离心机,101-1型电热鼓风干燥箱,HH-6型数显恒温水浴锅,FA2004N精密电子天平,SPX-250型生化培养箱,722S可见分光光度计。
1.2方法
1.2.1处理方法
薏仁米放入PE自封袋中,每袋100 g,共14袋,于自然条件下(温度4~24℃、相对湿度74%~86%)储藏6个月(6月至次年1月),每30 d测定1次各指标,每次取样200 g,共测定7次,每个指标重复测定3次。
1.2.2测定项目与方法
1.2.2.1感官品质评价
参照GB/T 5492—2008[11]中的方法进行评价。
1.2.2.2水分含量
参照GB 5497—85[12],采用直接干燥法测定。
1.2.2.3脂肪酸值
参照GB/T 5510—2011[13],采用滴定法测定。
1.2.2.4过氧化值
参照GB/T 5009.37—2003[14],采用比色法测定。
1.2.2.5脂肪酸组成
采用气质联用色谱法进行测定。
检测试样前处理:取5 g薏仁粉样品(过40目筛)用滤纸包好,用石油醚抽提4 h。取0.100 g油样置于具塞试管中,加入2mL正己烷,摇动溶解,再加入2mL 0.5mol/L的氢氧化钾-甲醇溶液,振摇5min,静置30min后,取上清液,用一次性过滤器通过0.22μm的滤膜到进样瓶,上气质联用仪测定。
色谱条件[15]:HP-弹性石英5%苯甲基硅烷毛细管柱(30m×0.25mm×0.25μm),进样口温度250℃,柱温160℃,保持5min,升温速率8℃/min,升至260℃,保持10min,氦气流速1mL/min,柱前压71 kPa,分流比10∶1,溶剂延误1.5min。
质谱条件[15]:El源,电子能量70 eV,发射电流300μm,电子倍增器电压1 635 eV,质量扫描范围10~550 u,接口温度280℃,离子源温度250℃,四极杆温度130℃。
1.2.2.6挥发性气体物质
样品处理:样品磨碎过40目筛,混匀。现磨现用,减少挥发性气体成分的损失。
测定参数选择:取相同质量的样品置于顶空瓶中,样品量占到顶空瓶体积的1/2~2/3为宜。顶空温度180℃,平衡6min后顶空进样。
气相条件:毛细管色谱柱:HP-5MS(30m×0.25mm× 0.25μm);柱温:程序升温50~80℃(3℃/min),停留时间1min,总时间11min,进样口温度280℃,分流比1∶1;载气为高纯氦气;载气流量1.0mL/min。
质谱条件:GC-MS接口温度280℃,EI电离源,电子能量70 eV。数据以30~505 u的扫描范围进行收集,通过将所得挥发性化合物的质谱数据与计算标准图谱库NIST11.L比较,对各种化合物的具体成分进行分析。
1.2.2.7过氧化物酶(POD)活性
采用比色法测定[16]。
1.2.2.8丙二醛(MDA)含量
采用比色法测定[17-18]。
MDA提取液制备:称取1.00 g薏仁粉(过40目筛),加入质量分数10%的三氯乙酸(TCA)4mL和少量石英砂,研磨至匀浆后转移至离心管中,然后每次用2mLTCA分3次清洗研钵,将清洗液一并转移至离心管中。4 000 r/min离心10min,上清液即为MDA提取液。
MDA含量测定:取提取液2mL,取2mL浓度为0.6%的硫代巴比妥酸(TBA)溶液,放入具塞试管中混匀,将混合液置于水浴锅中沸水浴15min,放入冷水浴中迅速冷却后再离心,取上清液分别于450、532、600 nm波长下测定吸光度(测定时以TBA溶液作为空白),计算MDA含量。
1.2.2.9菌落总数
参照GB 4789.2—2010[19],采用平板计数法测定。
1.2.3数据处理
每个样品进行3次平行试验,测定结果用Origin、Excel等软件进行数据处理。挥发性成分采用峰面积归一化法进行定量分析。采用SPSS软件进行相关性分析。
2 结果与分析
2.1薏仁米储藏过程中品质的变化
2.1.1色泽、形态和气味的变化
对薏仁米在自然条件储藏过程中色泽、形态及气味进行观察和记录,结果如表1所示。

表1 薏仁米色泽、形态和气味的变化Table 1 The changes of color,morphology and odour of coix seed
由表1可见,随着储藏时间的延长,薏仁米的色泽、形态及气味变化逐渐明显,色泽逐渐变暗变黄,储藏60 d时开始出现哈败味,形态变化从储藏120 d开始,时间越长薏仁米长虫现象越明显,劣变及哈败味越严重。
2.1.2理化指标的变化
由图1A可知,在6个月的储藏过程中,薏仁米水分含量在11.75%~13.12%范围内微量浮动。脂肪酸值随着储藏时间的延长逐渐升高,前60天增幅较大,从53.366mg/100g增至122.822mg/100g,增幅130.15%;90~180 d增幅较小,从124.407mg/100 g增长到
146.618mg/100g,增幅17.85%(图1B)。过氧化值在前60天内增长较快,达到4.871mmol/kg,之后略有下降,在第150天快速升至9.900mmol/kg并保持平稳(图1C)。
结合感官与理化指标可知,尽管储藏时间较短,但薏仁米的脂肪酸、过氧化值与色泽、形态和气味变化有良好的对应性。在脂肪酸值和过氧化值快速升高的前60天,薏仁米开始出现哈败味,随着储藏时间的延长,脂肪酸值和过氧化值逐渐升高,而对应的薏仁米的长虫、劣变及哈败味也越重,脂肪酸值和过氧化值能较灵敏地反映薏仁米品质的变化。
2.1.3菌落总数的变化
在薏仁米的储藏过程中,其品质变化会受到微生物的影响,本试验主要对薏仁米储藏过程中的菌落总数进行测定,结果见图2。
由图2可知,薏仁米菌落总数在储藏150 d内一直保持较低水平,呈先升后降再上升的趋势。但在储藏150 d后,菌落总数显著升高,这可能与第150天后长虫现象严重有关。
2.1.4薏仁米米虫生长
观察发现,薏仁米存放90 d后开始长虫,如图3所示,米虫从薏仁米中部深色部分开始蚕食,对白色淀粉部分损害较小,且薏仁米由丝状物相互粘连,14 d后,米虫吐丝结茧。
2.2薏仁米储藏过程中脂肪酸组成及含量的变化
薏仁米在储藏180 d期间脂肪酸组成及含量的变化如表2所示,共检测到20种脂肪酸,其中不饱和脂肪酸10种,分别为十六碳烯酸、十七碳烯酸、十七碳二烯酸、十八碳烯酸、十八碳二烯酸、十八碳三烯酸、十九碳烯酸、二十碳烯酸、二十碳二烯酸和二十二碳烯酸。
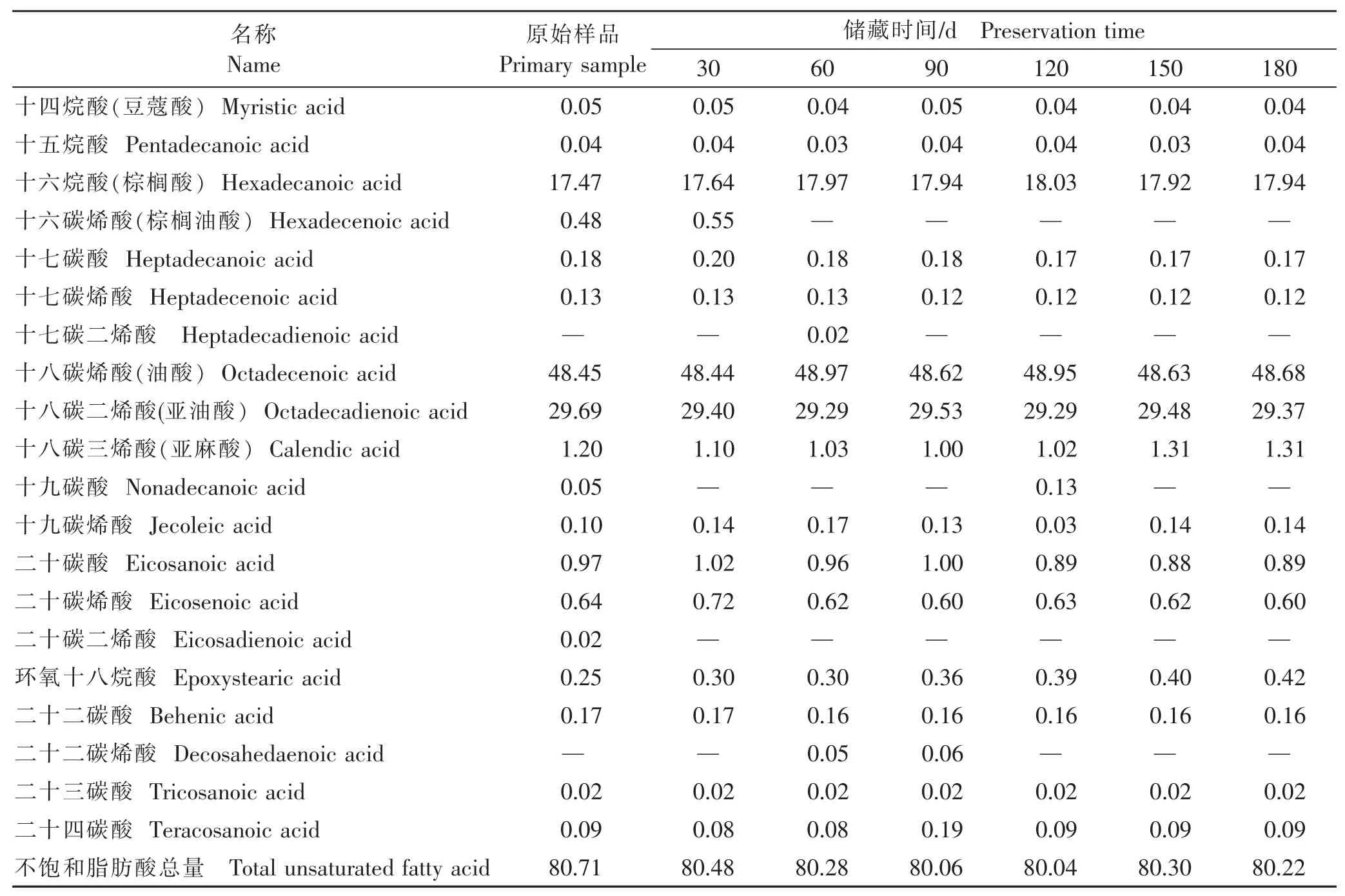
表2 薏仁米脂肪酸组成及含量的变化Table 2 The changes of the compositions and contents of coix seed fatty acid (%)
由表2可知,薏仁米中脂肪酸种类丰富,其中以油酸、亚油酸和亚麻酸等为主的不饱和脂肪酸占脂肪酸总量的80%以上。总体来看,在储藏过程中,饱和脂肪酸总量呈上升趋势,不饱和脂肪酸总量呈下降趋势。单不饱和脂肪酸和多不饱和脂肪酸总量波动较大,但总体均呈下降趋势。这种变化可能是由于薏仁米中的脂类不断氧化水解产生游离脂肪酸,而不饱和脂肪酸比饱和脂肪酸更易氧化,从而导致不饱和脂肪酸的比例下降[20]。在储藏过程中有5种脂肪酸不固定出现,其中有4种为不饱和脂肪酸,且只存在于储藏前期,饱和脂肪酸十九碳酸在原样及第120天储存时有检出,其他脂肪酸在储藏各个期间均有检出且含量变化较小,无明显规律。
2.3薏仁米储藏过程中挥发性物质的变化
以顶空固相微萃取-气相色谱质谱联用技术对不同储藏期薏仁米样品的挥发性成分进行测定,共得到31种气体成分,其中醇类9种、酯类3种、醛类4种、胺类6种、酸类3种及一些其他化合物,检测结果见表3。
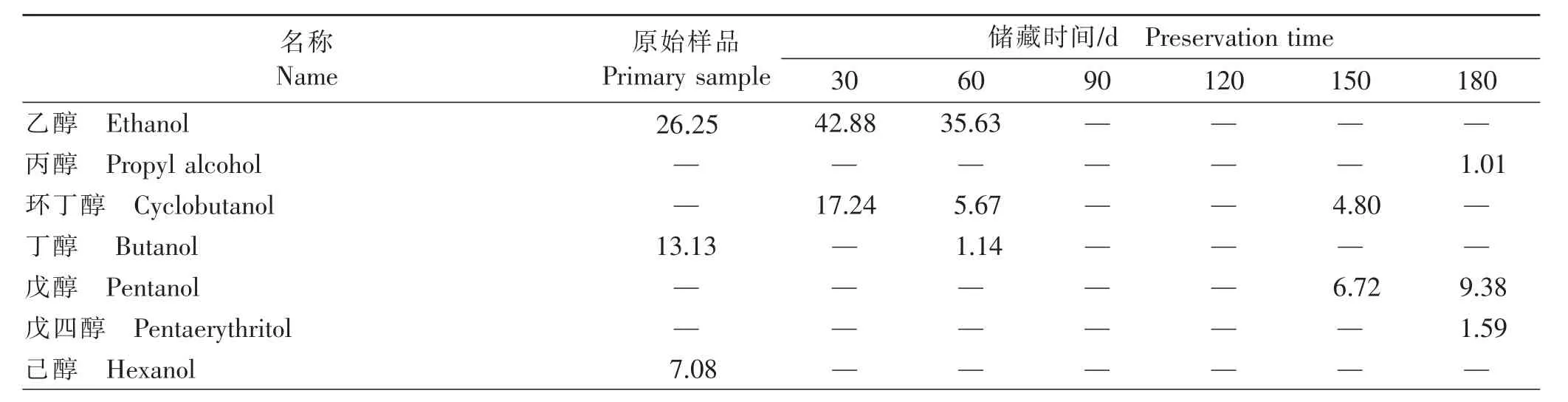
表3 薏仁米各挥发性成分及相对含量的变化Table 3 The changes of components and relative contentof volatilematter in coix seed (%)
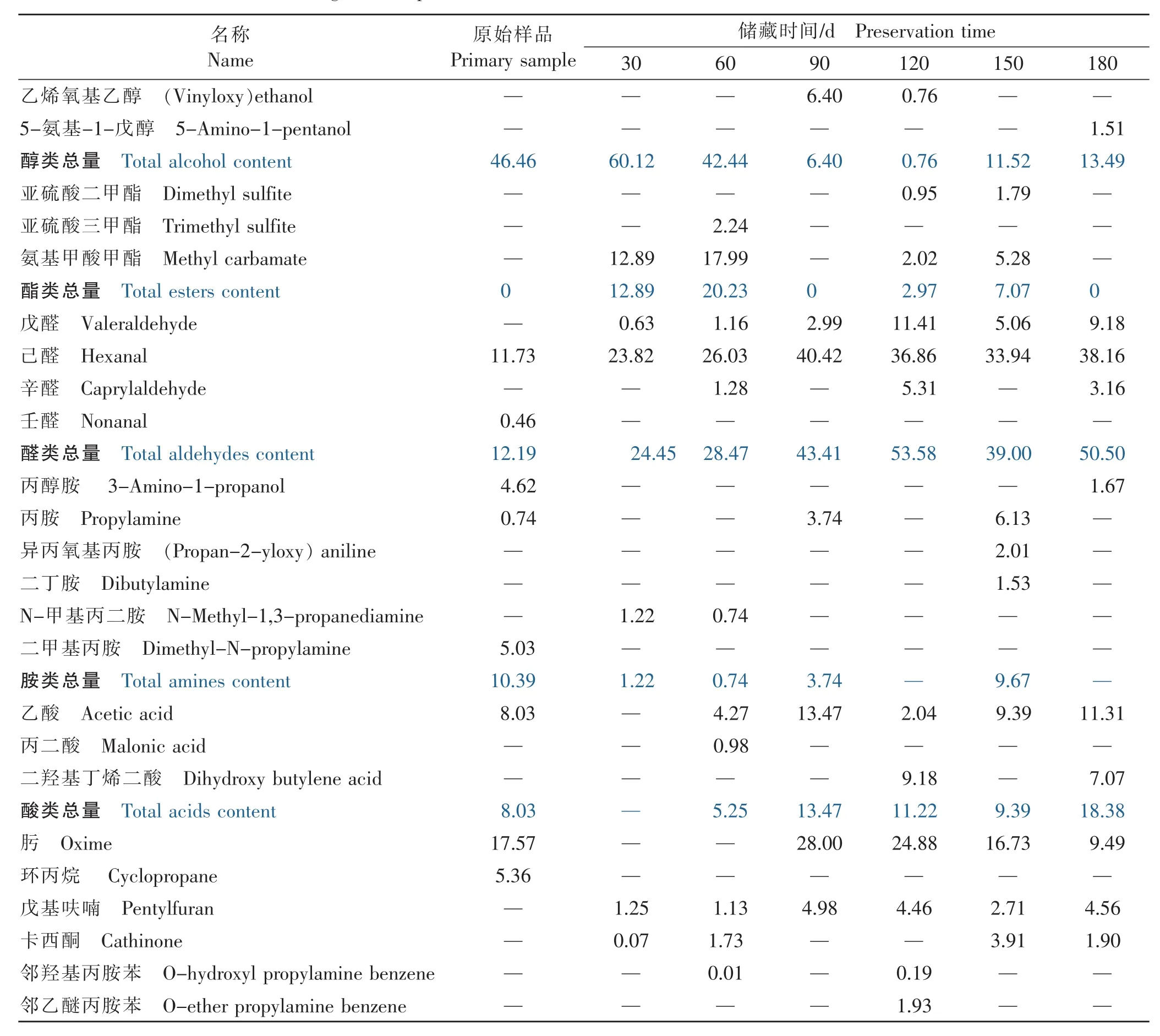
续表3 薏仁米各挥发性成分及相对含量的变化Continue table 3 The changes of components and relative content of volatilematter in coix seed (%)
由表3可知,薏仁米中各挥发性物质不固定地出现于整个储藏过程中,不同储藏时期主要挥发性物质有所不同。总体来看,醇类、酯类、胺类的相对含量降低,醛类、酸类的相对含量升高,醇类的相对含量波动较大。在储藏期间,醇类总量变化幅度较大,由第 30天的 60.12%降至第 120天时的最低值0.76%,之后升高至13.49%。酯类总量在储藏前60天较高,之后降低;醛类、胺类、酸类及肟的总相对含量具有相反的变化趋势,其中醛类总量在储藏第180天时达到50.50%,这与薏仁米随储藏时间的延长自身发生氧化酸败有关。据研究报道,大多数醛类物质是由不饱和脂肪酸氧化降解产生[21]。乙醇在初期含量较高且变化较大,氨基甲酸甲酯、戊醛、己醛、肟、乙酸、戊基呋喃及卡西酮出现在储藏的大多时期,为挥发性成分的特征物质,而其余物质的变化不具备明显的规律性。
2.4薏仁米储藏过程中生化指标的变化
测定的主要生化指标为MDA含量及POD活性。MDA是生物体内自由基作用于脂质发生过氧化反应的终产物,它能造成细胞的生物膜和功能的损害,薏仁米在储藏过程中随时间的延长其含量会增加,因此MDA含量是衡量薏仁米品质的重要指标。POD可避免或减轻自由基对植物体内生物大分子如蛋白质(酶)等的降解及对生物膜的破坏,是一种自由基清除剂[22-23]。
如图4所示,MDA含量在前60天内迅速降低,总体呈先降低后升高再降低的趋势,POD活性变化则与此相反,表明MDA含量变化与POD活性呈负相关关系。研究表明,MDA与蛋白质有较强的交联能力[24],可导致蛋白质变性,随着脂质过氧化程度加深及MDA含量的增加,会使蛋白质(酶)变性加剧,使酶活力下降[25],这可能是MDA含量和POD活性变化呈负相关的原因之一。
2.5薏仁米储藏过程中挥发性物质含量与理化、生化指标的相关性分析
选取表3中具有代表性的挥发性物质:乙醇、氨基甲酸甲酯、戊醛、己醛、肟、乙酸、戊基呋喃及卡西酮与水分含量、脂肪酸值、过氧化值、MDA含量及POD活性进行相关性分析,结果见表4。由表4可知,脂肪酸值与己醛相对含量呈极显著正相关(P<0.01),与乙醇、戊醛及戊基呋喃的相对含量显著相关(P<0.05);过氧化值与卡西酮相对含量呈极显著正相关(P<0.01),与己醛相对含量呈显著正相关(P<0.05);MDA含量与己醛呈显著负相关(P<0.05);POD活性和戊醛相对含量呈显著负相关(P<0.05)。从各类挥发物总量与理化、生化指标的相关性来看,醇类与脂肪酸值呈显著负相关(P<0.05),醛类与脂肪酸值呈极显著正相关(P<0.01),与MDA含量呈显著负相关(P<0.05),胺类与MDA含量呈显著正相关(P<0.05)。
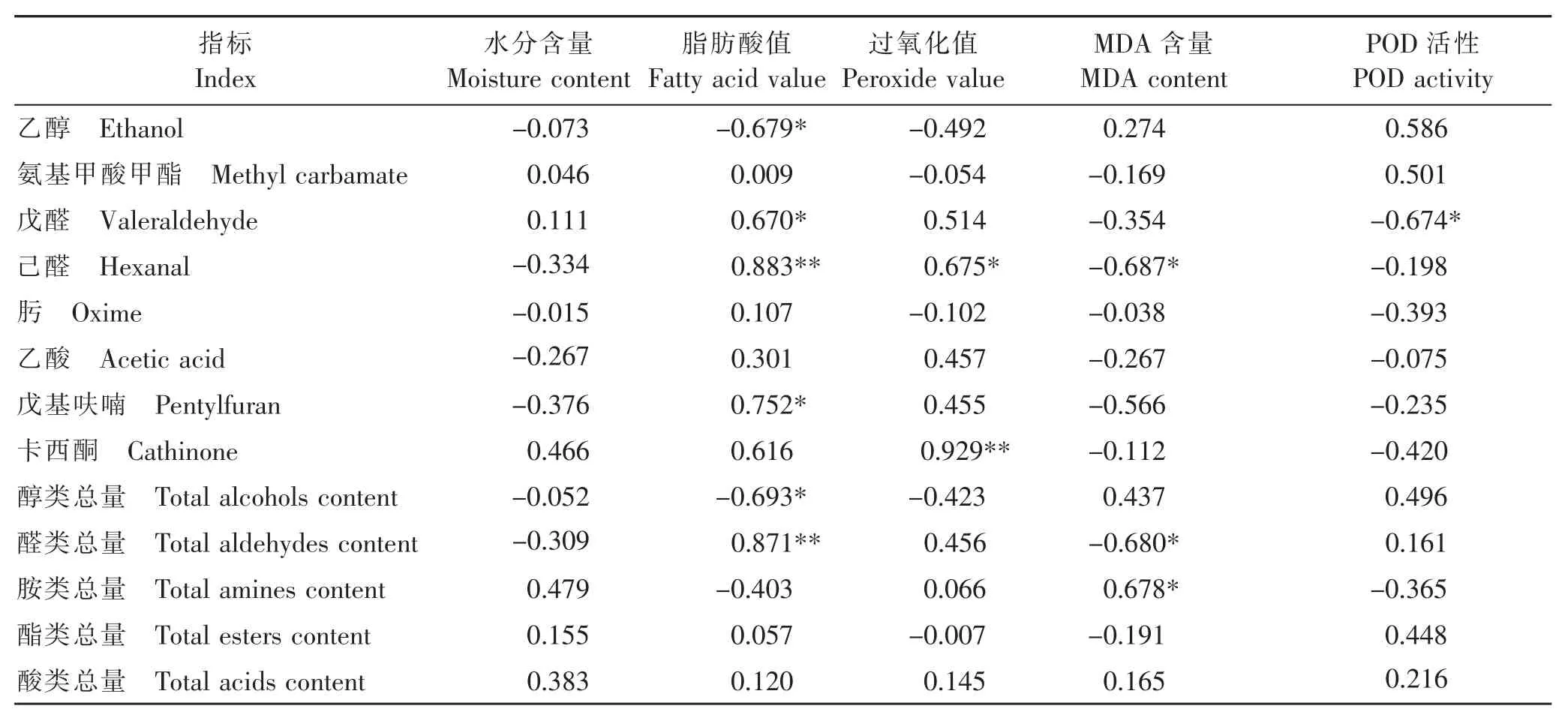
表4 挥发性物质含量与理化、生化指标的相关性分析Table 4 Correlation analysis between volatilematter contentand physiological and biochemical indexes
由此可进一步说明,在180 d的薏仁米储藏过程中,其品质变化主要与醇类、酯类物质的氧化、分解,醛类、酸类物质的形成相关,也与脂类氧化降解密切相关。薏仁米原有的香气随着醇类、酯类含量的降低,经过复杂化学反应,降解为醛类、酸类等挥发性成分,形成哈败味;且通过感官与理化指标可知,脂肪酸值、过氧化值与色泽、形态和气味变化有良好对应性,因此,脂肪酸值与过氧化值可作为判断薏仁米挥发性物质及品质变化的主要指标。
3 结论与讨论
薏仁米储藏品质的理化指标变化主要表现为脂肪酸值及过氧化值的升高,脂肪酸值、过氧化值与色泽、形态和气味变化有良好的对应性。随着储藏时间的延长,薏仁米色泽、形态及气味变化逐渐加重,气味变化先于色泽、形态变化;脂肪酸值和过氧化值逐渐升高,而对应的薏仁米的长虫、劣变及哈败味也越严重;菌落总数在储藏后期显著增高;饱和脂肪酸总量呈上升趋势,不饱和脂肪酸总量呈下降趋势。结合感官、理化及相关性分析得出,脂肪酸值和过氧化值与薏仁米的品质变化有良好对应性,可作为判断薏仁米陈化的主要指标。
据研究报道,大多数挥发性物质的产生主要源于脂类水解氧化、蛋白质和氨基酸降解以及糖类代谢[25]。其中,醇类及醛类主要源于脂肪酸的氧化分解。本研究结果表明,随着储藏时间的延长,醛类相对含量呈上升趋势,由12.19%上升至50.50%,且醛类阈值一般较低,因此醛类含量的升高很可能是薏仁米储藏过程中不良风味出现的主要原因之一。戊基呋喃是由不饱和脂肪酸亚油酸氧化降解所得,具有豆腥气息且阈值较低[26],因此可作为薏仁米脂质氧化特征物之一,且可能对薏仁米风味的改变起重要作用。卡西酮与过氧化值呈极显著正相关(P<0.01),说明卡西酮很有可能与脂类氧化降解相关。乙醇主要源于糖类代谢,乙醇在原始样品及储藏前两个月的相对含量较高,说明糖类代谢在薏仁米储藏前期较旺盛,之后薏仁米的挥发性物质则主要源于脂类氧化降解。此外主要由含硫氨基酸(蛋氨酸、半胱氨酸和胱氨酸)降解产生的硫醚类化合物未有检出,说明蛋白质、氨基酸类的降解挥发物较少[25]。乙醇、己醛、戊醛、戊基呋喃、卡西酮的相对含量与理化、生化指标有显著相关性,在一定程度上可反映薏仁米的品质变化。薏仁米储藏过程中的陈化主要与醇类、酯类物质的氧化、分解,醛类、酸类物质的形成相关,也与脂类氧化降解密切相关。
[1]薄春燕.薏苡仁营养成分分析及脱脂薏苡仁的综合利用[D].南昌:南昌大学,2011:1.
[2]CHEN H J,CHUNG CP,CHIANGW C,etal.Anti-inflammatory effects and chemical study of a flavonoid-enriched fraction from adlay bran[J].Food Chemistry,2011,126(4):1741 -1748.
[3]高建华,宁正祥,罗尧晶.苡仁营养成分的研究[J].食品研究与开发,2006,27(7):174-176.
[4]WOO JH,LID,WILSBACH K,et al.Coix seed extract,a commonly used treatment for cancer in China,inhibits NF-kappaB and protein kinase C signaling[J].Cancer Biology Therapy,2007,6(12):2005-2011.
[5]吕峰,林勇毅,陈代园.薏苡仁活性多糖对小鼠的免疫调节作用[J].中国食品学报,2013,13(6):20-25.
[6]PARK R,SUZUKIH,LEEY S,etal.Effectofcoix on plasma,liver,and fecal lipid components in the rat fed on lard-or soybeanoil-cholesteroldiet[J].BiochemicalMedicineandMetabolic Biology,1988,39(1):11-17.
[7]许健,沈雯,孙金权,等.薏苡仁油对人原位胰腺癌Bx-PC-3细胞生长及VEGF和bFGF表达的影响[J].中草药,2012,43(4):724-728.
[8]陈琴芳,刘建华,李永福,等.明日叶/薏仁米营养保健面条的研制[J].食品工业科技,2015,36(1):230-234.
[9]吴伯候.一种薏苡仁保健粉:CN101120773A[P].2008-02-13.
[10]刘城静.薏苡山药保健饮料的研制[J].饮料工业,2011,14(9):14-16.
[11]国家粮食局.粮油检验粮食、油料的色泽、气味、口味鉴定:GB/T 5492—2008[S].北京:中国标准出版社,2008.
[12]中华人民共和国商化业部.粮食、油料检验水分测定法:GB 5497—85[S].北京:中国标准出版社,1985.
[13]国家粮食局.粮油检验粮食、油料脂肪酸值测定:GB/T 5510—2011[S].北京:中国标准出版社,2011.
[14]中华人民共和国卫生部.食用植物精油卫生标准的分析方法:GB/T 5009.37—2003[S].北京:中国标准出版社,2003.
[15]张栋霞,张涛.GC/MSD分析薏仁油组份[J].粮食与油脂,2001(1):42-43.
[16]郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004:115-116.
[17]陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2002:124-126.
[18]中国科学院上海植物生理研究所,上海市植物生理学会.现代植物生理学实验指南[M].北京:科学出版社,1999:305-306.
[19]食品安全国家标准食品微生物学检验菌落总数的测定:GB 4789.2—2010[S].北京:中国标准出版社,2010.
[20]刘冬敏,王建辉,刘永乐,等.草鱼肌肉脂肪酸组成及其在冷藏中的含量变化[J].食品科学,2013,34(2):194-198.
[21]MOTTRAM DS.Flavour formation inmeatandmeatproducts:a review[J].Food Chemistry,1998,62(4):415-424.
[22]蒋选利,李振岐,康振生.过氧化物酶与植物抗病性研究进展[J].西北农林科技大学学报(自然科学版),2001,29(6):124-129.
[23]许东河,李东艳,陈于和.盐胁迫对大豆膜透性、丙二醛含量及过氧化物酶活性的影响[J].华北农学报,1993,8(S1):78-82.
[24]WANG Y,MENY Y L,LSHIKAWA H,et al.Photosynthetic adaptation to saltstress in three-color leaves ofa C4 plant A-maranthustricolor[J].PlantCellPhysiology,1999,40(7):668-674.
[25]周显青,张玉荣,张勇.储藏玉米陈化机理及挥发物与品质变化的关系[J].农业工程学报,2008,24(7):242-246.
[26]DAMERAU A,KAMLANG-EK P,MOISIO T,etal.Effectof SPME extraction conditions and humidity on the release of volatile lipid oxidation products from spray-dried emulsions[J]. Food Chemistry,2014,157:1-9.
Study on Aging M echanism of Coix Seed during Preservation
YANG Feng-yi1,LU Hong-mei1,*,CHEN Li1,DAILai-xin1,CHANG Dong-mei2,BAICheng-song2,JIA Qing-hui3
(1.Schoolof Liquorand Food Engineering,Guizhou University,Guiyang 550025,China;2.Guizhou Key Laboratory of Fermentation Engineeringand Biopharmacy,Guizhou University,Guiyang 550025,China;3.College ofChemistry and Chemical Engineering,Guizhou University,Guiyang 550025,China)
The changes of sensory quality,physical and chemical indexes,microorganism,the total bacterial count,the compositions and relative contents of fatty acid,the components and relative contents of volatilematter,and biochemical indexes of Xingren coix seed,which was packing with the 0.08 mm PE valve bag and stored at 4~24℃,74%~86%relative humidity were analyzed.The results indicated that,the color of coix seed became dimmed and yellow with the lengthening of preservation time,the rancidity was smelled after 60 days and the changes ofmorphology was observed after 120 days.The longer period during preservation,themore serious the phenomenon of the growth ofworm,deterioration and rancidity.During preservation,themoisture content remained about the same,fatty acid value,peroxide value and the total bacterial count showed growth trendswith themore serious of the growth of worm,deteroration and rancidity,content of saturated fatty acid showed a growth trend,content of unsaturatedfatty acid showed a decreasing trend,and themalondialdehyde content had inverse relation with peroxidase activity. The research analyzed the changes of sensory quality and physicochemical properties of coix seed during preservation,and combined with the volatile components,and their correlation with physiological and biochemical indexes,based on which the resultswere concluded that the aging in the process of coix seed preservation was found related to oxidation and decomposed of alcohols and esters and formation of aldehydes and acids,and they were also closely related to the oxidative degradation of lipids.Fatty acid value and peroxide value could be used as assessment indexes for the aging of coix seed.
coix seed;agingmachanism;changes of quality;preservation
S519;TS210.1
A
10.3969/j.issn.1009-6221.2016.04.009
贵州省科技计划(重大专项)黔科合重大专项字[2014]6023子课题2-1项目;贵州省科技厅、贵州大学联合资金计划项目(黔科合LH字[2014]7674)
杨凤仪(1992—),女,汉族,硕士在读,研究方向:食品科学。
卢红梅,博士,教授,主要从事酿酒工程、发酵工程、酶工程、食品生物技术等方面的教学与研究工作。
2016-04-08
