脂多糖对类风湿关节炎外周血单核细胞Toll样受体4、髓样分化因子88蛋白表达的影响
2016-10-28姚茹冰王圆圆蔡辉
姚茹冰,王圆圆,蔡辉
(南京军区南京总医院中西医结合科,江苏 南京 210002)
脂多糖对类风湿关节炎外周血单核细胞Toll样受体4、髓样分化因子88蛋白表达的影响
姚茹冰,王圆圆,蔡辉
(南京军区南京总医院中西医结合科,江苏 南京210002)
目的观察脂多糖(LPS)对类风湿关节炎(RA)患者外周血单核细胞Toll样受体4(TLR4)、髓样分化因子88(MyD88)蛋白表达的影响。方法采用活动期RA患者外周血进行单核细胞的分离培养,并与健康志愿者做对照。分为以下5组观察:健康对照组、健康+LPS组、RA对照组、RA+ LPS组、RA+LPS+TAK-242组,并采用Western blot法检测各组TLR4、 MyD88蛋白的表达。结果健康+LPS组或RA+LPS组TLR4、MyD88蛋白表达与健康对照组或RA对照组比较均明显升高(均P<0.01);RA对照组或RA+LPS组TLR4、MyD88蛋白表达与健康对照组或健康+LPS组比较均明显升高(均P<0.01);RA+LPS+TAK-242组TLR4、MyD88蛋白表达与RA+LPS组比较明显降低(均P<0.01)。结论RA活动期单核细胞可能存在TLR/MyD88信号通路的激活,且对LPS的刺激反应性增强。
关节炎,类风湿;脂多糖类;Toll样受体2;Toll样受体4;髓样分化因子88
Toll样受体(Toll-like receptors,TLRs)是一类重要的模式识别受体,每种受体通过特定识别来源于病毒,细菌和真菌等“病原体相关模式分子”(pathogen associated molecular patterns,PAMPs),察觉微生物感染的存在,激发启动机体免疫反应,是先天性免疫重要的跨膜受体和信号转导受体[1]。其中TLR4是革兰阴性细菌细胞壁成分脂多糖(lipopolysaccharide,LPS)的识别受体,主要表达于髓系单核细胞[2]。类风湿关节炎(Rheumatoid Arthritis,RA)是一种以关节滑膜炎症为主要特征的高度致残性自身免疫性疫病[3],TLR4对RA的发生发展起重要作用,TLR3和TLR4在慢性RA患者关节滑膜成纤维细胞中高表达[4];RA关节腔滑液中巨噬细胞高表达TLR2和TLR4[5];Toll样受体不仅存在于RA滑膜组织,而且在外周血单核细胞中也存在[6]。本文通过LPS刺激RA患者外周血单核细胞,观察对TLR4、MyD88蛋白表达的影响,以期进一步为RA靶向TLR4的治疗提供依据。
1 资料与方法
1.1研究对象选取 2014 年 4 月至 2015 年 1 月南京军区南京总医院就诊的活动期 RA患者5例(DAS28≥2.6),均符合 2010 年美国风湿病学会/欧洲抗风湿联盟(ACR/EULAR)分类标准。其中男1例,女4例,年龄 25~79岁,平均年龄(52.2±19.5)岁。同时选取5例健康志愿者为对照组,其中男 2例,女3 例,年龄29~40岁,平均年龄(34.2±4.8)岁,所有研究对象均需排除血液系统、心脑血管系统及其他自身免疫疾病等。
1.2试剂与仪器人外周血淋巴细胞分离液,天津灝洋生物有限公司;RPMI-1640 培养基,美国HYCLONE 公司;LPS 试剂,Sigma公司产品;SDS-PAGE凝胶配制试剂盒,南京凯基生物科技发展有限公司;GAPDH(FL-335)、TLR4抗体(H-80),美国Santa Cruz公司;MyD88(D80F5) 抗体,美国CST公司;Western 电泳仪,美国伯乐公司产品;高速冷冻离心机,美国科俊仪器公司。
1.3人外周血淋巴细胞分离、培养RA患者及健康志愿者于清晨空腹时抽取8 mL静脉全血,肝素抗凝。利用密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cells, PBMCs)后,将分离的PBMCs调整细胞浓度至5×109·L-1,接种于 24 孔细胞培养板,每孔 1 mL,置于 37 ℃ 5 % CO2培养箱中培养 4 h。细胞培养 4 h 后,弃细胞培养上清,将 37 ℃预热 PBS 轻洗细胞培养板 2 遍,洗脱未贴壁的细胞,获得贴壁的单核细胞。RPMI-1640 完全培养基重悬(含 1×105U·L-1青霉素,100 μg·L-1链霉素,10%胎牛血清)细胞。分为下列5组观察:(1)健康对照组:健康志愿者外周血单核细胞,不给予任何药物干预;(2)健康+LPS组:健康志愿者外周血单核细胞,给予终浓度为 100 μg·L-1LPS 干预;(3)RA对照组:RA活动期患者外周血单核细胞,不给予任何药物干预;(4)RA+ LPS组:RA活动期患者外周血单核细胞,给予终浓度为 100 μg·L-1LPS 干预;(5)RA+LPS+TAK-242组:RA活动期患者外周血单核细胞,给予终浓度为100 μg·L-1LPS及1000 ng·L-1TAK-242干预。置于37 ℃ 5% CO2培养箱中培养24 h后收获细胞。
1.4western blot法检测外周血单核细胞TLR4及MyD88蛋白的表达用等量的蛋白样本(50 μg)进行SDS-PAGE凝胶电泳,进行湿法转膜,在5% 脱脂奶粉封闭液中封闭(4℃,过夜),弃去封闭液。加入封闭液稀释好的TLR4、MyD88抗体及GAPDH抗体(1∶1 000),TBST漂洗滤膜4次,每次10 min。将膜与辣根过氧化酶标记的二抗(1∶5 000),室温下摇荡孵育2 h,然后用TBST充分洗膜,漂洗4次,每次10 min。显影液置膜上,凝胶成像仪成像。GAPDH表达作为内参蛋白,得出TLR4 / GAPDH,MyD88 / GAPDH的比值,用于统计分析。
2 结果
2.1LPS对外周血单核细胞TLR4蛋白表达的影响健康对照组及RA对照组外周血单核细胞给予LPS刺激后, TLR4蛋白表达均明显升高(均P<0.01);RA患者加入LPS刺激的同时加入TAK-242(TLR4抑制剂),TLR4蛋白表达可明显降低(P<0.01);与健康对照组比较,RA对照组TLR4蛋白表达明显升高;与健康+LPS 组比较,RA+LPS 组TLR4蛋白表达也明显升高(P<0.01)。见表1。
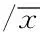
表1 LPS对外周血单核细胞TLR4蛋白表达的影响±s
注:与健康对照组比较,aP<0.01;与RA对照组比较,bP<0.01;与RA+LPS 组比较,cP<0.01;与健康+LPS 组比较,dP<0.01。
2.2LPS对外周血单核细胞Myd88蛋白表达的影响健康对照组及RA对照组外周血单核细胞给予LPS刺激后,Myd88蛋白表达均明显升高(均P<0.01);RA患者加入LPS刺激的同时加入TAK-242(TLR4抑制剂),Myd88蛋白表达可明显降低(P<0.01);与健康对照组比较,RA对照组Myd88蛋白表达明显升高;与健康+LPS 组比较,RA+LPS 组Myd88蛋白表达也明显升高(P<0.01)。见表2。
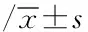
表2 LPS对外周血单核细胞Myd88蛋白表达的影响
注:与健康对照组比较,aP<0.01;与RA对照组比较,bP<0.01;与RA+LPS 组比较,cP<0.01;与健康+LPS 组比较,dP<0.01。
3 讨论
RA是一种以对称性多滑膜关节炎和关节外病变为主要临床表现的慢性自身免疫病,病因及发病机制不明[7]。一般认为其发病可能与溶血性链球菌或其他细菌代谢产物、病毒等的持续感染引起遗传易感个体的自身免疫反应密切相关[8]。TLRs不仅在固有免疫中具有重要作用,也是联系固有免疫与适应性免疫的桥梁,而且从多方面影响适应性免疫应答,在RA发病机制中可能有重要的作用[9]。TLR的生物学效应主要由髓样分化反应蛋白88(myeloid differentiation factor 88,MyD88)依赖型和非MyD88依赖型传导途径介导[10]。MyD88是一种接头分子,除了TLR3, MyD88与其它所有TLR相关。研究提示,TLR尤其是TLR4及其介导的TLR4/ MyD88信号通路在RA的发病中有重要的作用。LPS是脂质和多糖的复合物,为革兰氏阴性细菌外壁层中特有的一种化学成分,是TLR4经典的外源性配体[11]。Kowalski等研究提示相比较健康人和骨关节炎患者,新近诊断的RA患者的外周血单个核细胞对LPS的刺激反应性增高;钱雷等[12]研究提示RA患者外周血单个核细胞的TLR4表达及对脂多糖的刺激的反应性增加,且具有较强的诱导Th 17细胞分化能力,都与本文的结果有相似之处[13]。不同之处主要在于,考虑到RA活动期患者促炎细胞因子分泌相对增多,炎症通路相对明显激活,本文研究对象选择了活动性RA患者的外周血单核细胞,不只局限于新近诊断RA或单纯的确诊的RA的外周血单个核细胞。本文研究结果提示,健康+LPS组、RA+LPS组TLR4、MyD88蛋白表达均比LPS刺激前的健康对照组、RA对照组明显升高;活动期类风湿关节炎患者外周血单核细胞TLR4mRNA、Myd88蛋白表达,无论是在LPS刺激前与健康对照组比较,还是LPS刺激后与健康+LPS组比较均明显增高,且这种反应性可被TLR4抑制剂TAK-242抑制。
本实验显示,活动期RA患者外周血单核细胞TLR4、MyD88蛋白表达增高,对TLR4经典的外源性配体LPS刺激反应性较高,可能存在TLR4/MyD88信号通路的激活,且该通路可被TLR4抑制剂TAK-242抑制[14],为今后研究靶向TLR4/MyD88信号通路治疗RA提供了一定的实验依据,确切机制仍需进一步深入研究证实。
[1]Mohammad HA,Majidi J,Baradaran B,et al.Toll-like receptors in the pathogenesis of autoimmune diseases[J].Adv Pharm Bull,2015,5(Suppl 1):605-614.
[2]He X,Wei Z,Zhou E,et al.Baicalein attenuates inflammatory responses by suppressing TLR4 mediated NF-kappaB and MAPK signaling pathways in LPS-induced mastitis in mice[J].IntImmunopharmacol,2015,28(1):470-476.
[3]张群燕,姚茹冰,蔡辉.青藤碱抑制类风湿关节炎骨破坏的研究进展[J].安徽医药,2016,20(1):1-4.
[4]He X,Wei Z,Zhou E,et al.Baicalein attenuates inflammatory responses by suppressing TLR4 mediated NF-kappaB and MAPK signaling pathways in LPS-induced mastitis in mice[J].IntImmunopharmacol,2015,28(1):470-476.
[5]Liu Y,Yin H,Zhao M,et al.TLR2 and TLR4 in autoimmune diseases:a comprehensive review[J].Clin Rev Allergy Immunol,2014,47(2):136-147.
[6]任敏,武加标,汤丽,等.类风湿关节炎患者外周血单核细胞Toll样受体4的表达及其与血清白介素-18水平变化的相关性[J].中华临床免疫和变态反应杂志,2013,7(1):22-26,后插2.
[7]Bas DB,Su J,Wigerblad G,et al.Pain in rheumatoid arthritis:models and mechanisms[J].Pain Manag,2016,6(3):265-284.
[8]姚茹冰,蔡辉.类风湿关节炎缓解标准的比较与应用[J].医学研究生学报,2015,28(7):759-762.
[9]姚茹冰,王圆圆,蔡辉.Toll样受体与类风湿关节炎相关性研究进展[J].中国免疫学杂志,2015,31(9):1287-1289.
[10] Yoshitaka T,Mukai T,Kittaka M,et al.Enhanced TLR-MYD88 signaling stimulates autoinflammation in SH3BP2 cherubism mice and defines the etiology of cherubism[J].Cell Rep,2014,8(6):1752-1766.
[11] Xu D,Yan S,Wang H,et al.IL-29 enhances LPS/TLR4-mediated inflammation in rheumatoid arthritis[J].Cell PhysiolBiochem,2015,37(1):27-34.
[12] 钱雷,吕丽君,徐敏,等.活化的类风湿关节炎患者外周血单个核细胞Toll样受体4诱导Th17细胞分化[J].中华风湿病学杂志,2011,15(12):816-820.
[13] Hu F,Li Y,Zheng L,et al.Toll-like receptors expressed by synovial fibroblasts perpetuate Th1 and th17 cell responses in rheumatoid arthritis[J].PLoS One,2014,9(6):e100266.
[14] Matsunaga N,Tsuchimori N,Matsumoto T,et al.TAK-242(resatorvid),a small-molecule inhibitor of toll-like receptor(TLR) 4 signaling,binds selectively to TLR4 and interferes with interactions between TLR4 and its adaptor molecules[J].MolPharmacol,2011,79(1):34-41.
Effect of lipopolysaccharide on expression of TLR4 and MyD88proteinin peripheral blood monocytes cells of rheumatoid arthritis
YAO Rubing,WANG Yuanyuan,CAI Hui
(DepartmentofIntegratedTraditionalChineseandWesternMedicine,NanjingGeneralHospitalofNanjingMilitaryCommand,PLA,Nanjing,Jiangsu210002,China)
ObjectiveTo observe the effect of lipopolysaccharide(LPS) on expression of TLR4 and MyD88 protein in peripheral blood monocytes cells of rheumatoid arthritis(RA).MethodsPeripheral blood monocytes cells of active RA patients were isolated and cultured,healthy volunteers as control.Specimen were assignedinto the following five groups:the healthy control group,health + LPS group,RA control group,RA + LPS group,and RA + LPS + TAK-242 group.The expressions of TLR4 and MyD88 protein were detected by Western blot.ResultsThe expressions of TLR4,MyD88 protein in health + LPS group or in RA + LPS groupwere significantly higher than those in healthy control group or in RA control group(allP<0.01).The expressions in RA control group or in RA + LPS group were significantly higher than those in healthy control group or health + LPS group(allP<0.01).The expressions in RA + LPS + TAK-242 group were significantly lower than those in RA + LPS group(allP<0.01).ConclusionMonocytes cells of active RA patients may haveTLR / MyD88 signaling pathway activation and their reactivity to LPS stimulation is increased.
Arthritis,rheumatoid;Lipopolysaccharides;Toll-like receptor 2;Toll-like receptor 4;Myeloid differentiation factor 88
国家自然科学基金青年科学基金项目(81303124)
蔡辉,男,教授,博士生导师,研究方向:中西医结合风湿病,E-mail:njzy_caihui@163.com
10.3969/j.issn.1009-6469.2016.09.016
2016-01-09,
2016-04-18)
