高效液相色谱法测定自制苯海拉明乳膏中羟苯乙酯的含量
2016-10-28湛雯徐进孙芳景霞许静
湛雯,徐进,孙芳,景霞,许静
(南京医科大学附属南京儿童医院药学部,江苏 南京 210008)
高效液相色谱法测定自制苯海拉明乳膏中羟苯乙酯的含量
湛雯,徐进,孙芳,景霞,许静
(南京医科大学附属南京儿童医院药学部,江苏 南京210008)
目的建立测定医院自制制剂苯海拉明乳膏中羟苯乙酯的含量测定方法。方法采用高效液相色谱法(HPLC)。色谱柱:Agilent Eclipse Plus-C18(4.6 mm× 250 mm,5 μm)色谱柱;流动相:甲醇-0.03 mol·L-1磷酸二氢钾溶液(含0.1%三乙胺,用50%磷酸调pH 3.0±0.03)=60∶40;检测波长:258 nm;柱温:25℃;流速:0.9 mL·min-1;进样体积:20 μL。结果羟苯乙酯测定质量浓度在0.02~0.10 g·L-1范围内与其相应峰面积积分值呈良好线性关系(r=0.999 5);精密度、稳定性、重复性试验相对标准偏差(RSD)分别为1.6%、1.9%、2.0 %;平均绝对回收率为92.7 %,RSD为4.3%(n=9);平均相对回收率为102.5 %,RSD为3.6 %(n=9)。结论该方法专属性、重复性、准确性较好,可用于苯海拉明乳膏中羟苯乙酯的含量测定。
防腐剂,药物;色谱法,高压液相;苯海拉明;药物调剂;羟苯乙酯/分析
抑菌剂是能有效防止或抑制微生物的生长的化学物质。药物制剂中抑菌剂用量不足,达不到有效抑菌浓度;用量过大,具有一定毒性,易引起不良反应[1]。人用药物注册技术要求国际协调会议(ICH)明确提出应制订抑菌剂含量测定方法。但目前在我国,较少药品对抑菌剂进行了质量控制或含量测定研究[2-4]。中国药典制剂通则中规定了制剂须进行微生物限度的检测,虽然它能确定药品中抑菌剂的最低有效杀菌或抑菌浓度是否合理,但不能保证制剂中所含抑菌剂的上限是否合理,故它不能替代抑菌剂的含量测定。因此,从临床用药的安全性来说,制剂质量标准中制订抑菌剂含量测定具有重要意义[5]。
羟苯乙酯为一种优良的抑菌剂,化学性质较稳定,被广泛用于软膏及乳膏制剂的防腐。我院自制制剂苯海拉明乳膏中加入0.1%的羟苯乙酯作为抑菌剂。目前有部分文献对苯海拉明乳膏中的盐酸苯海拉明含量测定有一定研究[6-8],但尚无对此乳膏中的羟苯乙酯含量进行检测分析。为了对苯海拉明乳膏进行有效的质量控制,保证药品质量,本试验通过高效液相色谱法对自制乳膏中的羟苯乙酯进行含量测定,保障医院自制制剂的质量与安全。
1 仪器与材料
Agilent 1260 Infinity 高效液相色谱仪(G1312B二元泵,G1316A柱温箱,G4212B 二极管阵列检测器),十万分之一分析天平(瑞士Mettler Toledo,MS205DU)。
羟苯乙酯对照品购于中国食品药品检定研究院(批号:100847-201203),苯海拉明乳膏为我院自制(批号:141230,150225,150227,150317,150601,150602,150721,150722),甲醇为色谱纯,水为超纯水,其余试剂为分析纯。
2 方法与结果
2.1色谱条件Agilent Eclipse Plus-C18色谱柱(4.6 mm×250 mm,5 μm);流动相:甲醇-0.03 mol·L-1磷酸二氢钾溶液(含0.1%三乙胺,用50%磷酸调pH 3.0±0.03)=60∶40;检测波长:258 nm;柱温:室温(25℃);流速:0.9 mL·min-1;进样体积:20 μL。
2.2溶液制备
2.2.1对照品储备液
取干燥至恒重的羟苯乙酯对照品200 mg,精密称定,至10 mL量瓶中,加乙醇溶解并稀释至刻度,摇匀,即得。
2.2.2供试品溶液制备
取苯海拉明乳膏5 g,精密称定。加0.01 mol·L-1盐酸溶液适量,80 ℃水浴加热至油相完全融化析出,冷藏,待油层凝固,过滤;重复上述操作两次,至上层油相无胭脂红红色。将三次滤液并入100 mL量瓶中,以0.01 mol·L-1盐酸溶液定容至刻度,摇匀,10 000 r·min-1离心10 min,取上清液得供试品溶液。
2.2.3对照品溶液
精密移取2.2.1项羟苯乙酯储备液0.25 mL于100 mL容量瓶中,搅拌均匀,按2.2.2项下方法进行处理,即得对照品溶液。
2.2.4阴性对照品溶液
按苯海拉明乳膏处方工艺制备不含羟苯乙酯的空白制剂,按2.2.2项下方法进行处理,即得阴性对照品溶液。
2.2.5质控品溶液的制备
按苯海拉明乳膏处方工艺制备含羟苯乙酯处方量80%、100%及120%的制剂,按2.2.2项下方法进行处理,即得质控品溶液。
2.3专属性试验按2.1项下色谱条件分别对对照品溶液,供试品溶液,阴性对照品溶液进行色谱分析,记录色谱图(见图1)。结果表明,供试品溶液中羟苯乙酯色谱峰与对照品溶液中羟苯乙酯色谱峰保留时间一致,且与相邻色谱峰分离度良好;阴性对照品溶液在羟苯乙酯色谱峰位置无吸收峰,该测定方法专属性良好。
2.4线性关系考察精密吸取2.2.1项下对照品储备溶液适量,配制成浓度分别为0.02、0.04、0.05、0.06、0.08、0.10 g·L-1的羟苯乙酯溶液。分别按2.1项下色谱条件进行分析,记录色谱峰面积。以各色谱峰面积积分值(Y)对样品中羟苯乙酯浓度(X,g·L-1)进行线性回归,得回归方程:Y=142 169X-353.46,r=0.999 5。
称取5 g按苯海拉明乳膏处方工艺制备的不含羟苯乙酯的空白制剂,精密移取2.2.1项下对照品储备溶液0.1、0.2、0.25、0.3、0.4、0.5 mL,分别置于上述空白制剂中,搅拌均匀。按2.2.2项下方法进行处理。分别按2.1项下色谱条件进行分析,记录色谱峰面积。以各色谱峰面积积分值(Y)对样品中羟苯乙酯浓度(X, g·L-1)进行线性回归,得回归方程:Y=131 796X-590.8,r=0.9964。
结果表明,羟苯乙酯测试浓度在0.02~0.10 g·L-1范围内与其峰面积积分值呈良好线性关系。在苯海拉明乳膏基质中,羟苯乙酯测试浓度与其峰面积积分值亦呈较好线性关系。
2.5精密度试验取2.2.3项下对照品溶液,按2.1项下色谱条件,连续进样6次,羟苯乙酯色谱峰面积的RSD为1.6%,表明仪器精密度良好。
2.6稳定性试验取苯海拉明乳膏5 g(批号:150721),按2.2.2项下方法制备供试品溶液。分别于放置0,2,4,8,12,24 h时,按2.1项下色谱条件进行测定。记录羟苯乙酯色谱峰面积并计算RSD,结果为1.9%,表明供试品溶液在24 h内稳定。
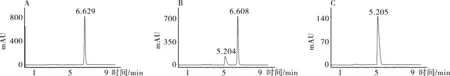
对照品溶液 供试品溶液 阴性对照品溶液
2.7重复性试验取苯海拉明乳膏一盒(批号:150721)。按2.2.2项下方法制备5份供试品溶液。按2.1项下色谱条件测定5份供试品溶液中羟苯乙酯的峰面积。结果羟苯乙酯的峰面积的RSD为2.0%,表明该方法的重复性良好。
2.8回收率试验
2.8.1绝对回收率试验
称取5 g按苯海拉明乳膏处方工艺制备的不含羟苯乙酯的空白制剂。分别加入适量盐酸苯海拉明对照品,按2.2.2下方法分别制备供试品溶液。以2.1下条件测定各样品中羟苯乙酯的含量。结果见表1。计算得样品平均绝对回收率为92.7%,RSD为4.3%。
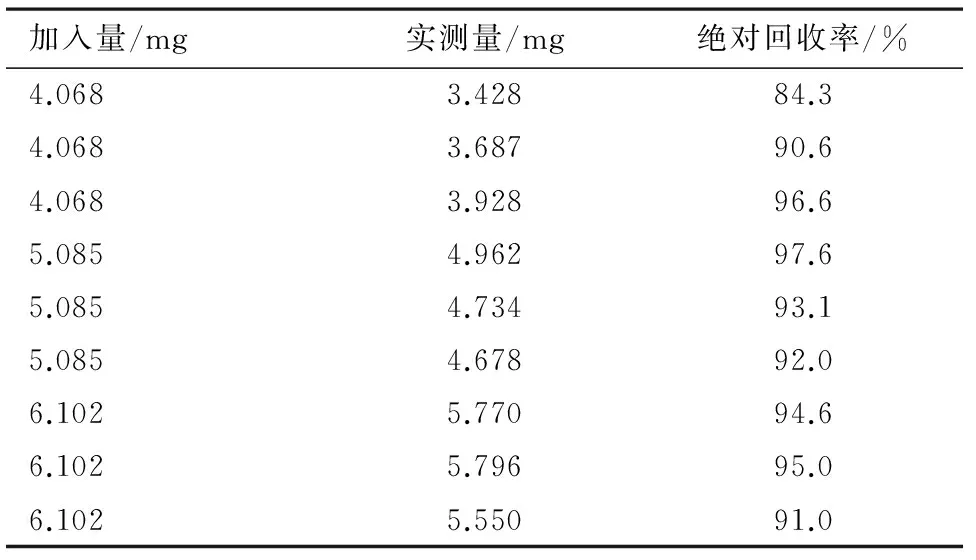
表1 绝对回收率试验结果(n=9)
2.8.2相对回收率试验
以2.8.1项下制备的供试品按2.4项中的含基质标准曲线Y=131 796X-590.8,计算所得的浓度,与配制浓度相比计算相对回收率。结果见表2。计算得样品平均相对回收率为102.5%,RSD为3.6%。
2.9样品含量检测取苯海拉明乳膏(批号:141230、150225、150227、150601、150602、150722),按2.2.2项下方法制备供试品溶液;按照2.2.5项下制备质控品溶液。按2.1项下色谱条件,分别取质控品溶液和供试品溶液进样,按外标法以峰面积计算样品中羟苯乙酯的含量。结果见表3。
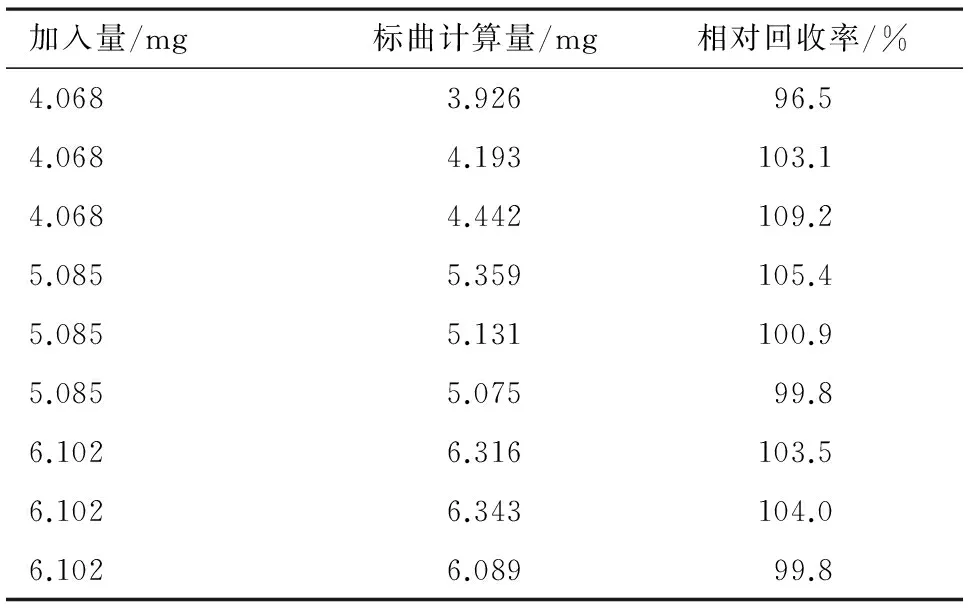
表2 相对回收率试验结果(n=9)
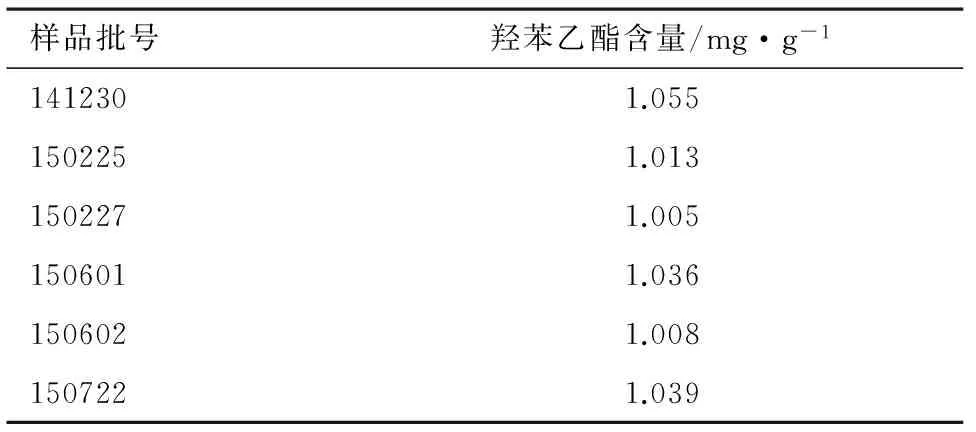
表3 苯海拉明乳膏中羟苯乙酯的含量测定
3 讨论
3.1试验方法因羟苯乙酯水中溶解度低,醇中溶解度高,故先摸索了用甲醇、乙醇提取苯海拉明乳膏中的羟苯乙酯[9],但乳膏中的油性基质亦溶于醇溶液,醇提取液在流动性中有油性基质析出,易堵塞色谱柱并吸附羟苯乙酯影响其定量,试验精密度及回收率均不合格。
摸索使用0.01 mol·L-1盐酸溶液自制苯海拉明乳膏中的羟苯乙酯,苯海拉明乳膏能良好的破乳,得油层和澄清的水溶液,取滤过水溶液进行色谱分析[10]。由于苯海拉明乳膏的基质复杂,羟苯乙酯在水中溶解度不佳,因此使用上述方法提取的苯海拉明乳膏中的羟苯乙酯的平均绝对回收率为92.7%,但平均相对回收率达到102.5%,符合2015版中国药典中药品待测成分定量分析要求。
3.2样品质量控制按2.2.5项下制备质控品溶液。检测样品时同时检测质控品,如果相对回收率落在90%~110%之间,即可认为样品制备过程符合实验要求,仪器检测正常,否则须检查整个操作过程。
3.3试验总结参考相关文献[11-12]和试验研究,本试验中采用甲醇-0.03 mol·L-1磷酸二氢钾溶液作为流动相,建立苯海拉明乳膏中羟苯乙酯HPLC含量测定方法。在本色谱条件下,羟苯乙酯理论塔板数大于8 000,出峰时间在10 min内完成,保留时间适宜。在该色谱条件下,亦能对盐酸苯海拉明进行分离和检测。
该方法线性关系良好,重现性高,可用于医院自制制剂的质量标准控制,为患者用药的安全性提供保障。
[1]李中东,张云轩,郭燕萍,等.羟苯酯类防腐剂的不良反应[J].中国药物警戒,2012,9(5):303-305.
[2]葛晓莹,陈晨,陈国清,等.托吡卡胺滴眼液中主成分及防腐剂的含量测定[J].中国药事,2014,28(8):880-883.
[3]刘存富.HPLC法测定蛋白琥珀酸铁口服溶液中防腐剂的含量[J].安徽医药,2015,19(1):53-55.
[4]张菁,常旸,朱建平,等.HPLC法同时测定盐酸林可霉素滴眼液中有关物质和防腐剂含量[J].中国药房,2013,24(45):4298-4300.
[5]成海平.药品研发中防腐剂的应用及质控[J].中国新药杂志,2005,14(8):954-956.
[6]张满常,刘宗昆.HPLC测定复方苯海拉明霜中盐酸苯海拉明含量[J].海峡药学,2014,26(10):55-57.
[7]白林,范金钊,蔡乐,等.HPLC法测定盐酸苯海拉明乳膏的含量[J].中国药物应用与监测,2014,11(6):348-350.
[8]余晓霞,施玉旋,朱桦,等.苯海拉明软膏中盐酸苯海拉明的含量测定[J].中国实用医药,2014,9(22):3-4.
[9]鲁琳,李晖,高燕红.高效液相色谱法检测化妆品中5种限用防腐剂[J].卫生研究,2014,43(4):627-636.
[10] 郭美华,马妍妍,刘世萍.盐酸苯海拉明乳膏的制备及质量控制[J].中国药师,2010,13(3):392-393.
[11] 孙燕,蒋培培,高旭,等.建立RP-HPLC法测定羟苯甲酯和羟苯乙酯的含量[J].军事医学,2014,38(9):751-752.
[12] 李洁,李婷婷.高效液相色谱法同时测定磺胺嘧啶银乳膏中磺胺嘧啶银及羟苯酯类防腐剂的含量[J].中国药学杂志,2014,49(21):1928-1932.
Determination of ethyl hydroxybenzoate in diphenhydramine cream by HPLC
ZHAN Wen,XU Jin,SUN Fang,et al
(PharmaceuticalDepartment,NanjingChildren’sHospitalAffiliatedtoNanjingMedicalUniversity,Nanjing,Jiangsu210008,China)
ObjectiveTo establish a method of quantitative determination of ethyl hydroxybenzoate in diphenhydramine cream.MethodsThe HPLC method was adopted with the Agilent Eclipse Plus-C18column(4.6 mm×250 mm,5 μm) at room temperature(25 ℃) and methanol-0.03 mol·L-1phosphoric acid solution(pH adjusted to 3.0 ± 0.03)(60∶40) as the mobile phase at the flow rate of 0.9 mL·min-1.The detection wavelength for ethyl hydroxybenzoate was 258 nm,and the injection volume was 20 μL.ResultsThe good linear relationship for ethyl hydroxybenzoate was in the range of 0.02~0.10 g·L-1(r=0.999 5).RSDs of ethyl hydroxybenzoate for precision,stability and reproducibility tests were 1.6 %,1.9% and 2.0 %,respectively.The average absolute recovery of ethyl hydroxybenzoate was 92.7%(RSD=4.3 %,n=9),while the average relative recovery was 102.5 %(RSD=3.6 %,n=9).ConclusionsThis established method was specific,accurate and reproducible for the quantitative determination of ethyl hydroxybenzoate in diphenhydramine cream.
Preservatives,pharmaceutical;Chromatography,high pressure liquid;Diphenhydramine;Drug compounding;Ethyl hydroxybenzoate/analysis
许静,女,副主任药师,硕士生导师,研究方向:临床药学,E-mail:njxujing@163.com
10.3969/j.issn.1009-6469.2016.09.011
2016-04-14,
2016-07-10)
