不同荧光定量PCR技术在乙型肝炎病毒检测中的应用评价
2016-10-28朱明岩叶英
朱明岩,叶英
(安徽医科大学第一附属医院感染病科,安徽 合肥 230022)
不同荧光定量PCR技术在乙型肝炎病毒检测中的应用评价
朱明岩,叶英
(安徽医科大学第一附属医院感染病科,安徽 合肥230022)
目的评价普通荧光定量PCR技术与罗氏内标法荧光定量PCR技术在乙型肝炎病毒(HBV)检测中的意义。方法采集HBV患者的血清190份,分别用两种方法进行检测,通过相关性分析和Kappa检验评价两种试剂检测结果之间的差异性及一致性。结果(1)190份标本中,罗氏Cobas试剂与国产试剂检测结果呈线性相关(R2=0.670 7,P<0.05);(2)分成HBeAg(+)与HBeAg(-)两组比较,两组中Cobas试剂与国产试剂检测均呈线性相关(R2=0.586 4,P<0.05;R2=0.522 6,P<0.05);(3)根据不同HBeAg状态和抗病毒要求的DNA载量对标本进行一致性分析,HBeAg(+)组Kappa值为0.752;HBeAg(-)组Kappa值为0.381。结论对于HBeAg(+)患者,可以应用国产试剂检测患者的HBV-DNA水平,而对于HBeAg(-)患者,建议应用Cobas试剂检测其患者的HBV-DNA水平。
乙型肝炎病毒;多重聚合酶链式反应;荧光抗体技术
乙型肝炎病毒(Hepatitis B virus,HBV)感染是世界性公共卫生问题,全世界约有2.48亿慢性HBV感染者[1-4]。慢性HBV感染病情进展可发展为肝硬化、肝癌,危及患者生命[5]。乙型肝炎病毒基因(Hepatitis B Virus gene,HBV DNA)载量在评价治疗指征、治疗效果及耐药的发生方面具有非常重要的价值。罗氏内标法Cobas检测是国际上公认的标准,然而试剂价格昂贵,在我国难以广泛使用。目前我国已批准实时荧光定量PCR试剂用于HBV DNA检测,但与罗氏Cobas检测在结果上的差异尚不明确。因此,本研究对HBV感染者包括正在使用抗病毒治疗的患者,进行了罗氏Cobas试剂和国产试剂的HBV DNA同步检测,以了解两者的差异和一致性,以便在临床中更加合理地应用国产试剂和罗氏Cobas试剂。
1 材料与方法
1.1标本来源收集2014年3~12月安徽医科大学第一附属医院收治的乙肝病毒感染者的血清标本190份。男138例,女52例,年龄10~72岁。所有患者均符合中国2010版“慢性乙型肝炎防治指南”的慢性HBV感染的诊断标准[6]。标本均系空腹采取,2 h内分离血清并置于-20 ℃低温冰箱保存。
1.2检测方法
1.2.1HBV-DNA检测采用罗氏内标法荧光定量
PCR试剂对190份标本进行检测,其配套仪器为Roche CobasTaqMan 48 PCR仪,检测的线性范围为2 IU·L-1~1.7×108IU·L-1;采用国产荧光定量PCR试剂(上海之江生物科技公司生产)对190份标本进行检测,其配套仪器为Applied Biosystem公司生产的ABI 7500基因扩增仪,其检测下线为5.0×102IU·L-1。操作和结果判定均参照试剂盒说明书进行。试剂均有正式批文,批检合格并在有效期内使用。
1.2.2HBV血清标志物检测
采用酶联免疫吸附法,试剂盒购自上海科华生物工程股份有限公司。操作和结果判定均参照试剂盒说明书进行,所有试剂均有正式批文,批检合格并在有效期内使用。
1.3统计学方法采用SPSS 16.0进行统计学分析。一致性检验采用Kappa检验进行分析,回归方程采用双变量的线性回归,P<0.05为差异有统计学意义。
2 结果
2.1两种检测方法的定量结果
2.1.1罗氏Cobas试剂检测结果
190例标本中处于Cobas试剂检测下限(数值为≤2 IU·L-1)的有10例,大于Cobas检测上限(数值为≥1.7×108IU·L-1)的标本有7份,余下的173份均检测出具体数量,分别在102≤DNA<103,103≤DNA<104,104≤DNA<105,105≤DNA<106,106≤DNA<107,107≤DNA<1.7×108(IU·L-1)范围内的标本数分别为:29,55,37,14,19,19。
2.1.2国产试剂检测结果
190例标本中处于国产试剂检测下限(数值为<5×102IU·L-1)的有72例,余下118份均检测出具体载量,分别在102≤DNA<103,103≤DNA<104,104≤DNA<105,105≤DNA<106,106≤DNA<107,DNA ≥107(IU·L-1)范围内的标本数分别为:8,38,18,17,16,21份。
2.2HBV血清标志物检测结果190例标本中HBsAg(+)、HBeAg(+) 98例,HBsAg(+)、HBeAg(-) 92例。
2.3两种检测方法的相关性分析
2.3.1HBV DNA定量结果相关性
所有结果经对数转换后进行相关性分析(注:总标本为190份,排除低于国产试剂检测下限者72份和高于罗氏Cobas检测上限者7份,可进行相关性分析标本为111份),见图1,表明国产试剂与罗氏试剂检测结果呈线性相关。

图1 罗氏Cobas试剂与国产试剂检测结果的相关性分析(n=111,P< 0.05)
2.3.2不同乙型肝炎E抗原(Hepatitis B e antigen,HBeAg)状态两种试剂检测结果相关性
111例患者样本分为HBeAg(+)组61例和HBeAg(-)组50例,HBV DNA结果分别取对数值后进行相关性分析(图2、3),表明两组均呈线性相关。根据两组R2值水平,HBeAg(+)组两种试剂检测结果相关性较高。
2.3.3不同HBV DNA载量两种试剂检测结果相关性
根据国产试剂检测结果,剔除190例标本中处于检测下限的72例,余下118例按不同载量分为6个区段:500≤DNA<103,103≤DNA<104,104≤DNA<105,105≤DNA<106,106≤DNA<107,DNA ≥107(IU·L-1),其与罗氏Cobas定量结果的相关性r数值分别为:-0.292,0.478,-0.240,0.283,0.311,0.891,P值分别为:0.484,0.002,0.336,0.271,0.242,0.000。可见国产试剂与罗氏Cobas试剂仅在103≤DNA<104和DNA ≥107(IU·L-1) 这两个区段相关性较好,其余的载量区段无相关性。
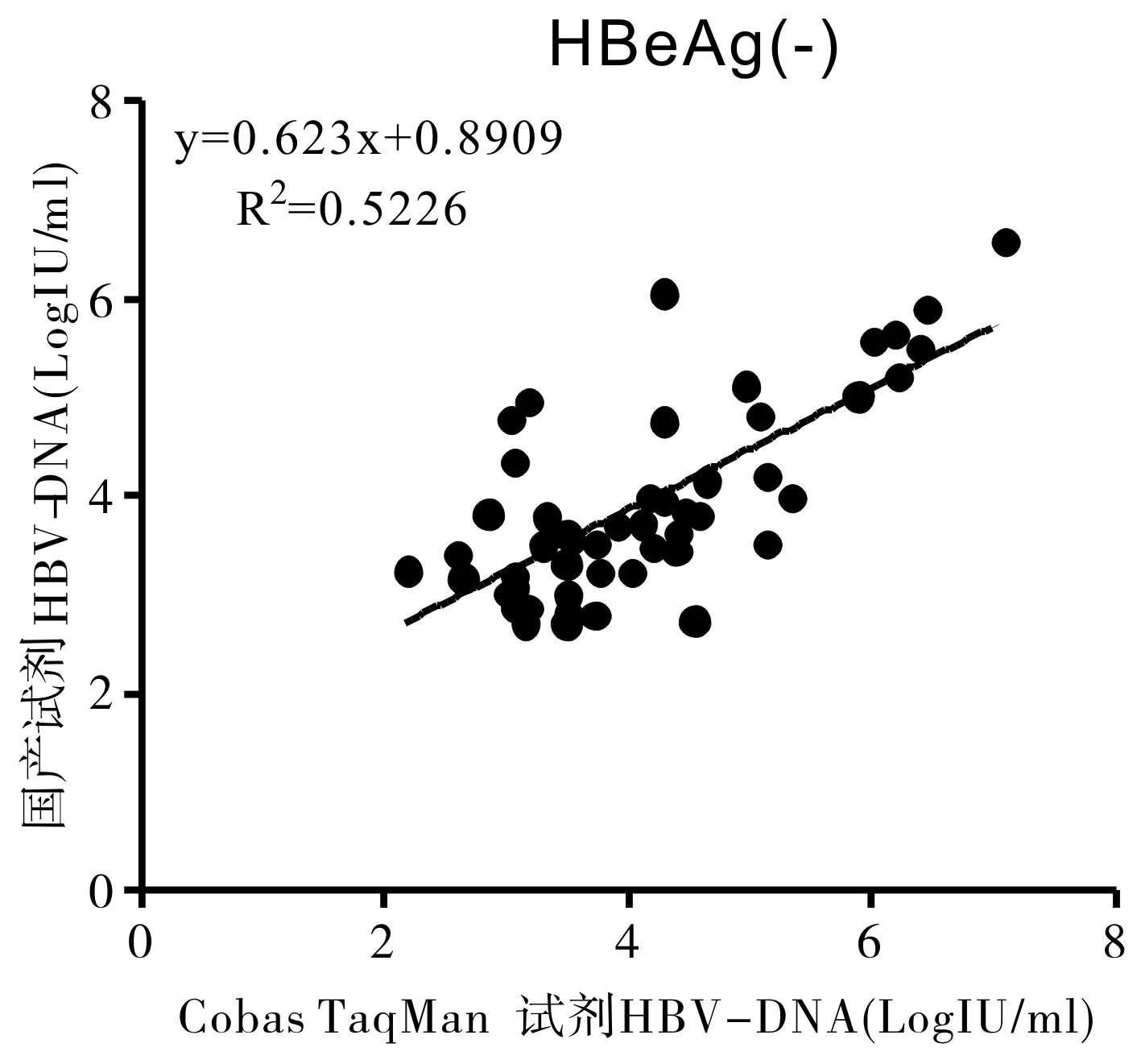
图2 HBeAg(-)组罗氏Cobas试剂与国产试剂检测结果相关性分析(n=50, P<0.05)
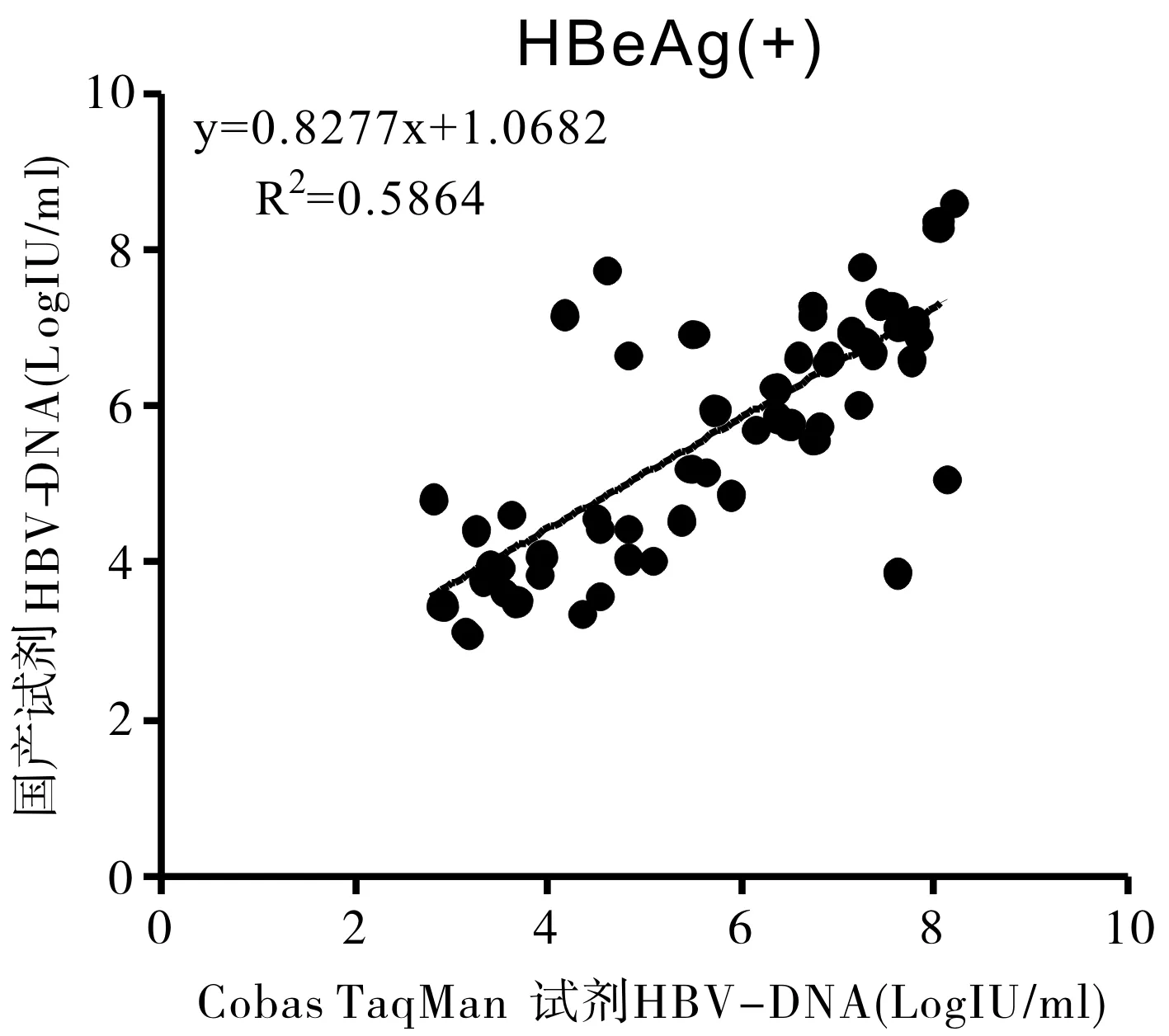
图3 HBeAg(+)组罗氏Cobas试剂与国产试剂检测结果相关性分析(n=61,P<0.05)
2.3.4根据HBeAg状态和HBV DNA载量分层分析
将190份标本根据不同HBeAg状态和抗病毒要求的DNA载量进行分层,当HBeAg(+)且HBV DNA<2×104IU·L-1时,采用国产试剂检测,符合的标本有45例;采用罗氏Cobas试剂检测结果分别为:HBV DNA<2×104IU·L-1的有37例,占82.2%;HBV DNA≥2×104IU·L-1有8例,占17.8%。HBeAg(-)且HBV DNA<2×103IU·L-1时,采用国产试剂检测,符合的标本有57例,采用罗氏Cobas检测结果分别为:HBV DNA<2×103IU·L-1的有24例,占42.1%,HBV DNA≥2×103IU·L-1有33例,占57.9%(图4)。
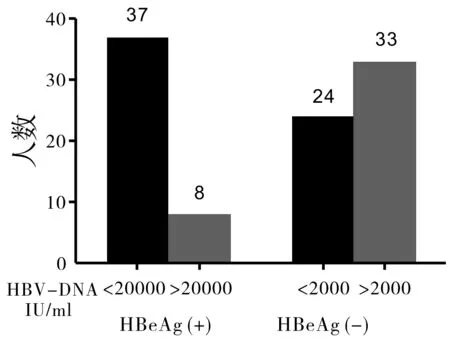
图4 不同HBeAg状态和不同DNA载量罗氏检测结果
2.4根据不同HBeAg状态和抗病毒要求的DNA载量对总标本进行一致性分析HBeAg(+)组98例,根据抗病毒要求将HBV DNA≥2×104IU·L-1,设为检测结果阳性,而HBV-DNA<2×104IU·L-1设为阴性;其Kappa值为0.752,说明国产试剂检测与CobasTaqMan试剂检测一致性较高;HBeAg(-)组92例,将HBV-DNA≥2×103IU·L-1,设为检测结果阳性,而HBV DNA<2×103IU·L-1设为阴性;其Kappa值为0.381,其检测值<0.4,说明国产试剂检测与CobasTaqMan试剂检测一致性较差。如图5。
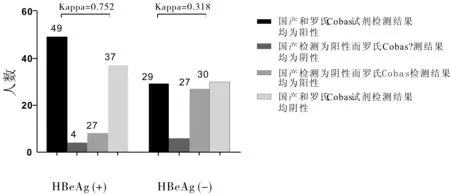
图5 两种检验结果一致性比较
3 讨论
本研究结果显示国产试剂与罗氏Cobas试剂具有较好的相关性,并呈线性相关(R2=0.6707,P<0.05),表明国产试剂检测结果总体上反映血清中HBV DNA水平[1-2];将结果按不同HBV DNA水平进行分组分析,发现国产试剂仅在病毒载量在103≤DNA<104和107≤DNA<1.7×108(IU·L-1) 范围的标本与罗氏检测具有较好的相关性,而载量在104≤ DNA <107IU·L-1范围内的标本相关性相对较差,这与薛艳等[7]报道相似。
根据不同HBeAg状态和抗病毒要求的DNA载量对总标本进行分层分析,HBeAg(+)组:国产试剂和罗氏Cobas试剂检测结果具有良好的相关性和一致性,按国产试剂检测结果显示HBV DNA<2×104IU·L-1的45例患者,应用Cobas试剂检测有8例达到HBV-DNA≥2×104IU·L-1,占17.8%,可见对于HBeAg(+)患者,国产试剂可以基本反应体内病毒载量情况,但若经济条件许可,仍然建议罗氏检测尤其对于已使用核苷类药物治疗超过6月的患者。HBeAg(-)组:国产试剂和罗氏Cobas试剂检测结果虽呈线性相关,但其一致性差,经国产试剂检测的不需抗病毒治疗的57例患者,应用Cobas试剂检测HBV DNA≥2×103IU·L-1有33例,占57.9%,因此对于HBeAg(-)低病毒载量的患者,建议应用Cobas试剂检测。对HBeAg(-)患者若仅根据国产试剂检测结果,不采取抗病毒治疗措施,可能会使病情进展为肝硬化或肝癌,而延误了患者的诊治。与罗氏Cobas试剂相比,国产试剂的灵敏度及检测范围仍有一定差距,分析原因主要包括:(1)PCR引物不够保守,标本存在HBV基因突变时导致扩增不能。(2)国产试剂荧光探针结合区基因序列可以出现突变,引起探针不能够有效地与扩增的靶基因结合,最终无法显示扩增的量[8-9]。罗氏Cobas系统有以下特性[10-12]:(1)在引物设计上覆盖了HBV A-G亚型,而且避开了常见的突变位点,如YMDD突变区、前C区和核心启动子变异区,在欧美有12%~27%的CHB患者HBV DNA基因存在前C区突变,而在亚太地区前C区的突变率高达47%~60%。(2)设立内部标准品的管内质控,与国产试剂采用的外标法定量相比,内标法完全消除由于核酸提取、扩增效率不同而造成的管间差异。
对于慢性HBV携带者,抗病毒治疗是关键,需要把握好抗病毒治疗指征。若延迟抗病毒治疗,可使病情进展。因此对于HBV携带者应定期检测肝功能、B超等,尤其HBV-DNA至关重要。HBeAg(+)慢性HBV感染者,多处于免疫耐受期,此期HBV-DNA水平高,然并无明显肝脏损害,暂无需抗病毒治疗,但需定期监测肝功能、HBV-DNA等变化,把握治疗时机,综合经济因素,可用国产试剂代替罗氏试剂应用于定期检测。对于HBeAg(-)慢性HBV感染者,HBV-DNA常处于不复制或低水平复制状态,但此期患者亦可隐匿进展为肝硬化、肝癌,根据本研究应积极采用罗氏Cobas试剂定期监测DNA;正如徐启恒等报道[13],对于肝硬化患者,其病情程度与血清HBV DNA高水平并没有显著相关性,往往呈现低病毒载量,尤其是HBeAg(-)肝硬化患者。
综合以上,对于HBeAg(-)患者尤其肝硬化患者,建议积极应用罗氏Cobas试剂进行定期检测;对于接受抗病毒治疗的慢乙肝患者,定期监测HBV-DNA特别在关键时间点如第12周、24周、48周时,可评估抗病毒药物疗效及耐药风险,应积极采用罗氏Cobas进行检测或复测,避免假阴性结果而延误病情,从而让患者得到更有效、更有价值的治疗,提高肝炎患者的治疗效果和生活质量。
[1]Sundaram V,Kowdley K.Management of chronic hepatitis Binfection[J].BMJ,2015,doi:10.1136/bmj.h4263.
[2]张海莹,季颖,朱凌,等.两种HBV-DNA检测试剂的比较[J].中华检验医学杂志,2011,34(5):459-464.
[3]Ott JJ,Stevens GA,Groeger J,et al.Global epidemiology of hepatitis B virus infection:new estimates of age-specific HBsAgseroprevalence and endemicity[J].Vaccine,2012,30:2212-2219.
[4]Tangkijvanich P,Sa_NgIlanm P,Mallachai V,etal.A case-control study on sequence variations in the enhancer Ⅱ/core pmmoter/precore and X genes of hepatitis B virus in patients with hepatocelluarcarcinoma[J].HepatolInt,2010,4:577-584.
[5]赵晓春,郭熙清,刘书宏,等.慢性乙型病毒性肝炎患者抗病毒治疗中细胞免疫功能的改变[J].安徽医药,2015,19(1):108-110.
[6]中华医学会肝病学分会、感染病学分会.慢性乙型肝炎防治指南[J].中华临床感染病杂志,2011,4:1-13.
[7]薛艳,王磊,徐皖苏,等.国产荧光定量PCR 与COBAS Amplicor检测HBV-DNA 的结果比较[J].山东大学学报(医学版),2009,47(4):62-64.
[8]王火生,陈心春,李美忠,等.三种乙型肝炎病毒DNA定量聚合酶链反应试剂比较及其假阴性原因分析[J].中华肝脏病杂志,2006,14(7):541-543.
[9]郑有为,梁敏文, 钱靖琳,等.荧光探针结合区序列突变对HBV DNA 检测的影响[J].热带医学杂志,2012,14(7):837-839.
[10] Allice T,Cerutti F,Pittaluga F,et al.COBAS AmpliPrep-COBAS TaqMan hepatitis B virus(HBV) test:a novel automated real-time PGR assay for quantification of HBV DNA in plasma[J].Journal of Clinical Microbiology,2007,45(3):828-834.
[11] Chevaliez S,Bouvier-Alias M,Laperche S,et al.Performance of the Cobas AmpliPrep/CobasTaqMan real-time PGR assay for hepatitis B virus DNA quantification[J].Journal of Clinical Microbiology,2008,46(5):1716-1723.
[12] Pawlotsky JM,DusheikoQ,Hatzakis A,et al.Virologic monitoring of hepatitis B virus therapy in clinical trials and practice:recommendations for a standardized approach[J].Gastroenterology,2008,134(2):405-415.
[13] 徐启恒,揭育胜,林淑珍,等.失代偿期乙肝肝硬化患者血清HBV-DNA水平与临床特征及48周短期转归关系[J].中华实验和临床病毒学杂志,2009,23(4):282-284.
Application evaluationof different PCR technologies in detecting HBV-DNA
ZHU Mingyan,YE Ying
(DepartmentofEpidemiology,TheFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei,Anhui230022,China)
ObjectiveTo evaluate the application of domestic PCR technology and Cobas Ampli Prep/CobasTaqMan 48 PCR technology in detecting HBV-DNA.MethodsWecollected 190 serum samples from patients with chronic HBV infections in The First Affiliated Hospital of Anhui Medical University and the samples were monitored by domestic reagent and CobasTaqMan reagent.The performances of the two reagents were compared and analyzed by correlation analysis and Kappa test.ResultsThe 190 serum samples were tested by two assays and there wassignificant linear correlation betweenthe two methods(R2=0.670 7,P<0.05).The serum samples were assigned into HBeAg-positive and HBeAg-negative groups.The data of two test methods had significantlinear correlation(R2=0.586 4,P<0.05;R2=0.522 6,P<0.05).The conformity analysis showed that the Kappa values were 0.752 in HBeAg-postive group and 0.381 in HBeAg-negative group.ConclusionsThe results of two test methods had poor conformity.CobasTaqMan reagent can be used to monitor HBV-DNA quantities in HBeAg-negative patients while domestic reagent canbe used in HBeAg-positive group.
Hepatitis B virus;Multiplex polymerase chain reaction;Fluorescent antibody technique
国家自然科学基金资助项目(81172737)
10.3969/j.issn.1009-6469.2016.09.031
2016-03-04,
2016-06-28)
