神经退行性疾病状态下血-脑屏障变化机制及中药对血脑屏障的影响研究进展
2016-10-28张伟石海莲吴晓俊杨睿王峥涛刘梅
张伟,石海莲,吴晓俊,杨睿,王峥涛,刘梅
(上海中医药大学,a.中药研究所,b.中药产学研合作中心,上海 201203)
神经退行性疾病状态下血-脑屏障变化机制及中药对血脑屏障的影响研究进展
张伟a,b,石海莲a,吴晓俊a,杨睿a,王峥涛a,刘梅b
(上海中医药大学,a.中药研究所,b.中药产学研合作中心,上海201203)
血-脑屏障(BBB)结构和功能的完整性是维持中枢神经系统动态平衡的关键因素。BBB异常伴随神经退行性疾病的发展过程,不同的神经退行性疾病,其BBB异常的病理机制不同,而药物对BBB异常的改善作用也严重影响药物对神经退行性疾病的疗效。本文主要针对神经退行性疾病状态下BBB异常的分子机制及中药的调控作用及其机制两方面进行综述,为神经退行性疾病靶向血脑屏障药物的研发提供基础理论参考。
血脑屏障/药物作用;阿尔茨海默病;多发性硬化;帕金森障碍;中草药;综述
血-脑屏障(blood-brain barrier,BBB)由内皮细胞、基底膜和星形胶质细胞血管周足组成,控制血浆各种溶质选择性进入脑组织,脑血管内皮细胞紧密连接是维持血脑屏障的完整性和中枢神经系统动态平衡的关键因素。血脑屏障若被破坏,其通透性将随着提高,一些大分子物质自由出入脑内,最终导致大脑功能紊乱。血脑屏障内皮细胞膜上ABC转运蛋白,包括P-糖蛋、多耐药辅助蛋白和乳腺癌耐药蛋白多种转运蛋白,可以转运底物包括糖、氨基酸、多肽、蛋白质、金属离子等[1]多种物质。以上任何功能失调都会导致中枢神经系统活性下降及功能障碍。分析既往研究,中枢神经系统疾病的发生发展常伴随以下几种病因:第一,神经递质释放异常,如帕金森病、癫痫、局脑缺血再灌注[2]等。第二,炎症反应,如多发性硬化症、实验性自身免疫脑脊髓炎[3]等。第三,神经元损伤,相关蛋白转运异常,如阿尔茨海默病[4]等。BBB的功能障碍可能与血脑屏障损伤所致的紧密连接被破坏和通透性增强有关,BBB的损伤是否是导致中枢神经系统疾病的发生目前不能确定,但研究表明中枢神经系统疾病的发生常伴随BBB的损伤和通透性增加并能加剧病理过程的进展[5]。
1 BBB异常与多发性硬化症
1.1多发性硬化症病变特征多发性硬化症(Multiple sclerosis,MS)是一种慢性中枢神经系统退行性疾病。中枢神经系统的脑和脊髓神经元轴突外围都包裹着一层髓鞘,MS发病过程中出现脱髓鞘现象的发生。通常认为MS是由于炎症反应,出现渐行性脱髓激发了周围免疫系统中淋巴细胞的某些亚群(CD4+,CD8+),进入中枢神经系统,接受了抗原呈递细胞如小胶质细胞呈递的抗原,诱导了炎症的发生,进而影响了神经电信号转导,影响了神经正常功能。
1.2多发性硬化症BBB病理改变机制在MS病变早期往往伴随着血脑屏障的开放[6],外周免疫激活先于中枢神经系统的病理免疫激活,在血脑屏障变化早期淋巴细胞CD8+和黏附分子ICAM-1表达升高,而淋巴细胞Mac-1(CD11b)和 CD68仅在BBB通透性增加的条件下增加,其中诱导型一氧化氮合酶iNOS 和淋巴细胞 CD4+在BBB结构破坏中表达最高[7],内皮细胞合成的紧密连接(Tight junction)蛋白分子ZO-1和Claudin-5的表达明显降低,occludin表达降低,而一些浸润细胞和神经胶质纤维酸性蛋白GFAP表达上调[8],可能导致血脑屏障通透性增大,使外周炎症反应细胞向神经中枢迁移,进一步加重神经中枢的炎症反应。Seo JE等[9]在MS动物模型EAE实验中发现6个月大C57BL雌性小鼠体内NADPH氧化酶、基质金属蛋白酶MMP-9、细胞间黏附分子ICAM-1和血管细胞粘附分子(VCAM-1)表达明显上升,血脑屏障通透性增加和疾病破坏程度严重。长期以来,CD4+Th1类细胞被认为是诱发MS的主要免疫细胞亚型,这类亚型细胞能够分泌IFNγ,其分化需要IL12的存在,并且依赖于转录因子T-bet[10]。另一类辅助性T细胞,Th17及其分泌的细胞因子IL17A在诱导多发性硬化症疾病的过程之中也起至关重要的作用[11]。在周边免疫系统中,抗原呈递细胞会把髓鞘蛋白和多肽类抗原呈递给神经抗原反应T细胞,促进了Th1和Th17类细胞的激活扩散,引发Th17(CCR6+)向脉络丛中表达CCL20的血管内皮细胞处迁移。CCL20在CCR6的信号刺激下,使得T细胞通过血脑脊液屏障进入脑室向蛛网膜下腔迁移。在蛛网膜下腔,T细胞再次受到携带神经抗原的抗原呈递细胞的刺激,释放出大量炎症细胞因子,进一步增加了血脑屏障的通透性,再次引发大量炎症细胞渗透浸入中枢神经系统,诱导破坏中枢神经系统[14],加剧疾病的恶化。Th17细胞通过渗透浸入中枢神经系统和神经细胞形成免疫神经细胞突触状泡,通过促进谷氨酸过量分泌诱发兴奋性神经毒性,增加细胞氧化应激水平,引发神经细胞的死亡[12]。
2 BBB异常与阿尔茨海默病
2.1阿尔茨海默症病理特征阿尔茨海默病(Alzheimer disease,AD)是一类以认知功能障碍和记忆损伤为显著特征的原发性中枢神经系统退化性疾病,是老年性痴呆的主要病因。主要呈现的病理特征有神经元丢失、神经纤维缠结、β淀粉样蛋白(Amyloid,Aβ)斑沉积。BBB具有屏障和载体功能,有多种物质的转运体和受体,具有营养物质的输入和毒性物质的清理功能,Gorelick等[13]提出 AD发病后BBB结构发生变化,β淀粉样蛋白无法经过BBB从中枢神经系统清除,在脑血管和脑实质中堆积,这是引发AD神经退行性病变的根本原因。
2.2阿尔茨海默病BBB病理机制AD大脑中血脑屏障微血管生成异常,Di Marco等[14]发现AD的病理过程是由血管发生病理变化所介导的,血管特异生成促进Aβ沉积及神经元死亡。Desai等[15]在AD脑组织病理学研究发现其海马、黑质区域有新生微血管生成,血管密度增大。这些新生血管的区域与AD产生神经纤维缠结区域相符合,说明AD血脑屏障微血管特异性增加与AD病理损伤有关。AD大脑内皮退化,促进了神经血管炎性反应,激活血管周围包括小胶质细胞、星形胶质细胞在内细胞,释放出大量致炎性细胞因子和血管活性物质诱发血管异常收缩。血管内皮炎症反应与AD病理密切相关,产生神经元损伤[16],促进Aβ生成、tau蛋白磷酸化等变化。RAGE在内皮细胞中表达增加可促进循环中Aβ跨过BBB到脑组织内在,RAGE 除具有转运载体功能外,还可以结合Aβ转导细胞内信号,Origlia等[17]研究表明RAGE可以将信号转导至细胞内,再通过p38MAPK信号转导后诱发长时程增效损伤,p38MAPK 蛋白表达量上升,使特异性位点的tau 蛋白磷酸化增加,诱导神经原纤维缠结形成。有研究表明在AD病理早期斑块和神经元纤维缠结产生都有pTau蛋白参与[18]。血管内皮上低密度脂蛋白特异相关蛋白1 表达量减少使Aβ从脑组织内向循环转运降低,使Aβ在脑实质沉积[19],体内实验和体外脑血管细胞都证实Aβ对内皮细胞具有毒性作用[20-21]。由于血管结构被破坏、血管内皮细胞间隙增大、Ⅳ胶原蛋白和层粘连蛋白表达减少,造成基底膜缺陷、BBB通透性增高。营养物质和氧不能有效的转运透过血管导致神经组织内环境恶化诱导造成神经退化,进而加重疾病进程。
3 BBB异常与帕金森综合征
3.1帕金森综合征病理特征帕金森综合征(Parkinson’s disease,PD)是全球第二大神经退行性疾病,发病机制包括兴奋性毒性学说、环境致病学说、自身免疫学说、遗传学说、凋亡学说和线粒体功能障碍学说等。PD的主要病理变化是中脑黑质致密部多巴胺能神经元的进行性变性死亡,残存的神经元多巴胺合成能力降低,导致纹状体多巴胺神经递质浓度不足,基底神经节环路神经递质乙酰胆碱与多巴胺平衡失调,出现静止性震颤、肌强直、运动迟缓和姿势不稳等症状。
3.2帕金森综合征BBB病理改变机制正常情况下血脑屏障会阻碍外周免疫细胞进入中枢,孟珊珊等[22]在百草枯诱导的慢性帕金森病大鼠模型中BBB的通透性显著性增加,TH蛋白和P-gp表达显著降低。PD病程中伴随免疫炎症的发生,血脑屏障上小胶质细胞和星形胶质细胞激活。研究发现免疫球蛋白G(IgG) 存在在PD 病人LB 上,与α-synuclein 结合成免疫复合物。与小胶质细胞表面的Fcγ受体-I(FcγR-I)结合,激活小胶质细胞介导神经炎症产生[23]。伴随这些炎症细胞的激活和浸润,大量的促炎细胞因子如白介素-6、干扰素-γ、肿瘤坏死因子-α、白介素-1β与趋化因子如CCL2等也在PD 病人的黑质、纹状体、脑脊液中检测到[24]。在小鼠MPTP 模型实验中在脑黑质区域检测到外周白蛋白与IgG,说明PD发生时血脑屏障结构功能受到破坏,局部黑质区域损伤BBB可引起胶质细胞激活及DA 神经元死亡。吴晓黎等[25]在脂多(Lipopolysaccharide,LPS)诱导PD大鼠模型中也发现LPS模型组黑质内BBB的通透性和MMP-9的表达显著增加,紧密连接蛋白相关蛋白ZO-1的表达和酪氨酸羟化酶(Tyrosine hydroxylass,TH)阳性细胞数显著降低。
4 中药调控血脑屏障的途径及分子机制
通过现代药理实验和临床研究发现很多中药及其复方治疗神经系统疾病与其有效成分通过血脑屏障有很大关联。中药及复方活性成份主要通过以下三种途径改善调节BBB的通透性:第一,通过改变BBB结构和微环境达到改善保护BBB的效果。第二,通过调节炎症因子和相关蛋白的表达保护BBB。第三,本身促进BBB通透性增加发挥芳香开窍作用的脂溶性和分子量小的成份或与别的药物合用,能够发挥引药上行促进其他药物透过BBB。
4.1通过改变BBB结构和微环境达到改善保护BBB的效果研究发现生物碱类如川芎嗪[26]、吴茱萸碱[27]在大鼠脑缺血再灌注模型中可以通过上调Occludin、Claudin-5的表达,恢复BBB紧密连接的功能,下调NF-κB和MMP-9降低血脑屏障通透性来减轻缺血再灌注后脑水肿。中药复方动物缺血再灌注模型实验中都发现续命汤[28]、脉络宁[29]、清开灵注射液[30]可以使ZO-1和Occludin的表达增加,显著降低大鼠脑梗死体积,明显降低血脑屏障通透性。通窍活血汤[31]能降低血脑屏障通透性,影响脑内单胺类神经递质含量减轻脑缺血再灌注损伤。
4.2通过调节炎症因子和相关蛋白的表达保护BBB顾民华等[32]发现黄酮类化合物芒柄花素可通过降低MMP-9 的表达、脑内MMPs活性并减少诱导型一氧化氮合酶(Inos)、白介素(IL-1β)等炎症因子的mRNA在缺血脑片上的表达,显著改善脑缺血再灌大鼠的神经缺损和降低BBB通透性。Wei等[33]发现大鼠脑缺血再灌注实验中白藜芦醇可以通过下调MMP-2、MMP-9 和ROS,血脑屏障通透性降低脑含水量减少。水通道蛋(Aquaporin,AQP)是血脑屏障膜上结构蛋白对血脑屏障通透性功能维持发挥重要作用。AQP4蛋白表达上升会加重内皮细胞和紧密连接的损伤,增加BBB结构的损伤。实验证明枸杞子提取物[34],茶多酚[35],人参皂苷Rg1[36]对脑缺血再灌注动物模型的保护作用和减轻脑水肿的机制相关联,可能与降低AQP4蛋白的表达和和减少血脑屏障结构的损伤有关。姜黄素可以下调AQP-4和血管内皮因子(VEGF)减轻脑水肿和伊文思蓝(EB)渗出量,减轻神经功能损伤和脑组织形态学改变维持血脑屏障完整性[37]。
4.3促进血脑屏障通透性增加或促进其他药物透过血脑屏障本身可自由透过BBB发挥芳香开窍作用的脂溶性小分子成分或与别的药物合用,能够发挥引药上行促进其他药物透过BBB。 Bin Yu[38]研究指出冰片可以很好的打开血脑屏障并且可以抑制多耐药相关蛋白Mdr1a,Mdr1b和Mrp1的表达,同时显著增加Rh123在海马、皮层、下丘脑、纹状体蓄积。冰片可以通过影响神经递质调节BBB通透性,王刚等[39]研究合成冰片影响BBB促进槲皮素入脑的情况,发现加入神经递质5-羟色胺抑制剂后脑组织中槲皮素含量显著下降。杨洋等[40]研究发现安息香醛、香草醛和β-细辛醚对转运体P-糖蛋白(P-gp)外排功能具有明显的抑制作用,显著降低细胞培养液中Rho-123的浓度,促进Caco-2细胞对Rho-123的摄取。提示安息香醛、香草醛和β-细辛醚促进药物透过血脑屏障和抑制内皮细胞上转运载体P-gp外排功能相关。研究发现冰片可促进对锰卟啉(MnTBAP)透过血脑屏障,增加其在脑脊液中的浓度,而不改变其血药浓度[41]。研究发现冰片和山柰酚合用,脑组织里山柰酚AUC0-inf提高了2.19倍,表明冰片可以降低BBB通透性促进山柰酚吸收[42]。徐露等[43]研究发现冰片和灯盏花素联用后,伊文思蓝渗入脑内的量减少,且紧密连接相关蛋白ZO-1、Claudin-5蛋白及mRNA 表达量增加了,说明血脑屏障通透性降低,血脑屏障得到了保护。可能的机制是冰片入脑后于内皮上运载体底物竞争结合被泵出细胞外,药物与运载体结合减少而在细胞内蓄积,进而提高药物脑组织含量。见表1。
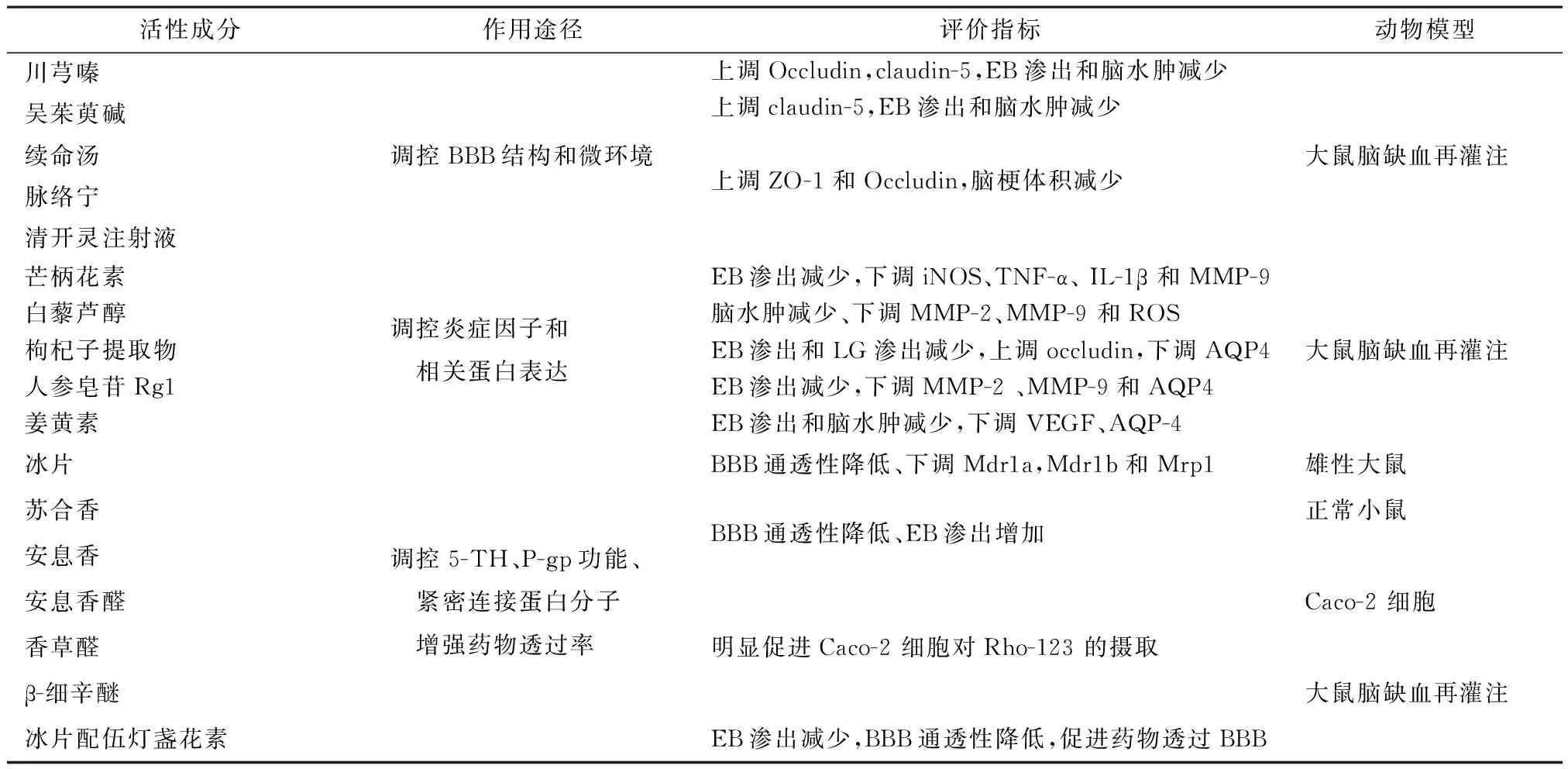
表1 中药活性成分对脑微血管内皮屏障功能的保护作用一览表
5 结语与展望
综上所述,血脑屏障结构功能正常是维持中枢神经组织内环境稳定的保证,当疾病状态下血脑屏障结构功能发生异常时,血脑屏障通透性增加,星形胶质细胞发生炎症反应,释放大量炎症细胞因子促进一系列连锁反应,进一步增加血脑屏障通透性诱导疾病的恶化。神经退行性疾病的治疗存在许多困难,如疾病发病机制不明确、机体自身免疫应答、炎症反应诱导、大分子药物难以透过BBB进入中枢神经系统等诸多方面原因。然而,神经退行性疾病的发生都伴随血脑屏障的损伤并能加重病理过程的进展,中药及复方活性成份可以通过多途径调节改善脑血管内皮屏障功能,改善血脑屏障通透性。中药及复方活性成份是否作用于特定的受体蛋白发挥作用有待进深入研究。因此可以从改善血脑屏结构功能、中药及其复方活性成份及新型靶向给药方面加以研究,为临床治疗神经退行性疾病提供参考、途径和方法,具有深远现实意义和应用前景。
[1]Hartz AM,Bauer B.ABC transporters in the CNS-an inventory[J].Curr Pharm Biotechnol,2011,12(4):656-673.
[2]Maggioli E,McArthur S,Mauro C,et al.Estrogen protects the blood-brain barrier from inflammation-induced disruption and increased lymphocyte trafficking[J].Brain Behav Immun,2016,51:212-222.
[3]Mohajeri M,Sadeghizadeh M,Najafi F,et al.Polymerized nano-curcumin attenuates neurological symptoms in EAE model of multiple sclerosis through down regulation of inflammatory and oxidative processes and enhancing neuroprotection and myelin repair[J].Neuropharmacology,2015,99:156-167.
[4]Gruden MA,Davydova TV,Wang C,et al.The misfolded pro-inflammatory protein S100A9 disrupts memory via neurochemical remodelling instigating an Alzheimer's disease-like cognitive deficit[J].Behav Brain Res,2016,306:106-116.
[5]Blanchette M,Daneman R.Formation and maintenance of the BBB[J].Mech Dev,2015,138(1):8-16.
[6]Huang XN,Fu J,Wang WZ.The effects of fasudil on the permeability of the rat blood-brain barrier and blood-spinal cord barrier following experimental autoimmune encephalomyelitis[J].J Neuroimmunol,2011,239(1/2):61-67.
[7]Alvarez JI,Saint-Laurent O,Godschalk A,et al.Focal disturbances in the blood-brain barrier are associated with formation of neuroinflammatory lesions[J].Neurobiol Dis,2015,74:14-24.
[8]Gao W,Zhao Z,Yu G,et al.VEGI attenuates the inflammatory injury and disruption of blood-brain barrier partly by suppressing the TLR4/NF-kappaB signaling pathway in experimental traumatic brain injury[J].Brain Res,2015,1622:230-239.
[9]Seo JE,Hasan M,Han JS,et al.Experimental autoimmune encephalomyelitis and age-related correlations of NADPH oxidase,MMP-9,and cell adhesion molecules:The increased disease severity and blood-brain barrier permeability in middle-aged mice[J].J Neuroimmunol,2015,287:43-53.
[10] Batoulis H,Recks MS,Addicks K,et al.Experimental autoimmune encephalomyelitis-achievements and prospective advances[J].APMIS,2011,119(12):819-830.
[11] Babaloo Z,Aliparasti MR,Babaiea F,et al.The role of Th17 cells in patients with relapsing-remitting multiple sclerosis:interleukin-17A and interleukin-17F serum levels[J].Immunol Lett,2015,164(2):76-80.
[12] Siffrin V,Radbruch H,Glumm R,et al.In vivo imaging of partially reversible th17 cell-induced neuronal dysfunction in the course of encephalomyelitis[J].Immunity,2010,33(3):424-436.
[13] Gorelick PB,Scuteri A,Black SE,et al.Vascular contributions to cognitive impairment and dementia:a statement for healthcare professionals from the american heart association/american stroke association[J].Stroke,2011,42(9):2672-2713.
[14] Di Marco LY,Venneri A,Farkas E,et al.Vascular dysfunction in the pathogenesis of Alzheimer's disease-A review of endothelium-mediated mechanisms and ensuing vicious circles[J].Neurobiol Dis,2015,82:593-606.
[15] Desai BS,Schneider JA,Li JL,et al.Evidence of angiogenic vessels in Alzheimer’s disease[J].J Neural Transm(Vienna),2009,116(5):587-597.
[16] Grammas P,Martinez J,Sanchez A,et al.A new paradigm for the treatment of Alzheimer's disease:targeting vascular activation[J].J Alzheimers Dis,2014,40(3):619-630.
[17] Origlia N,Righi M,Capsoni S,et al.Receptor for advanced glycation end product-dependent activation of p38 mitogen-activated protein kinase contributes to amyloid-beta-mediated cortical synaptic dysfunction[J].J Neurosci,2008,28(13):3521-3530.
[18] Do TM,Alata W,Dodacki A,et al.Altered cerebral vascular volumes and solute transport at the blood-brain barriers of two transgenic mouse models of Alzheimer’s disease[J].Neuropharmacology,2014,81:311-317.
[19] Agyare EK,Leonard SR,Curran GL,et al.Traffic jam at the blood-brain barrier promotes greater accumulation of Alzheimer's disease amyloid-beta proteins in the cerebral vasculature[J].Mol Pharm,2013,10(5):1557-1565.
[20] Hartz AM,Bauer B,Soldner EL,et al.Amyloid-beta contributes to blood-brain barrier leakage in transgenic human amyloid precursor protein mice and in humans with cerebral amyloid angiopathy[J].Stroke,2012,43(2):514-523.
[21] Kania KD,Wijesuriya HC,Hladky SB,et al.Beta amyloid effects on expression of multidrug efflux transporters in brain endothelial cells[J].Brain Res,2011,1418:1-11.
[22] 孟珊珊,贾非,刘洪文,等.P-gp对百草枯诱导慢性帕金森病大鼠模型血脑屏障和多巴胺能神经元的影响[J].卒中与神经疾病,2013,20(6):331-335.
[23] Zhang J,Niu N,Wang M,et al.Neuron-derived IgG protects dopaminergic neurons from insult by 6-OHDA and activates microglia through the Fc gammaRI and TLR4 pathways[J].Int J Biochem Cell Biol,2013,45(8):1911-1920.
[24] Abdelsayed S,Duong NT,Bureau C,et al.Piperazine derivatives as iron chelators:a potential application in neurobiology[J].Biometals,2015,28(6):1043-1061.
[25] 吴晓黎,王萍,刘云会,等.PARP抑制剂3-AB对脂多糖诱导的帕金森病大鼠血脑屏障及多巴胺能神经元的影响[J].解剖科学进展,2015,21(3):225-228.
[26] 李玉芳,刘坤,倪月秋,等.川芎嗪对大鼠脑缺血再灌注后血脑屏障的保护作用及Claudin-5表达的影响[J].中国医科大学学报,2013,42(6):511-514.
[27] Zhao T,Zhang X,Zhao Y,et al.Pretreatment by evodiamine is neuroprotective in cerebral ischemia:up-regulated pAkt,pGSK3beta,down-regulated NF-kappaB expression,and ameliorated BBB permeability[J].Neurochem Res,2014,39(8):1612-1620.
[28] 周天梅,佟丽妍,徐焕凤.续命汤对局灶性脑缺血中风大鼠紧密连接相关蛋白(Zo-1)和水通道蛋白4(AQP4) mRNA表达的影响[J].中华中医药学刊,2014,32(8):1983-1986.
[29] 庞晓斌,谢欣梅,王保全,等.脉络宁对脑缺血再灌注大鼠血脑屏障通透性的影响研究[J].中成药,2014,36(7):1347-1350.
[30] 高永红,朱海燕,娄利霞,等.清开灵注射液对小鼠脑微血管内皮细胞缺氧模型紧密连接蛋白claudin-5的影响[J].中西医结合心脑血管病杂志,2014,12(11):1363-1365.
[31] 刘亚芳,汪宁.通窍活血汤对脑缺血再灌注小鼠血脑屏障通透性及脑内单胺类神经递质含量的影响[J].安徽医药,2015,19(5):842-845.
[32] 顾民华,洪文,唐传其,等.芒柄花素保护前脑缺血再灌注损伤中的血脑屏障并抑制神经炎症[J].暨南大学学报(自然科学与医版),2015,36(1):34-39.
[33] Wei H,Wang S,Zhen L,et al.Resveratrol attenuates the blood-brain barrier dysfunction by regulation of the MMP-9/TIMP-1 balance after cerebral ischemia reperfusion in rats[J].J Mol Neurosci,2015,55(4):872-879.
[34] Yang D,Li SY,Yeung CM,et al.Lycium barbarum extracts protect the brain from blood-brain barrier disruption and cerebral edema in experimental stroke[J].PLoS One,2012,7(3):e33596.
[35] 朱振丹,茆翔,刘佰运.茶多酚对大鼠创伤性颅脑损伤的脑保护作用[J].安徽医药,2014,18(10):1825-1828.
[36] Zhou Y,Li HQ,Lu L,et al.Ginsenoside Rg1 provides neuroprotection against blood brain barrier disruption and neurological injury in a rat model of cerebral ischemia/reperfusion through downregulation of aquaporin 4 expression[J].Phytomedicine,2014,21(7):998-1003.
[37] 林国芳.姜黄素对大鼠局灶性脑缺血再灌注血管内皮生长因子和水通道蛋白4的影响[J].中国临床药理学与治疗学,2015,20(6):621-624.
[38] Bin Yu,Ming Ruan,Xiaoping Dong,et al.The mechanism of the opening of the blood-brain barrier by borneol:A pharmacodynamics and pharmacokinetics combination study[J].Journal of Ethnopharmacology,2013,150(3):1096-1108.
[39] 王刚,曾南,王建,等.合成冰片影响血脑屏障开放促槲皮素脑吸收的研究[J].中药药理与临床,2012,28(1):65-69.
[40] 杨洋,王世祥,房敏峰,等.安息香醛、香草醛和β-细辛醚对P-糖蛋白功能的影响[J].中成药,2012,34(7):1364-1366.
[41] 刁尧,刘新宁,王瓯越,等.冰片对MnTBAP透过大鼠血脑屏障的影响[J].解剖科学进展,2013,19(5):410-412.
[42] Zhang Q,Wu D,Wu J,et al.Improved blood-brain barrier distribution:effect of borneol on the brain pharmacokinetics of kaempferol in rats by in vivo microdialysis sampling[J].J Ethnopharmacol,2015,162:270-277.
[43] 徐露,张太君.冰片配伍灯盏花素对大鼠脑缺血再灌注损伤血脑屏障通透性的影响[J].中药药理与临床,2015,31(1):74-76.
Research progress of mechanism of blood-brain barrier abnormity induced by neurodegenerative diseases and the effect of traditional Chinese medicine on blood-brain barrier abnormity
ZHANG Weiab,SHI Hailiana,WU Xiaojuna,et al
(a.InstituteofChineseMateriaMedica,b.DepartmenofPhormacy,CooperativeCenterforProduction-Education-TndustryofMateriaMedica,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai201203,China)
The integrity of structures and functions of blood-brain barrier(BBB) is a critical factor to maintain dynamic balance of the central nervous system.The BBB abnormity involves in the pathological process of neurodegenerative diseases,while the pathological mechanism of different neurodegenerative diseases is different,and the effect of drugs on the BBB abnormity would greatly affect its effect on neurodegenerative diseases.This paper focuses on the research progress of mechanism of blood-brain barrier abnormity induced by neurodegenerative diseases and the effect of traditional Chinese medicine on blood-brain barrier abnormity,and then would supply basic theoretical reference for the research and development of drugs for treating neurodegenerative diseases by targeting blood-brain barrier abnormity.
Blood-brain barrier/drug effects;Alzheimer disease;Multiple sclerosis;Parkinsonian disorders;Drugs,chinese herbal;Review
教育部高等学校博士学科点专项科研基金优先发展领域项目(20123107130002);上海高校特聘教授(东方学者)岗位计划资助(2013-59);上海中医药大学预算内项目(2015YSNN29)
张伟,男,硕士研究生
刘梅,女,副研究员,硕士生导师,研究方向:新剂型与新药研发, E-mail:8089111@qq.com
10.3969/j.issn.1009-6469.2016.09.002
2016-04-07,
2016-07-11)
