痤疮合剂对兔耳痤疮模型动物血清中IL-1α、IL-6影响的实验研究
2016-10-28张小卿朴美淑吴景东辽宁中医药大学辽宁沈阳0847辽宁中医药大学附属医院辽宁沈阳00韩国圆光大学韩国首尔
张小卿,顾 炜,朴美淑,吴景东(.辽宁中医药大学 辽宁 沈阳 0847;. 辽宁中医药大学附属医院 辽宁 沈阳 00;.韩国圆光大学 韩国首尔)
痤疮合剂对兔耳痤疮模型动物血清中IL-1α、IL-6影响的实验研究
张小卿1,顾炜2,朴美淑3,吴景东1
(1.辽宁中医药大学 辽宁 沈阳 110847;2. 辽宁中医药大学附属医院 辽宁 沈阳 110032;3.韩国圆光大学 韩国首尔)
目的:本研究以辽宁中医药大学附属医院院内制剂——痤疮合剂为处理因素,采用兔耳痤疮模型,从毛囊角化程度、抗炎效应角度研究痤疮合剂对痤疮兔耳模型的疗效并探讨其作用机理。方法:以煤焦油外涂兔耳制作痤疮模型,每次约0.5ml,连续2周。造模成功后,将动物分为正常对照组,模型对照组,低、中、高剂量组和药物对照组,通过观察局部病理变化并检测血清中IL-1α、IL-6含量观察内服痤疮合剂对痤疮的炎症抑制作用。结果:痤疮合剂确能减少兔耳毛囊角栓和结节,减轻兔耳毛囊口扩张程度,减少炎症细胞浸润;造模后各组IL-1α、IL-6含量均显著升高(P<0.01);与模型对照组比较,痤疮合剂低、中、高剂量组及药物对照组含量均显著下调(P<0.01);高剂量组及药物对照组下调更为显著;其中IL-1α高剂量组下调最为明显,和药物对照组相比差异有统计学意义(P<0.05);IL-6高剂量组和药物对照组差异无统计学意义(P>0.05)。结论:痤疮合剂治疗痤疮作用机制与抑制血液中相关炎症因子有关。
痤疮;痤疮合剂;IL-1α;IL-6
痤疮(Acne)是常见皮肤病之一,属于慢性的炎症性皮肤疾病,它通常累及到毛囊、皮脂腺,好发于皮脂腺分泌旺盛的部位,其可表现为粉刺、丘疹、脓疱、结节、囊肿及瘢痕等特点的多形性皮损。本研究以辽宁中医药大学院内制剂——痤疮合剂为干预因素,以清肺胃湿热,解毒散结为治疗原则,通过观察痤疮合剂低、中、高三个剂量组对兔耳痤疮模型的抑制作用,进行痤疮合剂动物实验研究,并初步探讨其抗炎作用的机制,为临床推广应用提供有力的实验依据。
1 材料和方法
1.1 实验材料
1.1.1实验动物:健康家兔48只,雄性,体重2.5~3kg,由辽宁中医药大学实验动物中心提供。
1.1.2实验药品及制备:痤疮合剂(辽宁中医药大学附属医院院内制剂);清热暗疮胶囊(批号:Z20070425);痤疮合剂的方药组成有:夏枯草、枇杷叶、地黄、牡丹皮、黄连、桑白皮、连翘、金银花、黄芩、牛蒡子、川芎、防风、牡蛎、蝉蜕、北沙参、葛根、香附。
1.1.3主要试剂耗材:煤焦油(批号:81511);IL-1α试剂盒(批号:SEA071Rb);IL-6试剂盒(批号:SEA079Rb)。
1.1.4主要仪器及设备:酶标仪(anthos2010型);电热恒温培养箱(HH·B11·500型);恒温水浴振荡器(SHA-B);脱水机(LEICA 300);石蜡包埋机(EG1150);切片机(LEICA RM2235);生物显微镜(CHA型);离心机(PB300)。
1.2 实验方法
1.2.1实验动物的饲养:家兔于辽宁中医药大学实验动物中心适应性观察饲养1周后开始实验。家兔饲以白菜、胡萝卜,自由饮食、饮水。
1.2.2动物分组:家兔50只,适应性饲养1周后,死亡2只,其余48只随机分成6组,每组8只,即 ①空白对照组;②模型对照组;③痤疮合剂低剂量组;④痤疮合剂中剂量组;⑤痤疮合剂高剂量组;⑥药物对照组(清热暗疮胶囊)。
1.2.3造模:除空白对照组外,其余各组共40只家兔按照美国皮肤病学会1989年制定的兔耳模型规范 Kligman法[1],分别在其双耳内侧面耳管开口处2cm×2cm范围,每日用玻璃棒涂煤焦油1次,每次约0.5ml,连续2周。造模第14天取耳部痤疮病变皮肤活检,用10%的甲醛固定然后进行石蜡蜡块包埋再切片,每个标本需要连续切片4张并以HE染色,然后切片并烘干,其后在显微镜下观察,确定造模成功后,进行后续实验。
1.2.4干预方法:除空白对照组外,其余各组动物在造模成功后灌胃给药,模型对照组每日给予20ml生理盐水。成人临床痤疮合剂常用量为58.48g/d,分2次服用,按兔与人的等效剂量直接折算为2.92g/kg/d,痤疮合剂低剂量组按等效剂量的3倍剂量给药,即8.76g/kg/d;痤疮合剂中剂量组按等效剂量的6倍剂量给药,即17.52g/kg/d;痤疮合剂中剂量组按等效剂量的9倍剂量给药,即26.28g/ kg/d。低、中、高剂量药物按每天用药量不同分别煎煮成20ml水煎液,每日灌胃1次。清热暗疮胶囊临床成人常用量为2.4g/d,分2次服用。经等效剂量换算后,兔用药量为0.12g/kg/d,溶于20ml生理盐水后,每日灌胃1次,各组均连续治疗14d。
1.2.5耳部组织取材:末次给药20h后,以10%水合氯醛,按3ml/kg体重,进行耳缘静脉麻醉,麻醉后迅速取耳部痤疮处组织,去除血液,滤纸拭干,经4%多聚甲醛溶液固定后进行病理检测。
1.2.6血清的采集:麻醉后,耳缘静脉取血,分装于离心管中,静置30min,1 000r/min,离心5min,取上清,分装于离心管中,采用酶联免疫吸附(ELISA)法检测各组细胞培养上清液中IL-1α、IL-6的含量。
1.3 观测指标及检测方法
1.3.1肉眼观察兔耳痤疮变化:HE染色后光镜下观察模型病理变化。
1.3.2ELISA法检测血清中IL-1α、IL-6含量:将用于家兔血清IL-1α、IL-6含量检测的ELISA试剂盒从4℃冰箱中取出,室温静置30min,然后按照说明书步骤进行操作。
1.4统计学分析:本实验数据采用SPSS(19.0)软件,运用多个样本均数比较的方差分析检验,数据以x-±s表示,并用最小显著差法(LSD法)作两两比较。P<0.05表示具有统计学意义。
2 实验结果
2.1兔耳痤疮模型肉眼观察结果:正常对照组肉眼观察兔耳薄、柔软,其上毛细血管清晰可见,兔耳管开口处毛囊口排列整齐,不见角栓;模型对照组造模后14d兔耳部仍发红,表皮明显增厚,可见明显黑色毛囊角栓,毛囊口呈突起,结节增多增大;痤疮合剂低剂量组兔耳表皮增厚有所减轻,毛囊角栓和结节明显减少,但仍有较多未治愈粉刺存在;痤疮合剂中剂量组兔耳表皮厚度已达正常水平,毛囊角栓和结节显著减少;痤疮合剂高剂量组兔耳局部毛囊角栓少见,部分角栓脱落后遗留点状凹陷的毛囊,丘疹变平减少;药物对照组皮损恢复状态与痤疮合剂高剂量组相近,见图1~6。
2.2组织学观察结果:正常对照组兔耳表皮层较薄,毛囊,真皮、表皮交界清楚,真皮内稀疏单一核细胞浸润;模型对照组角化过度,表皮及毛囊上皮的颗粒层、棘层仍增生明显,毛囊口及漏斗部仍见角化物质堆积,漏斗部扩大如壶状,真皮内仍见较多的炎性细胞浸润。痤疮合剂低剂量组兔耳毛囊口扩张程度减轻,其内角化物疏松,炎症细胞有所减少;痤疮合剂中剂量组兔耳镜下观察炎症细胞明显减少,毛囊口扩张程度减轻;痤疮合剂高剂量组兔耳可见表皮增厚明显减轻,但仍见少部分毛囊口轻度扩张,有少量疏松角化物质充填,未见毛囊漏斗部扩大如壶状,真皮炎症细胞明显减少;药物对照组镜下可见少量炎症细胞,毛囊口轻度扩张。见图7~12。
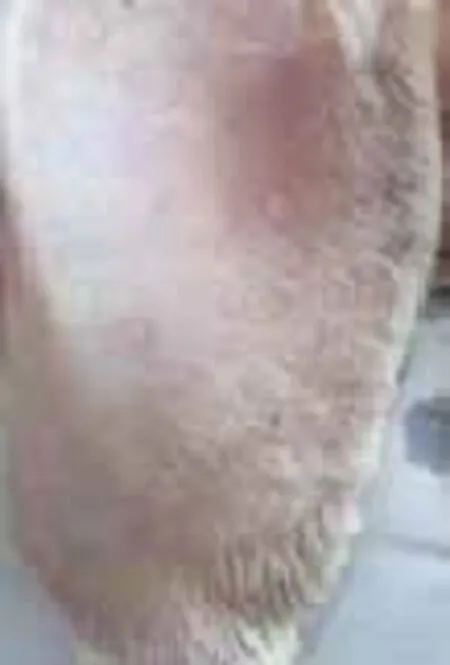
图1 正常对照组兔耳皮肤
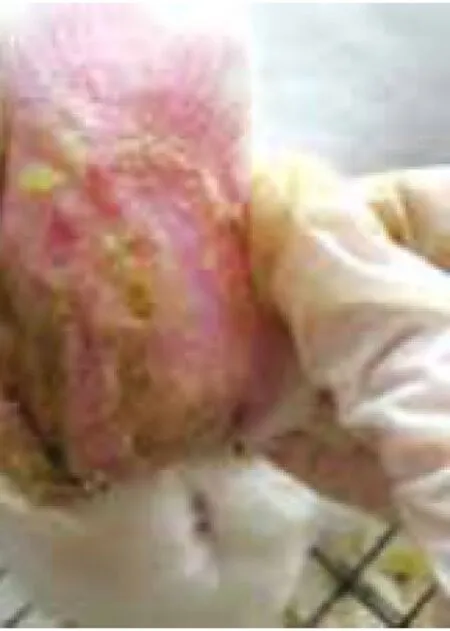
图2 模型对照组兔耳皮肤
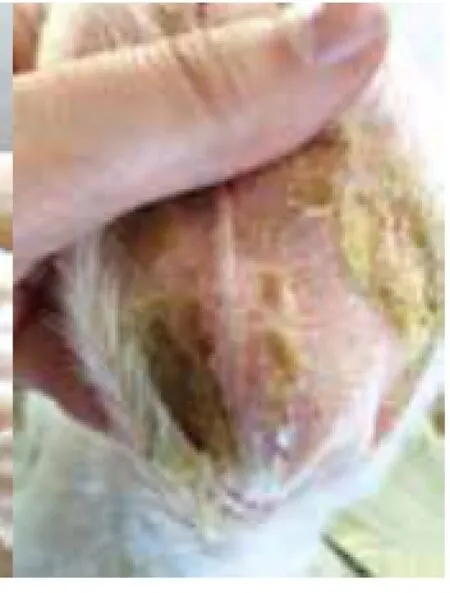
图3 低剂量组兔耳皮肤
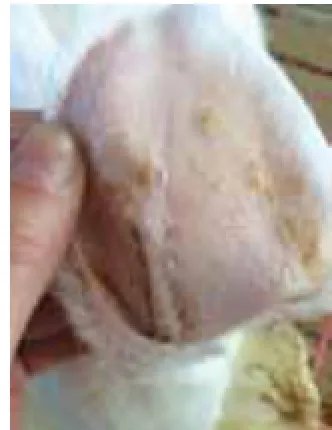
图4 中剂量组兔耳皮肤

图5 高剂量组兔耳皮肤
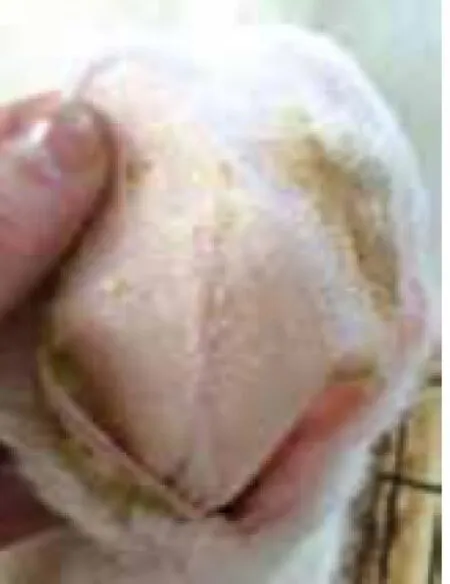
图6 药物对照组兔耳皮肤
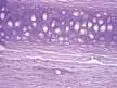
图7 正常对照组病理学观察(HE染色,×40)
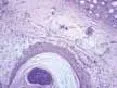
图8 模型对照组兔耳皮肤(HE染色,×40)

图9 低剂量组兔耳皮肤(HE染色,×40)
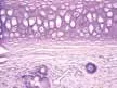
图10 中剂量组兔耳皮肤(HE染色,×40)
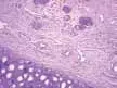
图11 高剂量组兔耳皮肤(HE染色,×40)

图12 药物对照组兔耳皮肤(HE染色,×40)
2.3治疗后各组家兔血清IL-1α、IL-6含量检测结果:与正常对照组比较,其余5组IL-1α、IL-6含量均显著升高,差异有统计学意义(P<0.01);与模型对照组比较,痤疮合剂低、中、高剂量组及药物对照组含量均显著下调,差异有统计学意义(P<0.01);与低剂量组比较,中、高剂量组及药物对照组含量显著下调,差异有统计学意义(P<0.01);与中剂量组比较,高剂量组含量显著下调,差异有极显著意义(P<0.01),药物对照组含量亦显著下调,差异有统计学意义(P<0.05);IL-1α高剂量组和药物对照组差异有统计学意义(P<0.05);IL-6高剂量组和药物对照组差异无统计学意义(P>0.05)。

表1 各组家兔血清lL-1α、lL-6含量 (n=8,x-±s)
3 讨论
痤疮的发病主要是由于雄性激素分泌的增加使皮脂腺肥大,致使皮脂分泌逐渐旺盛,毛囊皮脂腺导管开口处角化过度,皮脂腺开口变小或闭塞,影响皮脂的排出,使皮脂瘀积在毛囊内[2]。滞留的皮脂在痤疮丙酸杆菌的作用下,分解产生游离脂肪酸从而导致痤疮的炎症反应;炎症和感染又进一步加重本病的皮损,因此炎症是痤疮发病的重要因素之一,参与痤疮炎症反应的主要有IL-1α、IL-6、IL-8及TNF-α等细胞因子。IL-1是一个炎症细胞因子家族,包括 IL-1α、IL-1β和IL-1Ra,其中IL-1α是其在皮肤的内主要存在形式,IL-1α会引起毛囊皮脂腺导管的过度角化,以致痤疮疾病的发生与发展;IL-6是炎性反应的促发剂,由于在急性炎症期时水平会升高的特质,所以认为其是许多炎症性疾病的重要介质[3-7]。
痤疮临床治疗常采用抗生素、雌性激素或抗雄性激素、异维A酸等药物治疗。但上述各类药物具有较大副作用[8]。近代医家认为本病发生与饮食不节,过食辛辣油腻之品有关,过食辛辣油腻导致湿热内生,循经上壅,则粉刺易生;热郁不解,湿邪留滞,久而化毒,兼痰凝血热,则见皮疹从生[9]。笔者认为痤疮患者多处于青春期,生机旺盛,发病多由于素体阳热偏盛,嗜辛辣、肥甘厚味之品,引起肺胃湿热积蕴,以致湿热火毒郁于肌肤腠理,引起疾病发生。治宜清热祛湿,解毒散结。针对上述理论,结合祖国医学和现代医学对寻常痤疮发病机理的认识。辽宁中医药大学附属医院以清肺胃湿热,解毒散结为治则,研制了痤疮合剂,方中金银花清热解毒,芳香透邪,连翘清热解毒,消痈散结,二药相伍,为治热毒疮痈要药[10]。黄芩清肺热,黄连泻胃火,二药合用以清泻肺胃湿热火毒。桑白皮、枇杷叶泻肺胃之热且降逆气,俾火不上逆;沙参清热并能养阴,以防邪热伤阴。夏枯草清热散结,牡蛎软坚散结,合用以助消痈散结。牛蒡子疏散热毒,散结消肿,防风辛散透表,蝉蜕宣散透邪,葛根解肌散邪,四药合用,促使热毒邪气从肌表而散。热毒蕴结,气血郁滞不畅,故以地黄凉血清热,牡丹皮凉血散瘀,川芎活血行气,香附行气止痛,如此血畅气行,则郁热火毒易解。诸药合用,共奏清肺胃湿热,解毒散结之功,治疗寻常痤疮具有科学依据,临床疗效可靠。本实验进一步探讨了痤疮合剂的作用机制,研究发现痤疮合剂除了能减少兔耳毛囊角栓和结节,减轻兔耳毛囊口扩张程度,减少炎症细胞浸润,对血液中相关炎症因子也具有抑制作用,通过抑制IL-1α和IL- 6的产生进一步抑制毛囊的炎症损伤,从而阻断痤疮的形成和炎症级联反应。
通过本研究还能发现目前国内对痤疮研究多停留在疗效观察层面,对其作用机制也没有深入到细胞生物学和分子生物学水平,今后的研究有待继续深化。
[1]Fulton JE,Pay SR,Fulton JE.Comedogenicity of current therapeutic products,cosmetics,and ingredients in the rabbit ear[J].J Am Acad Dermatol,1984,10(1):96-105.
[2]张丽,薛国娜,朱镭,等.消痤胶囊治疗痤疮抗炎作用的实验研究[J].中医药导报,2014,20(11):10-12.
[3]杨宪鲁,王海燕,雷旭光,等.红蓝光联合治疗对寻常痤疮患者血清IL-1、IL-6、IL-8水平的影响[J].中国美容医学,2013,22(22):2200-2202.
[4]文娜,郝晋东,晋志高.面部刺络闪罐结合体针治疗聚合性痤疮的临床研究[J].北京中医药,2012,31(3):364-366.
[5]王思农,张娅茹,张博,等.三黄凝胶对大鼠耳廓痤疮模型血清IL-1α、TNF-α的影响[J].西部中医药,2013,26(1):7-8.
[6]刘文彬,梁庆,王晖,等.外用丹参酮乳膏抗痤疮药效及机制[J].中国实验方剂学杂志,2012,18(14):212-216.
[7]孙莉,连海燕,颜敏,等.红蓝光治疗对痤疮患者外周血炎症介质表达的影响[J].广东医学,2014,35(9):1385-1387.
[8]Roodsari MR,Akbari MR,Sarraf-rad N,et al.The effect of isotretinoin treatment on plasma homocysteine levels in acne vulgaris[J].Clin Exp Dermatol,2010,35(6):624-626.
[9]王伟明,白海玉,张树明.痤消灵丸对痤疮模型的实验研究[J].黑龙江医学,2012,36(3):180-181.
[10]胡秀娟,雷鸣.金银花治疗青春期痤疮的临床经验浅析[J].中国美容医学,2015,24(8):72-73.
Experimental study of the impact of acne mixture on animal serum IL-1α and IL-6 on rabbit ears acne models
ZHANG Xiao-qing1,GU Wei2,PIAO Mei-shu3,WU Jing-dong1
(1.Liaoning University of Traditional Chinese Medicine, Shenyang Liaoning 110847; 2.The Affliated Hospital of Liaoning University of Traditional Chinese Medicine hospital, Shenyang Liaoning 110032;3.Korean Wonk Wang University,Seoul Korea)
Objective In this study, acne mixture is the treatment factors, which is hospital preparation from Liaoning University of Traditional Chinese Medicine hospital, and using rabbit ear as acne model, from follicular keratosis degree and the perspective of anti-infammatory effects to study effcacy of acne mixture on acne rabbit ears model, and explore the mechanism of action. Methods Painted coal tar on rabbit ears to make acne models, every times 0.5 ml, for two consecutive weeks. After determine the successful model, the animals were divided into normal control group, model control group, low dose group,medium dose group,high dose group and drug control group. By observed local pathological changes and detection of serum IL-1α,IL-6 content to observed inhibition of oral acne mixture on acne infammatory. Results Acne mixture can reduce the rabbit ear follicular keratinous plug and nodules, reduce rabbit ears hair follicle dilation, and reduce infammatory cell infltration. Each group of IL-1α, IL-6 content were signifcantly increased after modeling(P<0.01). Compared with model control group,acne mixture low, medium and high dose group and drug control group content were signifcantly reduced (P<0.01).High dose group and drug control group was signifcantly down-regulated more;IL-1α decline was most obvious in the high dose group,there were statistical signifcance compared with drug control group(P<0.05). IL-6 had no statistic signifcance between high dose group and drug control group(P>0.05). Conclusion Acne mixture acne treat mechanism of action is related to inhibition related infammatory factors in blood.
acne; acne mixture; IL-1α; IL-6
R622 Q813.1
A
1008-6455(2016)08-0047-04
2016-05-15
2016-07-25
编辑/张惠娟
辽宁省教育厅科学研究项目(课题编号L2014363)
吴景东,男,黑龙江哈尔滨人,教授,博士研究生导师,博士;研究方向:中医药抗皮肤衰老。E-mail:lnzywjd0719@163.com
