硫酸庆大霉素中RNA和DNA的检查
2016-10-27杨帆夏云空刘晓薇席德慧
杨帆夏云空刘晓薇席德慧
(1.四川大学生命科学学院 四川成都 610042; 2.成都蓉生药业有限责任公司 四川成都 61000)
硫酸庆大霉素中RNA和DNA的检查
杨帆1,2夏云空2刘晓薇2席德慧1
(1.四川大学生命科学学院 四川成都 610042; 2.成都蓉生药业有限责任公司 四川成都 61000)
目的 为检查硫酸庆大霉素中的RNA与DNA,方法 先用凝胶柱色谱法分离出RNA与DNA,再采用改良苔黑酚法检查RNA,采用二苯胺法检查DNA。结果 RNA在1~20μg范围内,吸光度与浓度线性回归的相关系数r=0.9993,检测限和定量限分别为0.28μg和0.85μg,平均回收率为96.1%;DNA在5~200μg范围内,吸光度与浓度线性回归的相关系数r=0.9995,检测限和定量限分别为2.8μg和6.3μg,平均回收率为93.3%。结论 所建立的方法专属、灵敏、准确,可用于硫酸庆大霉素中RNA 和DNA的检查。
硫酸庆大霉素 RNA DNA 凝胶柱色谱法 改良苔黑酚法 二苯胺法
1 实验部分
1.1 仪器与试药
UV-1800PC 紫外-可见分光光度计(上海MAPADA);
RNA对照品(酵母核糖核酸,中国科学院上海生物化学研究所,含磷量大于7.0%);
DNA对照品(小牛胸腺DNA,XIASI BIO公司生产);
葡聚糖凝胶(Sephadex G-50);
其他试剂均为分析纯。
1.2 方法与结果
1.2.1 RNA的检查
采用改良苔黑酚法检查本品中的RNA。改良苔黑酚法是利用RNA与盐酸共热,发生降解并生成糖醛,在铜离子的催化下,糖醛可与苔黑酚(3,5-二羟基甲苯)反应,生成绿色产物,在670nm有最大吸收,采用比色法测定[2]。由于硫酸庆大霉素对检查有干扰,采用凝胶柱色谱法分离出RNA后,再进行检查。
1.2.1.1 测定方法
苔黑酚铜离子试液的配制:
试液A:称取苔黑酚5.0g,,溶解于10ml 95%的乙醇中,摇匀;
试液B:称取氯化铜0.15g,溶解于100ml浓盐酸中,摇匀;
临用前,量取试液A 1ml 与试液B 100ml,混匀,即得。
对照品溶液的制备:准确称取RNA对照品10.0mg,置10ml量瓶中,加水适量,振摇使溶解,加水稀释至刻度;精密量取上述溶液1ml,置100ml量瓶中,用水稀释至刻度,混匀,即得。(0.01mg/ml)
凝胶柱的制备:取葡聚糖凝胶(Sephadex G-50)20g,加水适量使溶胀,用水冲洗数次,装于玻璃柱(25×1.5cm;有效柱长约16. 5cm)内,待凝胶自然沉降完全后,加3倍于柱体积的水洗涤,备用。
供试品溶液的制备:称取硫酸庆大霉素样品1.0g,置10ml量瓶中,加水适量,振摇使溶解,再加水稀释至刻度,摇匀(100mg/ml);量取上述溶液1.0ml,加于预先装好的凝胶柱上,以水为洗脱剂洗脱,流速为0.25ml/min,弃去初流出液8ml,收集续流出液8ml,备用。
测定方法:按下表配制好溶液后,同置沸水浴内加热35min,放冷后,以6号管为空白,在670nm波长处测定吸光度,用标准曲线法计算样品中R N A的含量。
1.2.1.2 方法的考察
(1)线性和范围
按1.2.1.1项下方法配制不同浓度的对照品溶液,测定吸光度,以吸光度(A)对RNA的量(X)进行线性回归, 结果表明,吸光度与浓度呈良好的线性关系。
(2)检测限和定量限
采用空白信号标准差法测定。取空白溶液,重复测定3次,测得吸光度分别为0.001、0.000和0.000。计算得空白信号标准差σ为5.8× 10-4。
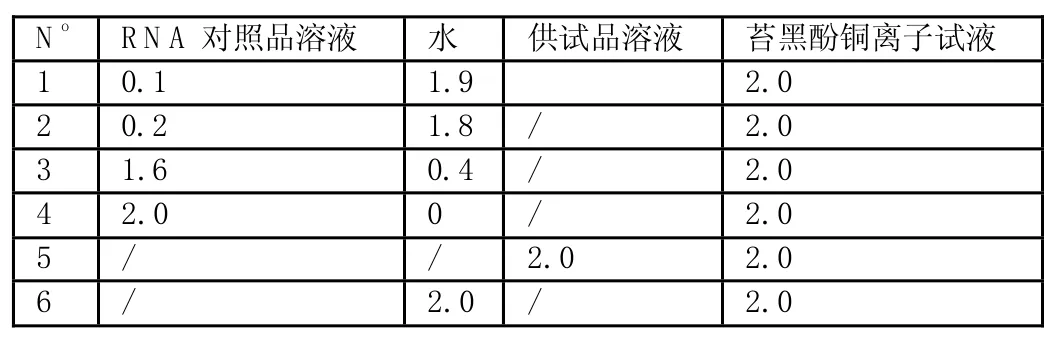
表1 RNA的测定方法 单位:ml

表2 RNA测定回收试验的结果

表3 样品中RNA的测定结果

表4 DNA的测定方法 单位:ml

表5 DNA测定回收试验的结果
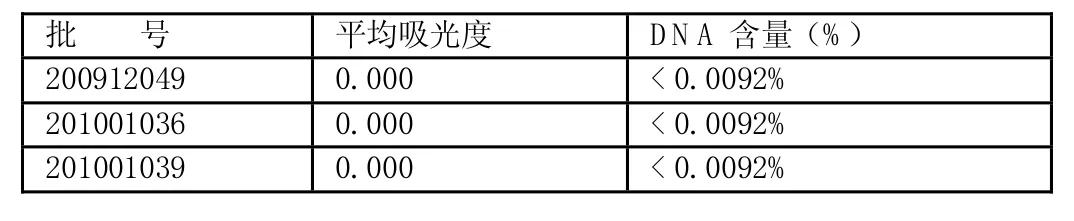
表6 样品中DNA的测定结果
(3)回收试验 准确称取已测定RNA含量的硫酸庆大霉素1.0g,加入高低两种浓度的RNA对照品溶液,按1.2.1.1项下方法测定RNA的含量,并计算回收率,结果见下表:
1.2.1.3 样品中RNA的测定
称取硫酸庆大霉素1.0g,按1.2.1.1项下的方法测定,结果见下表:
1.2.2 DNA的检查
采用二苯胺法检查本品中的DNA。二苯胺法是利用DN A在酸性溶液中加热降解,生成2’-脱氧核糖并形成ω-羟基-γ-酮基戊醛,后者与二苯胺试剂反应,生成蓝色化合物,在595nm有最大吸收,采用比色法测定[2]。由于硫酸庆大霉素对检查有干扰,所以采用凝胶柱色谱法分离出DNA后,再进行检查。
1.2.2.1 测定方法
二苯胺试液的配制:
试液A:称取二苯胺0.4g,加冰醋酸90ml使溶解,加高氯酸4ml,混匀;
试液B:量取40%的乙醛溶液1.0ml,加水稀释至25ml,混匀;
临用前取A液,加B液0.4ml,混匀,即得。
对照品溶液的制备:准确称取DNA对照品10.0mg,置10ml量瓶中,加水溶解并稀释至刻度;精密量取上述溶液1ml,置10ml容量瓶中,加水稀释至刻度,混匀,即得。(0.1g/ml)
凝胶柱的制备与供试品溶液的制备:同1.2.1 RNA测定项下。
测定方法:按下表配制好溶液后,置60℃水浴中加热1.5h,放冷,以6号管为空白,于595nm波长处测定吸光度,用标准曲线法计算样品中D N A的含量。
1.2.2.2 方法的考察
(1) 线性和范围 按1.2.2.1项下方法配制不同浓度的对照品溶液并测定吸光度,以吸光度对DNA的量进行线性回归,结果表明,吸光度与浓度呈良好的线性关系。
(2) 检测限和定量限
空白信号的测定:采用空白信号标准差法测定。取空白溶液(同1项下的9#溶液),重复测定3次,测得吸光度分别为0.000、0.001和0.000。计算得空白信号标准差σ为5.8×10-4。
(3)回收实验:准确称取已测定DNA含量的硫酸庆大霉素1.0g,加入高低两种浓度的DNA对照品溶液,按1项下方法测定DNA的含量,并计算回收率,结果见表7:
1.2.2.3 样品中DNA的测定
称取硫酸庆大霉素1.0g,按1.2.2.1项下的方法测定,结果如下:
1.3 讨论
1.3.1 由于硫酸庆大霉素对检查有干扰,所以采用凝胶柱色谱法分离出核酸后,再进行检查。选择葡聚糖凝胶(Sephadex G-50)进行分离,RNA和DNA分子量较庆大霉素大,在分离过程中为全排阻,首先被洗脱。分别取核酸对照品溶液和硫酸庆大霉素溶液,加于葡聚糖凝胶柱上,收集洗脱液,用紫外分光光度法监测,确定组分的保留体积。结果表明,在实验条件下,死体积约为8ml,两种核酸在随后的8ml内被洗脱,庆大霉素随后被洗脱,核酸和庆大霉素可以完全分离。
[1]华维一.药物化学[S]. 北京:高等教育出版社,2004.
[2]赵亚华.生物化学实验技术教程.广州:华南理工大学出版社,2000.
Determination of RNA and DNA in Gentamicin Sulfate
YANG FAN1,2
(1.College of live scienen Sichuan university,Chengdu, 610041 China;2.Chengdu rongshen pharmaceuticals co., Chengdu,610000 China)
Objective: To determine RNA and DNA in Gentamicin Sulfate, Methods: RNA and DNA were separated by gel chromatography and determined with improved orcinol colorimetry and diphenylamine colorimetry, respectively. Results: For RNA determination, the linear range was 1~20 μ g (r=0.9993). LOD and LOQ were 0.28μg 0.85μg, respectively. The average recovery was 96.1%. For DNA determination, the linear range was 5~200 μg (r=0. 9995). LOD and LOQ were 2.8μg 6.3μg, respectively. The average recovery was 93.3%. Conclusion: The methods were specific, sensitive, accurate and suitable for determination of RNA and DNA in Gentamicin Sulfate.
Gentamicin Sulfate; RNA; DNA; Gel chromatography; Improved orcinol colorimetry; Diphenylamine colorimetry
R917
A
1674-2060(2016)02-0166-02
杨帆,男,汉族,现从事于血液制品行业,就职于成都蓉生药业有限责任公司,具有多年的生产工作经验,同时为四川大学生命科学学院2012级在职研究生。
