青霉素结合蛋白PBP 2b基因的克隆与表达
2016-10-27覃鸿妮俞苏敏
覃鸿妮 俞苏敏
(苏州工业园区服务外包职业学院 江苏苏州 215123)
青霉素结合蛋白PBP 2b基因的克隆与表达
覃鸿妮 俞苏敏1
(苏州工业园区服务外包职业学院 江苏苏州 215123)
在已知基因序列但缺乏DNA模版的情况下,人工设计合成多条引物,采用重叠PCR技术体外人工合成编码青霉素结合蛋白的基因PBP 2b。将合成的PBP 2b基因连接到载体pet-30a上,并将重组表达载体(pet-30a)/PBP2b-tiger转入T7 expression E.coli表达菌株中。重组工程菌经IPTG诱导,用SDS-PAGE鉴定,发现青霉素结合蛋白(PBPs)成功表达。本研究构建了高表达青霉素结合蛋白(PBPs)的原核表达系统,制备出青霉素结合蛋白,从而为进一步从基因水平认识青霉素结合蛋白(PBPs)奠定基础,为了解细菌耐药的机制提供依据。
青霉素结合蛋白 PBP 2b基因 克隆 表达
青霉素结合蛋白(penicillin binding proteins, PBPs) 是细菌表面的一种微小蛋白质,PBPs由Suginaka 等于1972年第一次报道,能和青霉素共价结合,使青霉素具有完全的抗原性[1]。PBPs是一类在肽聚糖合成中起着重要作用酶类,当外源青霉素或其它β-内酰胺类抗生素作为青霉素结合蛋白底物(细胞正常代谢过程中,本应与青霉素结合蛋白反应结合的物质)的结构类似物,竞争性地与青霉素结合蛋白共价结合,就可以引起细菌细胞壁合成相关酶的缺乏,从而干扰细菌细胞壁的合成,以达到杀灭细菌的作用[2]。一旦青霉素结合蛋白的数量、种类或者与抗生素的亲和力发生变化将会影响细菌的形态或细菌对抗生素的敏感性。细菌青霉素结合蛋白改变引起的细菌对抗生素的耐药性是现研究的热点之一,其对抗生素的改造、新抗生素的设计均有指导意义[3,4,5,6]。肺炎链球菌能引起肺炎、脑膜炎、中耳炎及败血症等多种疾病,是常见细菌性感染的主要病原菌之一,多年来一直是人类健康的大敌,也是科学家研究的焦点之一。PBP 2b基因是肺炎链球菌中已发现的5个编码明确的青霉素结合蛋白的基因之一[7],其表达蛋白为青霉素结合蛋白2b,基因编号为spr1517。本研究着重于编码肺炎链球菌PBPs的其中一个基因PBP 2b的克隆及表达,为的是更深层次的了解青霉素结合蛋白相关基因的表达机制,以便为进一步深入研究青霉素结合蛋白奠定基础,为了解细菌耐药的机制提供依据。
1 材料与方法
1.1 试验材料
1.1.1 目的基因
在NCBI网站(http://www.ncbi.nlm.nih.gov/)查询Sundick等发表的肺炎链球菌的PBP 2b 基因的序列,根据其基因序列,利用PAS技术合成该基因即为本研究的目的基因。
1.1.2 受体菌TOP10、T7 expression E.coli ;载体 pet30a。
1.2 方法
根据基因序列委托相关公司设计和合成PCR扩增所需PBP 2b的引物,将引物稀释到20pmol/uL,每条引物取2uL混匀作为引物混液。通过两轮PCR扩增目的基因。第一轮PCR引物拼接获得目的基因,第二轮PCR(基因扩增),在第一轮PCR以后, 以扩增的产物为模版,用片段两端的引物进行基因扩增。扩增结果采用琼脂糖凝胶电泳检测并回收目的基因.
1.2.2 目的基因克隆
(1)目的基因与载体双酶切后连接
用BamHI与XhoI酶切来获得目的基因PBP 2b,同时用BamHI与XhoI酶切载体pGEM-T。酶切后将目的基因与载体连接。
(2)连接产物转化
取一管-80℃保存的感受态细胞(100μl),置冰上融化;加入连接产物pGEM-T/PBP 2b(10μl),轻轻旋转离心管以混匀,冰浴30min;将1.5EP管置于42℃热击100s,然后迅速置冰浴3分钟;向管中加入800uL LB培养基(不含抗生素),混匀后置于37℃摇床振荡培养30min(目的是使质粒上相关的抗性标记基因表达,使菌体复苏);
将1.5EP管5000r离心5min,析出部分培养液,弃之,吸取前吹打一下,把约100ul已转化的感受态细胞加到LB体琼脂培养基上(含50ug/ml Amp,内已倒入若干无菌的玻璃珠),把平板轻轻地上下左右均匀摇晃,使得无菌的玻璃珠将细胞均匀涂开;将平板置于室温直至液体被吸收,倒置平板,37℃过夜培养,至蓝白斑生长区分明显为止。
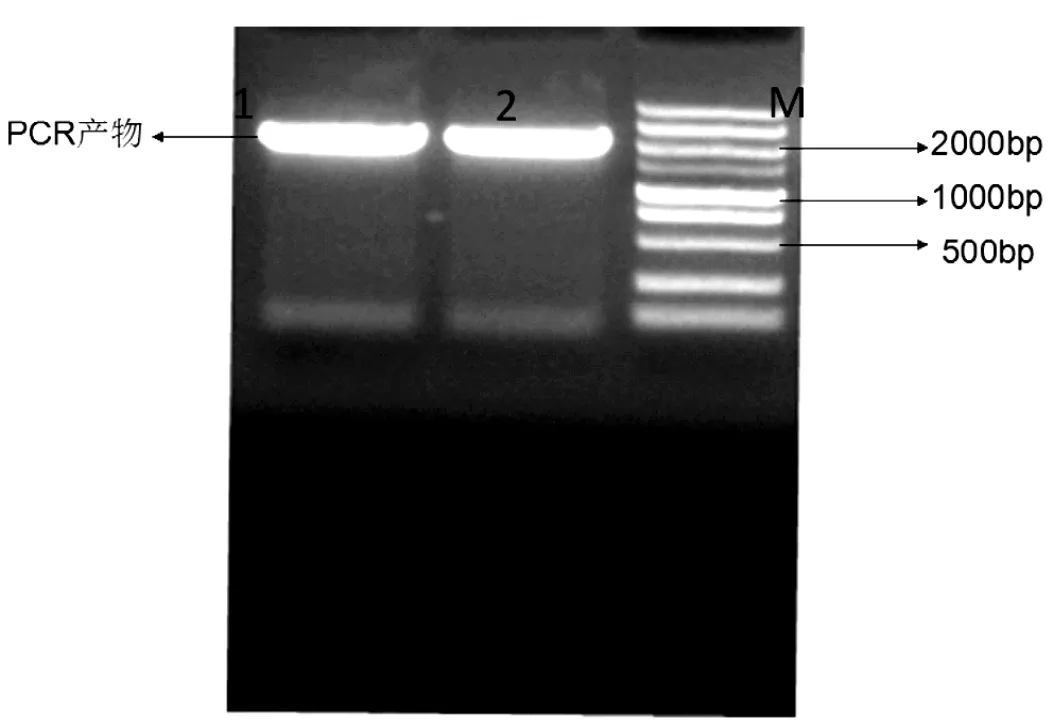
图1 目的基因的PCR产物琼脂糖凝胶电泳图

图2 pGEM-T/PBP 2b 酶切电泳图
1.2.3 阳性克隆的PCR鉴定
随着生产力的发展,奴隶主土地的开垦面积越来越大,从前的“井田制”遭到破坏,许多奴隶主一方面使用奴隶开垦公田同时又大量招收“隐民”、“私属徒”进行开荒,扩大自己的私田面积。有些贵族为了增加自己的收入大量开发荒芜的上地,就成为拥有大量私田的地主。另一方面,从事大规模集体生产的奴隶,由于不堪忍受奴隶主的残酷剥削和压迫,则纷纷选择逃亡,这样就使井田逐渐荒芜。井田制的破坏,就说明奴隶制社会的经济基础开始崩溃。私田的不断增多,促进了封建生产关系的产生和新兴地主阶级势力的发展,最终打破了奴隶社会“工商食官”社会分工体系。
阳性克隆的验证通过随机挑取转化平板上的阳性单菌落,接种于2mL LB培养基(50μg/ml Amp)中,37℃ 8h 220r振荡培养后提取质粒对其目的基因进行PCR扩增,进而多扩增产物进行琼脂糖凝胶电泳检测。将pGEM-T/PBP 2b质粒用BamHI和XhoI酶切后通过琼脂糖电泳来验证目的基因并获得目的基因。用移液枪吸取6 μl的菌检PCR产物点入浓度为1%的检测胶,电泳仪220V、280mA电泳7min。
1.2.4 蛋白表达
(1)将正确克隆(pet-30a)/PBP2b-tiger转入T7 expression E. coli(NEB菌株),菌液涂布于同时含Amp和Kan的LB固体培养基上,37°C培养过夜。
(2)取2克隆分别加入含4 m l L B的试管中,3 7°C培养至OD600=0.6 ,取一试管中加入4μl,浓度为1M的IPTG诱导剂,使终浓度为1mM,另一试管不加诱导剂作为阴性对照。再继续培养3h,各吸取500μl菌液离心,弃上清。每管加入50μl 50mM,pH8.0的Tris-Hcl。混匀后,沸水煮10min,离心取上清液,采用SDS-PAGE法鉴定表达产物。
2 结果与分析
2.1 目的基因的合成
目的基因的电泳检测结果如图1所示,PBP2b的PCR产物条带大小在2000bp左右,与其理论值大小2262bp相符,可判断PCR产物正确。
2.2 pGEM-T/PBP 2b 酶切结果
将pGEM-T/PBP 2b质粒用BamHI和XhoI酶切后通过琼脂糖电泳来验证目的基因并获得目的基因。通过电泳图2可表明上带大小为3 0 0 0 b p左右,下带在2 2 0 0 b p左右;与克隆载体p G E M-T 3100bp、目的基因PBP 2b 2262bp的大小相吻合。
2.3 表达载体的构建与验证
将酶切下的目的基因PBP 2b连接到表达载体(pet-30a),用BamHI和XhoI酶切后通过琼脂糖电泳来验证目的基因是否导入。通过电泳图3可表明上带大小为5000 bp左右,下带在2200bp左右;与表达载体(pet-30a)5300bp、目的基因PBP 2b 2262bp的大小相吻合,可判定表达载体构建正确。
2.4 PBP 2b所表达的蛋白检测
通过不同浓度的IPTG来诱导PBP 2b,SDS-PAGE凝胶电泳来检测蛋白,从图4可知用0.3mmol/L、0.6mmol/L、0.9mmol/L 浓度的IPTG诱导出的蛋白大小约为87KD左右,与PBP 2b应表达蛋白大小相吻合,但表达强度不同,可判断IPTG的浓度对于PBP 2b蛋白表达强度有一定影响。

图3 表达载体的酶切验证

图4 PBP 2b蛋白表达检测
3 结论与讨论
3.1 青霉素结合蛋白PBP 2b基因的克隆
本研究运用PCR法获得PBP 2b基因,将连接到切成指定的克隆载体上;在PCR过程中产物两端加入BamHI和XhoI的酶切位点,经限制性内切酶处理连接至表达载体,运用转化表达载体成功获得PBP 2b的克隆。
3.2 青霉素结合蛋白PBP 2b基因的表达
通过诱导剂IPTG的不同浓度来诱导PBP 2b蛋白,结果表明IPTG的浓度直接关系到重组蛋白的表达水平,本研究结果显示,IPTG诱导E.coli BL21蛋白表达浓度在1 mmol/L以内时,其浓度越高诱导效果越好,但因IPTG既能诱导大肠杆菌表达外源蛋白质又同时对大肠杆菌有一定的毒害作用,故本研究没有设置高于1mmol/L的诱导浓度。
PBPs谱变异与细菌耐药性产生密不可分,本研究结果也为更深层次了解青霉素结合蛋白提供了实验依据,为了解细菌耐药性奠定基础。
[1]朱竟赫,郭文洁,刘耀川等.革兰阳性菌青霉素结合蛋白研究进展[J],动物医学进展,2010,31(1):77-80.
[2]熊亚莉,青霉素结合蛋白研究进展[J],国外医药抗生素分册,2004,25(5):193-197.
[3]向华国,王晓红,熊札宽,李凌云,潘鹏,朱德保,梅毒螺旋体青霉素结合蛋白的克隆及表达[J],中国热带医学,2008,8(5):723-724,727.
[4]陈婉纯.呼吸道细菌对抗生素的耐药性与合理使用抗生素[J],中国医药指南,2013,11(21):266-267.
[5]綦廷娜,王和,陈峥宏.细胞壁缺陷肺炎链球菌青霉素结合蛋白2b基因片段的检测[J],2010,36(5):552-553.
[6]孔聪聪,刘改芳.幽门螺杆菌对抗生素耐药的分子机制研究进展[J],2014,29(4):478-480.
[7]袁竹青,吴忠道,肺炎链球菌R6株全基因组序列的初步分析[J],中国人兽共患病杂志2003,19(6):93-97.
Q75
A
1674-2060(2016)02-0011-02
覃鸿妮(1983—),女,湖北长阳人,博士,讲师,研究方向为分子生物学。
