南方红豆杉枝叶与果实中6种紫杉烷类化合物含量分析
2016-10-27杨星星王仁才张家银李炎林秦宇熊兴耀
杨星星,王仁才*,张家银,李炎林,秦宇,熊兴耀,2*
南方红豆杉枝叶与果实中6种紫杉烷类化合物含量分析
杨星星1,王仁才1*,张家银3,李炎林1,秦宇1,熊兴耀1,2*
(1.湖南农业大学园艺园林学院,湖南长沙 410128;2.中国农业科学院蔬菜花卉研究所,北京 100081;3.国家中医药管理局亚健康干预技术实验室,湖南长沙 410128)
以南方红豆杉的枝、叶、果实为材料,建立了高效液相色谱法同时测定6种紫杉烷类化合物(紫杉醇、三尖杉宁碱、7–表–10–去乙酰紫杉醇、7–表–紫杉醇、巴卡亭III、10–去乙酰巴卡亭III)含量的方法。结果表明:以甲醇–乙腈–水(体积比为25∶36∶39)为流动相,等度洗脱,检测波长227 nm,6种紫杉烷类化合物在35 min 内完全分离;南方红豆杉的枝、叶、果实中6种紫杉烷类化合物含量存在差异,其中,紫杉醇和7–表–10–去乙酰紫杉醇在种胚中含量最高,分别为866.47、722.50 μg/g,10–去乙酰巴卡亭III、巴卡亭III和7–表–紫杉醇在叶中的含量最高,分别为301.20、234.08、11.74 μg/g,三尖杉宁碱含量最高的部位是枝,为392.69 μg/g。
南方红豆杉;枝叶;果实;紫杉醇;紫杉烷;高效液相色谱法
紫杉醇是从红豆杉科红豆杉属植物中分离得到的一种四环二萜类生物碱[1],是世界上公认的高效、广谱天然抗癌药物,自1992 年被美国食品药物管理局(FDA)批准作为晚期卵巢癌的治疗药物以来,其临床应用范围已扩展到乳腺癌、肺癌、头颈癌、前列腺癌等多种癌症的治疗[2]。最新的临床研究表明,紫杉醇可用于治疗类风湿性关节炎[3]、早老年性痴呆[4]和先天性多囊肾病[5]等。随着其疗效的确认,需求量越来越大,但红豆杉属植物中的紫杉醇含量极低,野生的红豆杉属于国家一级保护树种,禁止砍伐。天然的紫杉醇主要来源人工栽培的红豆杉,但是红豆杉生长缓慢,从植物中直接提取紫杉醇无法满足市场需求。紫杉醇的全合成已在实验室获得成功,但效率太低,不具备商业价值[6]。目前紫杉醇的主要来源是从红豆杉的枝叶中提取含量较高的紫杉烷,再化学半合成紫杉醇[7]。
紫杉烷是紫杉醇的合成代谢相关化合物及其衍生物,目前已分离鉴定了400 多种紫杉烷类化合物。由于紫杉烷类化合物与紫杉醇结构的相似性,不少紫杉烷类化合物具有抗癌活性,还有一些紫杉烷类化合物可以通过结构修饰改造成紫杉醇甚至药效更好的化合物,如多烯紫杉醇[8]。
本研究以南方红豆杉的枝叶、果实为材料,建立了同时检测红豆杉枝叶果实中6 种紫杉烷类化合物的高效液相色谱法,分析了南方红豆杉不同部位紫杉醇以及相关紫杉烷类化合物的含量,旨在探明紫杉醇含量较高的部位,为南方红豆杉资源综合利用提供理论依据。
1 材料与方法
1.1材料
供试材料采自湖南省浏阳市大围山的南方红豆杉((Pilger) Rehd.var.Cheng et L. K. Fu),约50年生,由中国农业科学院蔬菜花卉所熊兴耀教授鉴定。
试剂:甲醇,乙腈(色谱纯,美国MERK公司);超纯水(由英国ELGA公司生产的纯水仪制备);其他试剂均为分析纯(国药集团化学试剂有限公司);紫杉醇(质量分数>99.6%,批号 100382–201102),7–表– 10–去乙酰紫杉醇(质量分数>98%,批号 100925– 201102),7–表–紫杉醇(质量分数>98%,批号100927–201102),三尖杉宁碱(质量分数>98%,批号 100926–201102)购自中国食品药品检定研究院;10–去乙酰巴卡亭III(质量分数≥98.0%,批号 CRM009749),巴卡亭III(质量分数≥98.0%,批号CRM009301)购自美国International Laboratory (IL)。
主要仪器和设备:Agilent 1260 高效液相色谱仪;色谱柱ZORBAX SB–C18(250 mm×4.6 mm,5 μm) (美国Agilent 公司);旋转蒸发仪(上海亚荣生化仪器厂,RE–5200A);KQ–52000DE型数控超声波清洗器(昆山市超声仪器有限公司);AB104 电子天平(瑞士METTLER公司)。
1.2方法
1.2.1样品采集
试验于2014年进行。在南方红豆杉果实成熟期,从植株东、南、西、北4个方向随机采集当年生的枝、叶、果实各约2 kg,再把果实分为假种皮、种皮、种胚3部分,将材料按部位混合均匀,放置−80 ℃冰箱冻存,备用。
1.2.2色谱条件
色谱柱为ZORBAXSB–C18( 250 mm ×4.6 mm,5 μm),流动相为甲醇–乙腈–水(体积比为25∶36∶39),等度洗脱35 min,流速0.8 mL/min;柱温35 ℃,紫外检测波长227 nm,进样量10 μL。
1.2.3标准曲线的绘制
分别精密称取标准品10–去乙酰巴卡亭III(10.4 mg)、巴卡亭III(10.0 mg)、三尖杉宁碱(21.0 mg)、紫杉醇(20.2 mg)、7–表–10–去乙酰紫杉醇(19.6 mg)、7–表–紫杉醇(20.0 mg),置于5 mL 容量瓶中,用甲醇定容,配制单标准溶液作为贮备液。以6 种单标准溶液为基础,配制含6 种标准品的混合标准溶液,使溶液中的10–去乙酰巴卡亭III、巴卡亭III、三尖杉宁碱、紫杉醇、7–表–10–去乙酰紫杉醇、7–表–紫杉醇最终质量浓度分别为0.204、0.196、0.412、0.402、0.384、0.392 mg/mL,于4 ℃冰箱中储存,备用。
分别精密移取混合标准品溶液0.015、0.060、0.200、0.600、0.800、1.000、1.250 mL置于10 mL 容量瓶中,用甲醇定容。按1.2.2色谱条件,分别进样10 μL,记录峰面积。以峰面积为纵坐标(),质量浓度为横坐标(,μg/mL),进行线性回归,得到10–去乙酰巴卡亭III、巴卡亭III、三尖杉宁碱、紫杉醇、7–表–10–去乙酰紫杉醇、7–表–紫杉醇的线性回归方程及线性关系。
1.2.4样品溶液的制备
参照文献[9]的方法并稍作改进。分别称取2.0 g枝、叶、假种皮、种皮、种胚于研钵中,液氮研磨至粉末状,置于50 mL离心管中,加入 20 mL甲醇,在超声功率200 W,温度25 ℃时超声提取30 min,2 000 r/min离心15 min,取上清液。重复3次,合并上清液,加适量石油醚除去非极性色素,于45 ℃下减压、浓缩、干燥,加10 mL甲醇溶解,过0.45 μm 微孔滤膜,收集滤液,备用。
1.2.5方法学考察
参照文献[10]的方法进行。
1) 精密度试验。取1.2.3中混合标准品溶液,在1.2.2色谱条件下连续进样 6 次,记录峰面积,计算6种紫杉烷类化合物峰面积的。
2) 稳定性试验。在1.2.2色谱条件下,将新制备的同一份供试溶液,室温条件下放置,分别于0、1、2、4、6、8、12、24 h进行取样测定,记录峰面积,计算6种紫杉烷类化合物峰面积的。
3) 重现性试验。称取样品6份,每份2.0 g,按稳定性试验方法制备成甲醇提取液,在1.2.2中色谱条件下测定,记录峰面积,计算6种紫杉烷类化合物峰面积的。
4) 加样回收率试验。按照样品含量的80%、100%和120%添加标准品溶液。重复2次。按照样品制备方法进行超声提取,浓缩后定容,再进行含量检测,计算加样回收率。
1.2.6样品的测定
将制备的样品溶液在1.2.2色谱条件下进样检测,根据样品与标准品出峰时间对比,测出每个样品中所含目标化合物的峰面积,通过标准曲线将每个目标化合物的峰面积换算成质量浓度(1,μg/mL)。
1.2.7紫杉烷类化合物含量计算
含水量测定方法:称取不同样品质量1约2.0 g,置于105 ℃下烘干至恒重,放置干燥箱冷却并称质量2,则含水量=1–2/1。重复3次,取平均值[11]。不同部位材料中紫杉烷的含量均折算成干重含量,根据下列公式计算,=1×/(1×(1–)。式中为样品中紫杉烷含量(μg/g);1为高效液相色谱法检测的紫杉烷浓度(μg/mL);为样品体积(mL)。重复6次,结果取平均值。
1.2.8数据分析
所得数据采用统计分析软件SPSS 22.0进行统计分析,显著性分析采用单因素方差分析。
2 结果与分析
2.1HPLC 分析结果
以甲醇–乙腈–水(体积比为25∶36∶39)为流动相,等度洗脱35 min,在此色谱条件下,高效液相色谱图基线稳定,标准品溶液与样品溶液中组分分离度好,6种紫杉烷类化合物保留效果较好,达到基线分离(图1)。与中国药典的检测方法对比,洗脱时间更短,检测的化合物种类更多。标准曲线绘制结果显示,10–去乙酰巴卡亭III、巴卡亭III、三尖杉宁碱、紫杉醇、7–表–10–去乙酰紫杉醇、7–表–紫杉醇的质量浓度与峰面积线性关系良好(表1)。

表1 6种标准品的回归方程和线性范围
2.2方法学考察结果
精密度试验结果显示,在本试验检测条件下,10–去乙酰巴卡亭III、巴卡亭III、三尖杉宁碱、紫杉醇、7–表–10–去乙酰紫杉醇、7–表–紫杉醇的色谱峰面积的分别为0.38%、0.34%、0.48%、0.49%、0.53%、0.47%,表明仪器精密度良好。稳定性试验结果显示,在本试验检测条件下,10–去乙酰巴卡亭III、巴卡亭III、三尖杉宁碱、紫杉醇、7–表–10–去乙酰紫杉醇、7–表–紫杉醇的峰面积的分别为0.78%、1.19%、0.89%、0.73%、0.89%、1.22%,说明6 种紫杉烷类化合物在24 h 内的稳定性良好。重现性试验结果显示,10–去乙酰巴卡亭III、巴卡亭III、三尖杉宁碱、紫杉醇、7–表–10–去乙酰紫杉醇、7–表–紫杉醇的色谱峰面积的分别为1.01%、0.98%、1.26%、1.89%、1.07%、1.13%,表明方法重现性良好。加样回收率试验结果显示,10–去乙酰巴卡亭III、巴卡亭III、三尖杉宁碱、紫杉醇、7–表–10–去乙酰紫杉醇、7–表–紫杉醇的平均回收率分别为98.3%、102.2%、106.5%、99.1%、104.3%、101.5%,分别为1.97%、2.16%、1.98%、2.13%、1.91%、2.11%。
2.3样品的测定结果
由表2可知,不同紫杉烷类化合物在南方红豆杉植株中不同部位的含量差异较大。方差分析结果显示,不同部位紫杉醇含量存在显著差异,其中种胚中紫杉醇含量最高,平均含量为866.47 μg/g,接下来依次是种皮、枝、叶,假种皮紫杉醇含量最低,为23.33 μg/g。10–去乙酰巴卡亭III在叶中含量最高,为301.20 μg/g;其次是枝,为158.01 μg/g,其在种胚和种皮中的含量分别为124.09、116.05 μg/g。巴卡亭III在叶中含量最高,为234.08 μg/g,假种皮未检测到巴卡亭III。三尖杉宁碱含量最高的部位是枝,为392.69 μg/g;含量最低的部位是种胚,为26.16 μg/g,在假种皮中未检测到。7–表–10–去乙酰紫杉醇在种胚中的含量为722.50 μg/g,叶中的含量为237.20 μg/g,其他部位未检测到。7–表–紫杉醇仅在叶中检测到,为11.74 μg/g。
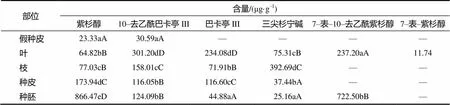
表2 不同部位紫杉烷类化合物的含量
同列不同大写字母表示差异极显著;不同小写字母表示差异显著。
3 结论与讨论
研究[12]表明,同一红豆杉不同部位的紫杉醇含量高低顺序依次为树皮、根皮、侧枝、种子、须根、嫩枝、叶,含量最高部位为树皮,均值可达418 μg/g。本研究结果表明,紫杉醇含量最高的部位是种胚,但种胚是否是南方红豆杉植株中紫杉醇积累最多的部位还需要进一步研究。
10–去乙酰巴卡亭III和巴卡亭III是生物合成紫杉醇的重要前体物质,也是化学合成紫杉醇的重要原材料,研究其含量分布规律,不仅有助于理解紫杉醇合成转运途径,还可以为紫杉醇的化学半合成提供新材料。研究[13]表明,10–去乙酰巴卡亭III、巴卡亭III在枝叶中含量最高,本试验结果表明叶中的10–去乙酰巴卡亭III含量最高,其次是枝。本研究发现种胚和种皮中含有丰富的前体化合物10–去乙酰巴卡亭Ⅲ和巴卡亭Ⅲ,种胚及其附近组织有充足的合成前体,可能有助于种胚大量积累紫杉醇。
目前所用紫杉醇主要从红豆杉的树皮和根中提取[14–15],而枝叶与果实是植株每年不断生长更新的部位,与采集红豆杉的树皮和根相比,采集红豆杉的枝叶果实对植株的伤害更小,因此,在大规模提取红豆杉中紫杉醇时,可以考虑用红豆杉的枝叶与果实来代替树皮。
参考文献:
[1] Wani M C,Taylor H L,Wall M E,et al.Plant antitumor agentsVI.Isolation and structure of taxol,a novel antileukemic and antitumor agent from[J].Journal of the American Chemical Society, 1971,93(9):2325–2327.
[2] Cragg G M.Paclitaxel (Taxol):a success story with valuable lessons for natural product drug discovery and development [J].Medicinal Research Reviews,1998,18(5):315–331.
[3] Oliver S J,Banquerigo M L,Brahn E.Suppression of collagen-induced arthritis using an angiogenesis inhibitor,AGM–1470,and a microtubule stabilizer,taxol[J]. Cellular Immunology,1994,157(1):291–299.
[4] Burke W J,Raghu G,Strong R.Taxol protects against calcium-mediated death of differentiated rat pheochro- mocytoma cells[J].Life Sciences,1994,55(16):313–319.
[5] Woo D D,Miao S Y,Pelayo J C,et al.Taxol inhibits progression of congenital polycystic kidney disease [J]. Nature,1994,368(6473):750–753.
[6] Nicolaou K,Yang Z,Liu J,et al.Total synthesis of taxol [J].Nature,1994,367(6464):630–634.
[7] Commeron A,Bourzat J,Didier E,et al. Practical semisynthesis and antimitotic activity of docetaxel and side-chain analogs [J].ACS Symposium Series,1994(583):233–246.
[8] Shi Q W,Kiyota H.New natural taxane diterpenoids fromspecies since 1999 [J].Chemistry & Biodiversity,2005,2(12):1597–1623.
[9] 石梦蝶,杨星星,曾静,等.高效液相色谱法测定南方红豆杉细胞悬浮液中紫杉醇含量[J].中南药学,2013(3):232–234.
[10] 李夏洁,李清明,苏小军,等.高效液相色谱法测定芒草60Coγ辐照降解副产物[J].湖南农业大学学报(自然科学版),2015,41(5):527–532.
[11] 谢红旗,杨星星,曾建国.不同前处理方法对鲜葡萄枝蔓中茋类化合物的影响研究[J].中草药,2014,45(24):3553–3558.
[12] 赵春芳,余龙江,刘智,等.中国红豆杉中主要紫杉烷类物质的分布研究[J].林产化学与工业,2005,25(1):89–93.
[13] 刘智,余龙江,栗茂腾,等.紫杉醇及其前体在中国红豆杉植株中合成和积累部位探讨[J].华中农业大学学报,2006,25(3):313–317.
[14] 郑德勇.我国3种红豆杉各部位紫杉醇含量的比较[J].福建林学院学报,2003,23(2):160–163.
[15] 房耀欣,花奕蕾,田兴军.南方红豆杉紫杉醇含量的时空变异[J].中国农学通报,2015,31(13):19–22.
Content analysis on 6 kinds of taxanes in branches, leaves and fruits ofvar
Yang Xingxing 1, Wang Rencai1*, Zhang Jiayin3, Li Yanlin1, Qin Yu1, Xiong Xingyao1,2*
(1.College of Horticulture and Landscape, Hunan Agricultural University, Changsha 410128, China; 2.The Institute of Vegetables and Flowers Chinese Academy of Agricultural Sciences, Beijing 100081, China; 3.State Key Laboratory of Sub-health Intervention Technology, Changsha 410128, China)
The branches, leaves and fruits ofvarfrom Dawei mountain in Liuyang city were used as material, to establish a high performance liquid chromatograph (HPLC) method for simultaneous determination of 6 taxanes, namely, paclitaxel, cephalomannine (CE), 7– epi–10–deacetyl paclitaxel( 7–epi–10–DAT), 7–epi–paclitaxel, baccatin III and 10–deacetyl baccatin III (10–DAB). The result indicated that six kinds of taxanes were thoroughly separated within 35 min under the condition of using methanol-acetonitrile-water (volume rate of 25∶36∶39) as mobile phase throughisocratic elution and the detection wavelength of 227 nm. The contents of six taxanes in the branches, leaves and fruits ofvarwere differences, which the paclitaxel and 7– epi–10–deacetyl paclitaxel were the highest (866.47 、722.50 μg/g ) in embryo, the 10–deacetyl baccatin III, baccatin III and 7–epi–paclitaxel were the highest (301.20、234.08、11.74 μg/g ) in leaves, while the highest contents of cephalomannine was in branches (392.69 μg/g).
var.; branch leaves; fruit; paclitaxel; taxanes;high performance liquid chromatography (HPLC)
S791.49
A
1007-1032(2016)05-0549-05
2016–03–25
2016–08–30
国家国际科技合作项目(2013DFG32060);湖南农业大学青年科学基金项目(13QN14,15QN27)
杨星星(1987—),男,湖南邵阳人,博士研究生,主要从事天然产物开发与利用研究,youngstars@163.com;*通信作者,熊兴耀,主要从事天然产物开发与利用研究,教授,xiongxingyao@caas.cn;*通信作者,王仁才,教授,主要从事天然产物开发与利用研究,wangrenc@163.com
投稿网址:http://xb.ijournal.cn
责任编辑:尹小红
英文编辑:梁和
