花粉管通道法介导山葡萄VaCBF3基因转化杨树的初步研究
2016-10-27冯连荣王占斌尹杰宋立志彭儒胜赵鑫闻
冯连荣,王占斌,尹杰,宋立志,彭儒胜,赵鑫闻
花粉管通道法介导山葡萄基因转化杨树的初步研究
冯连荣1,2,王占斌1,尹杰2,宋立志2,彭儒胜2,赵鑫闻2
(1.东北林业大学林学院,黑龙江哈尔滨150040;2.辽宁省杨树研究所,辽宁盖州 115213)
以美洲黑杨‘D189’和辽宁杨为杂交亲本,利用花粉管通道法,经柱头滴注,将携带山葡萄()基因的质粒导入杨树中。结果显示:在杂交授粉后,经过目的基因导入,共获得了52株转化后代,经PCR检测,有5株扩增出目的条带,初步推断目的基因已导入到杨树中。本研究结果可为进一步利用花粉管通道培育抗寒杨树新品系提供参考。
山葡萄3基因;美洲黑杨‘D189’;辽宁杨;花粉管通道法;遗传转化
花粉管通道法(pollen-tube pathway)介导的基因转化属于种质转化系统中的一类,也称生物媒体转化系统,是在中国学者周光宇提出的“DNA片段杂交假设”基础上建立并逐渐发展起来的,其主要原理是利用植物授粉后柱头内形成的花粉管通道将外源总DNA或基因导入适当时期的胚囊,转化尚不具备正常细胞壁的卵、合子或早期胚胎细胞,从而达到遗传转化的目的。目前花粉管通道法已成功应用于水稻()[2–3]、棉花()[4–5]、小麦()[6–7]、玉米()[8–9]、大豆()[10–12]、核桃()[13]、甜瓜()[14]等,在杨树中的研究应用尚少。将和基因转化大青杨()和小黑杨(×),获得了阳性转化植株[15]。为选育耐盐白杨杂种无性系,以胡杨() DNA作为供体,用花粉管通道法将胡杨DNA导入到白杨中,经AFLP分析,检出了70株分子水平存在变异的株系[16]。用花粉管通道法将水曲柳()DNA导入到杨树,获得了具有水曲柳优势性状的杨树植株[17]。利用花粉管通道法对杨树转化抗寒调控基因的研究尚少见报道。CBF(CRT/DRE binding factor)转录因子是一类受低温诱导的反式作用因子,它可以与真核生物启动子中的CRT/DRE等顺式作用元件特异性结合,激活低温和脱水响应基因的表达,从而提高植物的抗逆性,在植物抗性育种中的应用越来越广泛。本研究在成功克隆基因启动子并构建由其驱动的基因植物表达载体的基础上[18],以美洲黑杨‘D189’和辽宁杨为杂交亲本,利用花粉管通道,将导入到杨树中,旨在为利用花粉管通道法培育杨树抗寒新品系提供技术支撑。
1 材料与方法
1.1材料
1.1.1植物材料和菌株
以辽宁杨(Bartr. el. ‘Lux’×Bartr. ‘Shanhaiguan’)为杂交母本,以美洲黑杨‘D189’(‘D189’)为杂交父本。父母本花枝于2014年2月中旬采于辽宁省盘锦市石新镇。选择花芽多而饱满的雄花枝和雌花枝作为试验材料。采集的花枝放入已消毒的地窖中保存(地窖温度不超过5 ℃),备用。
农杆菌()菌株为根癌农杆菌LBA4404。质粒载体(pROKⅡ–rd29–CBF3)携带具有抗寒性状的山葡萄()基因,基因全长854 bp。启动子为拟南芥基因,终止子为Nos,带有抗卡那霉素标记基因。质粒(图1)由东北林业大学林学院森林保护学科王占斌先生提供。

图1 pROKⅡ–rd29A–CBF3质粒图谱
1.1.2引物
用于扩增基因的引物序列为C1(5–ATG GAA TCG GAG CGA G–3)和C2(5–CTG TCA TCA GAA AGT G–3)。引物由宝生物工程(大连)有限公司合成。
1.2方法
1.2.1质粒DNA的提取及目的基因的检测
挑取携带有目的基因质粒的农杆菌单菌落接种于5 mL LB液体培养基中,28 ℃,200 r/min振荡培养过夜。取0.5 mL菌液接种至50 mL的LB液体培养基中继续振荡培养至菌液600 nm值为0.5。
利用OMEGA中量质粒提取试剂盒进行质粒提取,具体操作步骤按说明书进行。质粒溶于Elution Buffer中。利用紫外分光光度计分别测定质粒在波长260、280 nm处DNA的吸光率,然后计算DNA浓度(DNA浓度=260 nm×50×稀释倍数),DNA纯度用260 nm、280 nm的比值表示,并进行琼脂糖凝胶电泳检测质粒大小。
1.2.2质粒DNA的导入
用0.1%TE将提取的质粒DNA稀释至200 μg/mL(记为质粒Ⅰ),另外参照文献[19]制备200 μg/mL与0.001 mol/L CaCl2质粒DNA的混合液(记为质粒Ⅱ),–20 ℃保存,备用。
采用柱头滴注法[15]进行目的基因质粒的导入,导入时间分别为授粉后24、30、36、42、48、54、60、66、72 h。收集美洲黑杨‘D189’花粉,待辽宁杨雌花柱头分泌大量黏液达到最佳授粉时期时进行常规人工授粉。在授粉后按照时间设置进行外源DNA导入,用微量移液器吸取质粒Ⅰ溶液及质粒Ⅱ溶液对雌花花序进行处理。每朵花滴加5 μL DNA溶液,每处理1个花枝,约3~6个花序,以只做人工授粉、不滴加DNA溶液的处理作为阴性对照(CK),共计19个处理。
1.2.3转基因后代的管理
在雌花上滴注质粒后,将花枝继续水培,并适时换水,观察结实情况。待蒴果成熟后进行人工去絮和挑种,统计种子数量后及时将种子播种于营养钵中。播种前,对土壤进行高温消毒处理,播种出苗后,勤喷水,勤观察。对花序脱落但蒴果没完全开裂的部分采用组织培养法进行培养。具体培养方法:脱落的蒴果用70%的乙醇消毒3次,每次1 min;用0.1%氯化汞消毒2~3 min;用无菌水冲洗5次,每次1 min。灭菌后于无菌条件下剥开花序,将处理过的未成熟种子培养在MS培养基上,置于培养室内进行培养、炼苗、移栽。
1.2.4转基因后代的PCR检测
用天根快捷型植物DNA提取试剂盒提取转化植株与对照植株的叶片总DNA进行PCR扩增(以叶片总DNA为模板,以质粒DNA为阳性对照,以对照植株DNA为阴性对照,以无菌水为空白对照,C1、C2为引物)。反应程序为94 ℃预变性5 min,94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸45 s,72 ℃延伸10 min,4 ℃终止反应。反应结束后进行1%琼脂糖凝胶电泳检测。
2 结果与分析
2.1质粒DNA提取及目的基因检测的结果
将提取的质粒DNA样品稀释1 000倍,用紫外分光光度计测得其在波长260、280 nm处的吸光率分别为0.005、0.003,质粒DNA的浓度为250 μg/mL(将其稀释至200 μg/mL,备用)。质粒DNA纯度为1.67,表明样品纯度较好,杂质较少。经1%琼脂糖凝胶电泳检测(图2),结果表明,质粒条带清晰,片段大小与目的基因质粒的大小一致,可以满足试验需要。以质粒DNA为模板进行PCR扩增,扩增出片段的大小与目的基因的大小相同,长度约850 bp(图3)。

M DL15 000 DNA Marker;1,2 质粒。
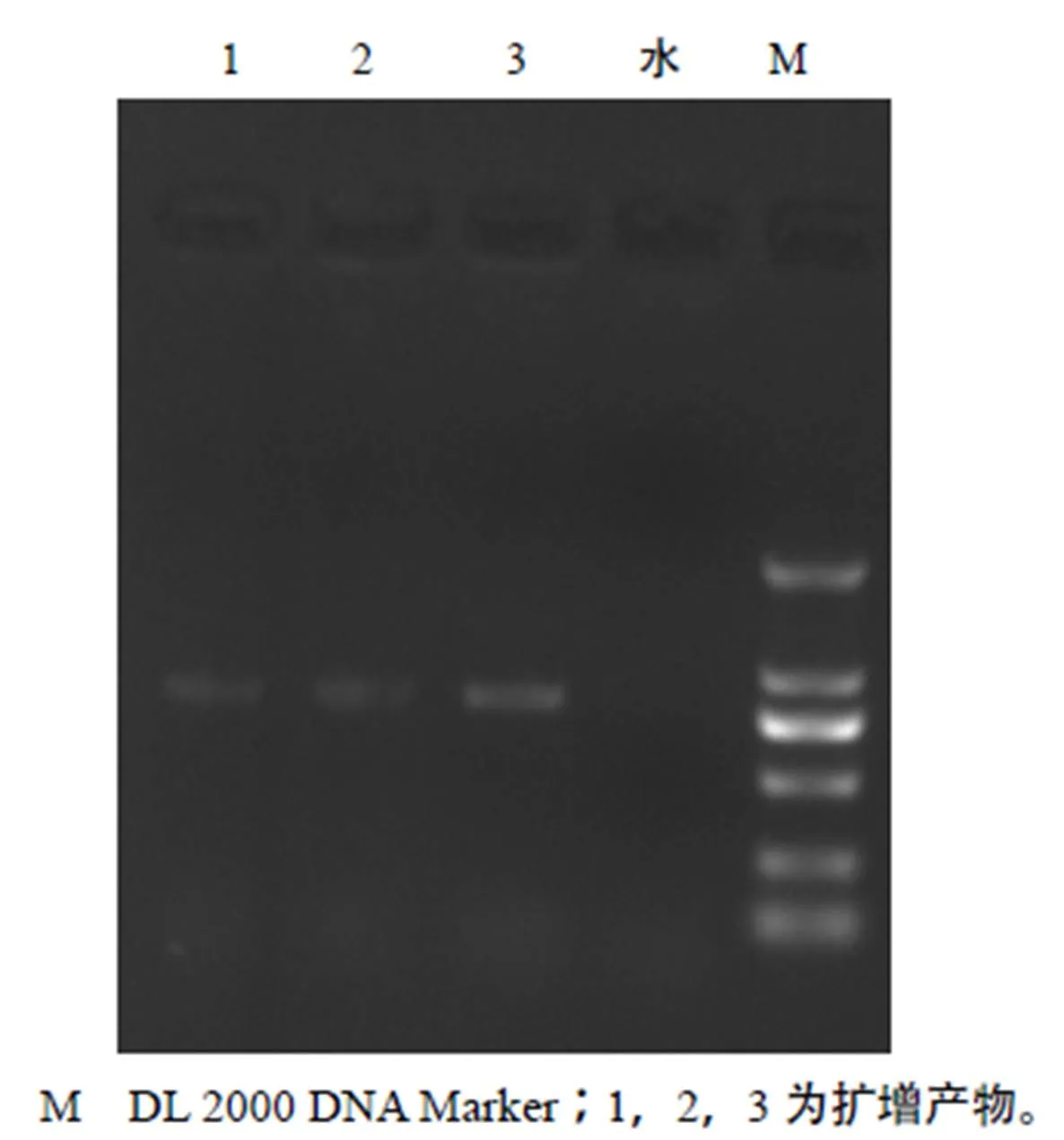
M DL 2000 DNA Marker;1,2,3为扩增产物。
2.2花粉管通道遗传转化结果
由表1可见,共转化雌花序97个,结实收获76个,结实率为78%。采用组培法进行人工去絮接种,将15个处理近成熟时脱落的42个蒴果接种至MS培养基中,待种子发芽、出苗、生根、炼苗后移栽至营养钵中,其雌雄花枝及获得的转化苗见图4。共收获种子4 157粒,存苗52株。

表1 各处理试验结果
2.3转化植株与对照植株的PCR检测结果
提取的叶片总DNA经1%琼脂糖凝胶检测(图5),DNA条带清晰,无杂质,无降解,质量较好,可以作为PCR反应的模板用于后续PCR检测。

1,2,3,…,6为待测植株叶片总DNA。
反应结束后,取6 µL反应产物用0.8 %琼脂糖凝胶电泳进行检测(图6),在检测的52株转化植株中,有5株扩增出的条带与预期片段吻合,初步表明目的基因质粒导入成功,分别为授粉后54 h滴加目的基因质粒处理(处理6)获得转化植株1株,授粉后54 h滴加目的基因质粒和CaCl2混合液处理(处理15),获得转化植株4株。
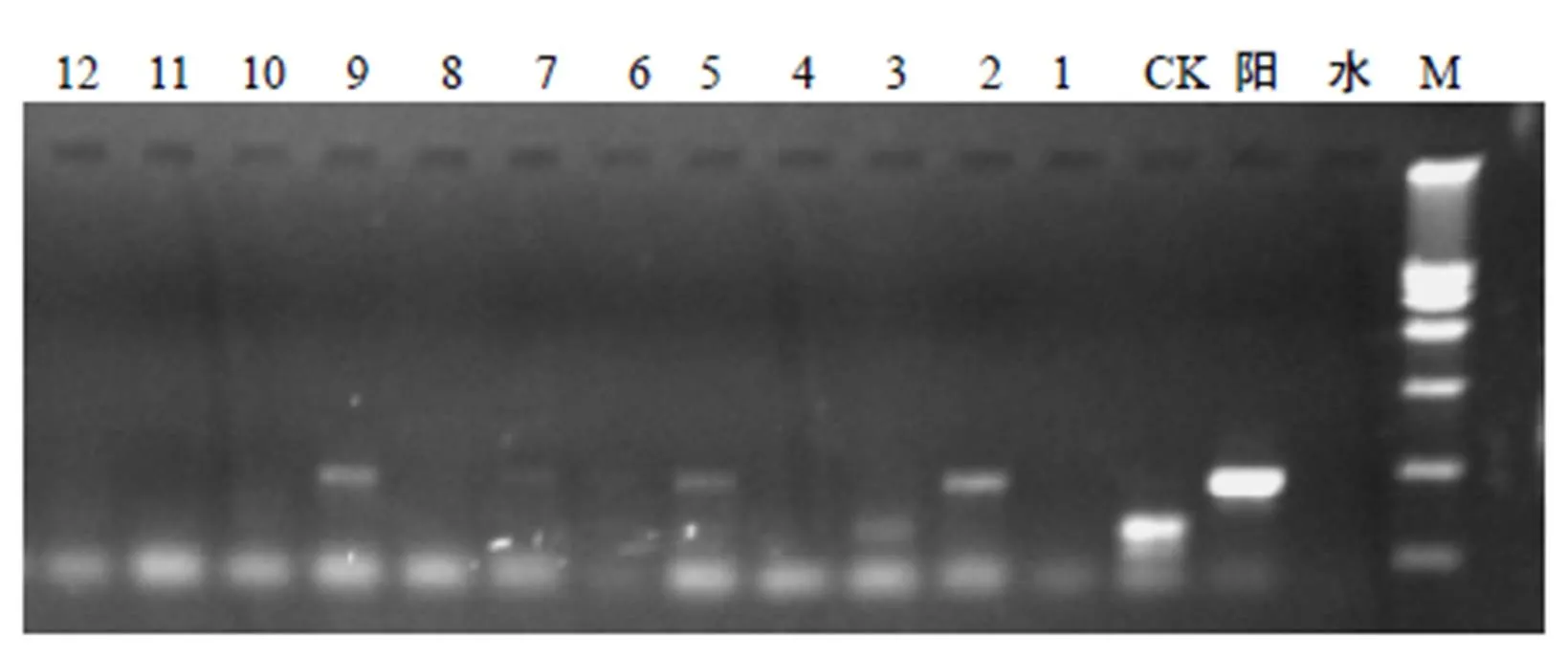
M DL 15 000 DNA Marker;阳 质粒对照;水 水对照;CK 阴性对照;1,2,3,…,12为待测植株。
3 结论与讨论
采用花粉管通道法对杨树进行遗传转化,是将分子生物学技术直接应用于杨树常规育种,并辅助常规育种的有效方法之一,同时也是杨树创新种质、拓宽基因库的一种新途径。与农杆菌介导法、基因枪法等遗传转化方法相比,花粉管通道法操作简便,不受地点限制,可以在大田、盆栽或在温室中进行,省去了细胞、原生质体等组织培养和诱导植株再生等人工培养过程[1],可直接获得大量种子,后代群体遗传多样性丰富,选择余地大,其应用前景十分广阔。花粉管通道法介导的遗传转化受很多因素影响,受体植物受精过程及导入时间是关键因素[1],水稻自花授粉一般在1 h内花粉管伸进胚囊,2 h左右完成双受精,3~6 h初生胚乳和合子先后开始分裂,此时是接受外源DNA的敏感时期[1]。刺梨(Tratt)花粉管通道从人工授粉后10 h左右开始萌发,到18 h左右完成萌发,2~9 h是其转化的最佳时期[20]。核桃(L.)花粉管通道导入外源基因时DNA的导入时间因导入方法不同而不同,采用柱头滴加处理的适宜时间为授粉后14~20 h,此时花粉管通道打开;DNA子房注射处理的适宜时间为授粉后24 h,此时花粉管进入子房内部[21]。本研究中的杂交母本为辽宁杨。对辽宁杨受精过程的荧光显微观察表明,授粉后16 h花粉管通道形成(另文发表),易于接受外源DNA。本研究中虽然设置了不同的导入时间,但由于苗木保存率低,无法得出外源DNA的最佳导入时间。
细胞外Ca2+是花粉萌发和花粉管生长的重要信号,Ca2+在花粉萌发及花粉管伸长过程中具有重要作用[19]。微量的CaCl2可使大豆花粉管通道转化效率提高3倍[19]。本研究中参考文献[19]中CaCl2的使用浓度,配制微量CaCl2与质粒的混合液,进行外源基因导入,最后获得的5株阳性植株中有4株导入的是CaCl2与质粒的混合液,但该数据不能直接说明CaCl2有助于提高转化效率,CaCl2在杨树花粉管通道导入外源基因中的作用还待研究。
DNA分子结构及其片段大小、DNA导入液浓度、pH值等也是影响花粉管通道法转化率的重要因素[1]。本研究中利用花粉管通道法实现了基因对杨树的转化,获得了大量的种子,有5株PCR检测呈阳性,扩增出了目的条带,可初步推断外源基因已经整合到杨树基因组中。本研究只对花粉管通道法转化杨树进行了初步探索,对于最佳导入时间、最佳质粒DNA的浓度等还有待研究。笔者将对这些阳性转基因植株进行RNA水平检测及抗寒生理指标测试,以期得到抗寒性较强的杨树新品系,提高杨树在高纬度地区的适应性,扩大杨树栽培区域。
参考文献:
[1] 王关林,方宏筠.植物基因工程[M].2版.北京:科学出版社,2002.
[2] Luo Z X,Wu R.A simple method for the transformation of rice via the Pollen-Tube Pathway[J].Plant Molecular Biology Reporter,1989,7(3):240–240.DOI:10.1007/ bf02668692.
[3] 洪亚辉,董延瑜,赵燕,等.密穗高粱总DNA导入水稻的研究[J].湖南农业大学学报(自然科学版),1999,25(2):87–91.DOI:10.3321/j.issn:1007–1032.1999.02.001.
[4] 王芙蓉,张传云,刘国栋,等.利用花粉管通道技术创造棉花变异种质及其SSR标记分析[J].山东农业科学,2006,38(1):10–12.DOI:10.3969/j.issn.1001–4942. 2006.01.003.
[5] 马盾,黄乐平,黄全生,等.提高棉花花粉管通道法转化率的研究[J].西北农业学报,2005,14(1):10–12. DOI:10.3969/j.issn.1004–1389.2005.01.003.
[6] 王广金,李忠杰,张晓东,等.利用花粉管通道法将编码优质HMW–GS基因导入小麦进行品质改良的研究[J].黑龙江农业科学,2002(6):1–4.DOI:10.3969/j. issn.1002–2767.2002.06.001.
[7] 张立,王建锋,王晓杰,等.花粉管通道法介导小麦抗病相关基因的转化和抗锈性鉴定[J].麦类作物学报,2013,33(1):29–33.
[8] 王罡,张艳贞,魏松红,等.花粉管通道法将毒蛋白基因导入优良玉米自交系[J].吉林农业大学学报,2002,24(4):40–44.DOI:10.3969/j.issn.1000–5684.2002. 04.010.
[9] 董春林,张明义,林忠平,等.用花粉管通道法将抗旱耐盐基因导入玉米自交系的研究[J].山西农业科学,2011,39(5):392–394.DOI:10.3969/j.issn.1002–2481. 2011.05.02.
[10] 刘昭军,李铁,刘丽艳,等.花粉管通道介导的抗除草剂基因()对大豆的遗传转化[J].大豆科学,2007,26(3):310–314.DOI:10.3969/j.issn.1000–9841.2007. 03.004.
[11] 李文霞,李文滨,宁海龙,等.大豆花粉管通道法转化基因[J].大豆科学,2007,26(5):653–656.DOI: 10.3969/j.issn.1000–9841.2007.05.003.
[12] 武小霞,刘伟婷,刘琦,等.利用花粉管通道法将抗虫基因()转入大豆的研究[J].大豆科学,2010,29(4):565–568,574.
[13] 师校欣,杜国强,王晓蔓,等.花粉管通道法遗传转化核桃的研究[J].园艺学报,2012,39(7):1243–1252.
[14] 哈斯阿古拉,牛一丁,张丽,等.花粉管通道法转基因技术在甜瓜品种河套蜜瓜上的应用[J].内蒙古大学学报(自然科学版),2007,38(4):419–423.DOI:10.3969/ j.issn.1000–1638.2007.04.010.
[15] 张文元.和基因在杨树上的遗传转化及其功能的初步验证[D].北京:中国林业科学研究院,2006.
[16] 陈洪伟.白杨花粉管通道导入外源胡杨DNA技术研究[D].北京:北京林业大学,2008.
[17] 杜人杰,曲跃军,金虎,等.水曲柳DNA浓度及滴加时间对杨树花粉管通道法结实率的影响[J].安徽农业科学,2014,42(22):7323–7324,7326.DOI:10.3969/j. issn.0517–6611.2014.22.007.
[18] 冯连荣,王占斌,宋立志.2种启动子驱动下的基因植物表达载体构建[J].沈阳农业大学学报,2011,42(5):559–564.DOI:10.3969/j.issn.1000–1700.2011. 05.009.
[19] 李卉,武天龙.CaCl2诱导大豆花粉管通道农杆菌转基因研究[J].大豆科学,2007,26(1):55–59.
[20] 王唯薇,赵德刚.刺梨花粉管萌发的荧光显微观察[J].基因组学与应用生物学,2010,29(2):322–326.DOI: 10.3969/gab.029.000322.
[21] 师校欣,杜国强,王晓蔓,等.花粉管通道法遗传转化核桃的研究[J].园艺学报,2012,39(7):1243–1252.
Preliminary study on transgenic poplar mediated withgene fromby pollen-tube pathway approach
Feng Lianrong1,2, Wang Zhanbin1, Yin Jie2, Song Lizhi2, Peng Rusheng2, Zhao Xinwen2
(1.College of Forestry, Northeast Forestry University, Harbin 150040, China; 2.China Liaoning Provincial Institute of Poplar, Gaizhou, Liaoning 115213, China)
By taking crossing offspringof‘D189’ andBartr. el. ‘Lux’×Bartr ‘Shanhaiguan’ as parents, the plasmid carried with() was transferred into poplar through stigma-drop by Pollen-Tube Pathway approach. The results from PCR–analysis showed that 5 out of 52 transformed offspring were amplified in the form of target stripe, which indicated that the target gene had been integrated into poplar genome. The result could provide a clue for further research on new cold-resistance poplar via pollen-tube pathway approach.
gene;‘D189’;Bartr. el. ‘Lux’×Bartr. ‘Shanhaiguan’; Pollen-Tube Pathway; genetic transformation
S792.11;S722.3
A
1007-1032(2016)05-0500-05
2015–12–10
2016–04–06
辽宁省科学事业公益研究基因项目(2014002016)
冯连荣(1983—),女,黑龙江齐齐哈尔人,博士研究生,工程师,主要从事杨树转基因育种及病虫害防治研究,fenglianrong@ 163.com
投稿网址:http://xb.ijournal.cn
责任编辑:王赛群
英文编辑:王库
