莴苣叶斑病菌的分离鉴定及弱毒菌株致病力的衰退
2016-10-27潘显婷陆训庞茜丹高必达周倩
潘显婷,陆训,庞茜丹,高必达,周倩*
莴苣叶斑病菌的分离鉴定及弱毒菌株致病力的衰退
潘显婷1,2,陆训1,2,庞茜丹1,2,高必达1,2,周倩1,2*
(1.湖南农业大学植物保护学院,湖南长沙 410128;2.植物病虫害生物学与防控湖南省重点实验室,湖南长沙 410128)
利用组织分离法,从感染叶斑病的莴苣叶片上分离得到4株真菌,ITS序列分析鉴定为匍柄霉(spp)。科赫氏法则验证其致病性时发现,菌株WS–01较其他菌株致病力减弱,且生长缓慢。用纤维素吸附法提取菌株WS–01的dsRNA,发现WS–01含有3条1~5 kb的dsRNA条带,提示WS–01菌株内含有dsRNA病毒。利用高温–利巴韦林–尖端脱毒结合的方法消除WS–01内的病毒,所得菌株WS–01–D与菌株WS–01相比,致病性增强且表型恢复正常,提示弱毒菌株WS–01的致病力减弱与其所含dsRNA有关。
匍柄霉属病菌;弱毒菌株;dsRNA病毒;病毒消除
匍柄霉属(Wallroth)真菌寄主广泛,可引起多种作物病害[1–5]。防治匍柄霉叶斑病主要采用化学方法,杀菌剂多为甲霜·锰锌、代森锰锌、福星等,但效果普遍较差[6–7]。长期持续使用化学农药易造成环境污染,并且极易导致病菌形成抗药性。
真菌病毒是侵染真菌并在真菌中复制的病毒,广泛存在于包括植物病原真菌在内的各种真菌中[8–9]。目前,报道的真菌病毒主要分为dsRNA和+ssRNA病毒[10–11]。大部分真菌病毒对寄主表现为潜伏侵染,但有小部分真菌病毒引起寄主的不正常表型。弱毒相关真菌病毒被认为是一种潜在的生防因子,可以用来防治植物真菌性病害[12–14]。
笔者从感染叶斑病的莴苣叶片上分离得到4株真菌(WS–01、WS–02、WS–03、WS–04),ITS序列分析鉴定为匍柄霉。菌株WS–01在PDA培养基上较其他3株匍柄霉生长缓慢,科赫氏法则验证其致病性时也发现,接种莴苣叶片后,WS–01致病力较其他菌株弱。用纤维素吸附法提取菌株WS–01的dsRNA,发现其含有3条1~5 kb的dsRNA条带。通过病毒消除和弱毒菌株与脱毒菌株的生物学比较,发现菌株WS–01的不正常表型与所含dsRNAs有关。现将结果报道如下。
1 材料与方法
1.1材料
从湖南农业大学蔬菜基地采集的具有典型叶斑病发病症状的莴苣叶片。
1.2方法
1.2.1病原菌的分离鉴定与致病力测定
用组织分离法,取叶片病健交界处组织,培养并分离获得病原菌。用打孔器打取菌饼(直径4 mm)对健康莴苣叶片进行无伤接种,3 d后观察接种处是否出现叶斑病症状。
采用CTAB法[15]提取菌株DNA,利用通用引物ITS4(5–TCCTCCGCTTATTGATATGC–3)和ITS5 (5–GGAAGTAAAAGTCGTAACAAGG–3)进行PCR扩增。反应体系25 μL:dNTPs (10 mmol/L) 0.5 μL,10×Buffer 2.5 μL,酶(2.5 U/μL) 0.5 μL,引物(10 μmol/μL ) ITS4和ITS5各1 μL,模板DNA 2 μL,补足ddH2O使体系达到25 μL。扩增程序:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火 30 s,72 ℃延伸 30 s,34个循环;最后72 ℃10 min补平片段。PCR产物采用1 %琼脂凝胶电泳检测,送铂尚生物技术公司进行测序,测序结果在NCBI数据库中进行BLAST比对,并通过MEGA5软件用邻接法构建系统发育树。
1.2.2弱毒菌株毒力分析
1) 弱毒菌株dsRNA的提取。将弱毒菌株接于PD培养基,在28 ℃恒温摇床培养4 d。将培养好的菌丝体用灭菌纱布过滤,收集菌丝,并用灭菌滤纸吸干水分。参照Morris T J和Dodds J A方法[16]进行dsRNA的提取。
粗提dsRNA采用DNase I和S1核酸酶去除DNA和ssRNA后,1%琼脂凝胶电泳,凝胶成像仪观察电泳结果。
2) dsRNA的消除。将弱毒菌株转接到含有利巴韦林的PDA培养基,33 ℃培养7 d后,挑取菌丝尖端转接到同样含有利巴韦林的培养基中,连续转接4代后,用PD培养基培养菌丝,用于dsRNA的提取验证。
3) 脱毒菌株与弱毒菌株的生物学特性比较。将弱毒菌株与其脱毒菌株接于PDA平板,28 ℃恒温培养7 d后,观察菌落形态,并在显微镜下观察菌丝形态。
打取菌饼(直径4 mm)接于PDA平板,28 ℃恒温培养,3 d后每间隔24 h采用十字交叉法测定记录1次菌落直径,每个菌株3次重复。
采用离体叶片接种法,在PDA平板上活化5 d的菌落边缘,分别打取直径为4 mm菌丝块,对莴苣叶片进行无伤接种,每个菌株重复4次,以空白琼脂块作对照,置 28 ℃保湿培养3 d后观察发病情况。
2 结果与分析
2.1 莴苣叶斑病病原菌的生物学特性
通过组织分离法,从感染叶斑病的莴苣叶片上得到4个纯培养的菌株,编号为WS–01、WS–02、 WS–03、WS–04。在PDA培养基上,菌落呈匍匐状,产生色素。到第7天时,菌株WS–02、 WS–03、 WS–04的菌丝基本可铺满整个培养皿(直径7 cm),但菌株WS–01生长较慢(2.8 cm)(图1)。将4个菌株分别接种于健康莴苣叶片,3 d后,WS–02、WS–03、WS–04菌株接种的叶片初现病斑,5 d时在离体的莴苣叶片上形成典型褐色圆形病斑,病斑周围有黄色晕圈,但接种WS–01的此时才初现病斑(图2)。

图1 培养7 d的菌落在PDA培养基上的形态

图2 离体接种后5 d莴苣叶片的感病结果
用真菌rDNA 基因通用ITS4和ITS5引物对4个菌株基因组DNA进行PCR扩增,得到600 bp左右的扩增产物。测序结果在NCBI数据库中进行BLAST比对后构建系统发育树(图3)。结果显示,莴苣上分离的病原菌WS–01、WS–02、WS–03、WS–04与、、单独处于一个分支上,聚为一类。rDNA– ITS序列分析确定4个菌株均为匍柄霉(spp),但尚无法鉴定到种。
图3系统发育树
Fig.3Phylogenetic tree
2.2弱毒菌株的特性
对弱致病力菌株WS–01,采用纤维素CF11吸附法进行dsRNA提取,提取物经过DNase I和S1 Nuclease去除DNA和ssRNA后进行琼脂糖凝胶电泳,结果显示该菌株内含有大小为1~5 kb的dsRNAs(图4)。

图4 菌株WS–01的dsRNA电泳图谱
菌株WS–01采用高温–利巴韦林–尖端消除方法进行平板转接,4代后用纤维素吸附法提取dsRNA,1%琼脂糖凝胶电泳检测发现,第4代完全消除,命名为WS–01–D(图5)。
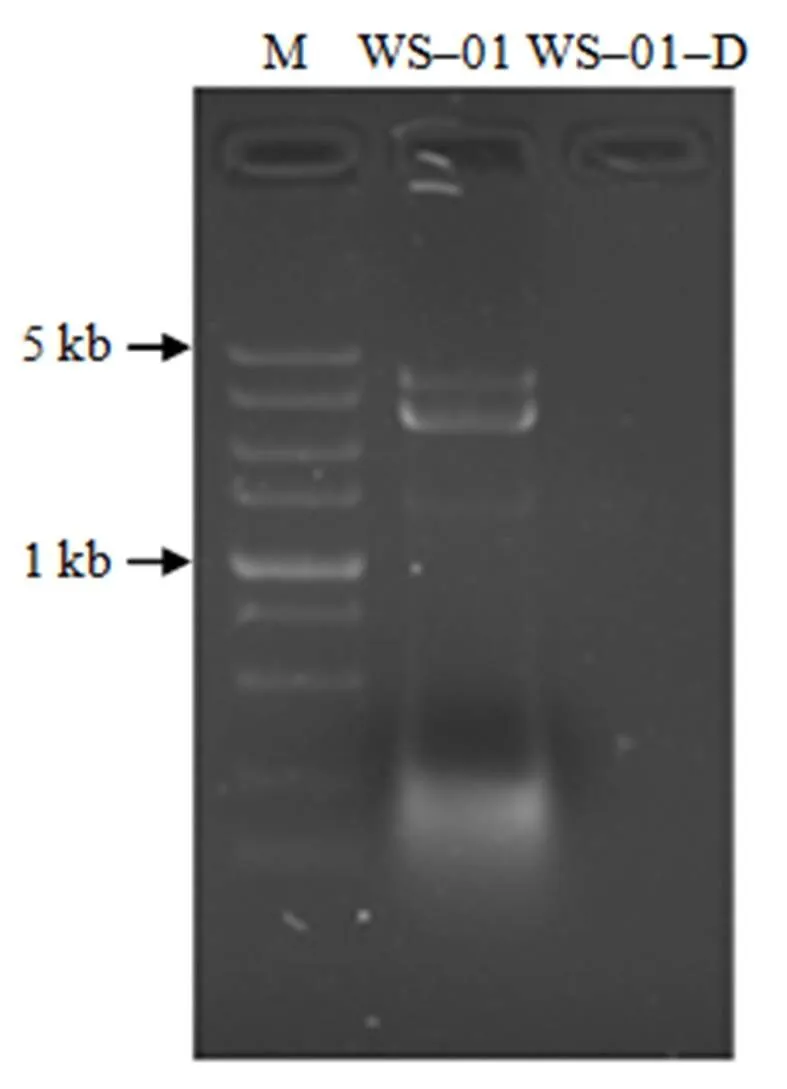
图5 WS–01–D内的dsRNA的电泳图谱
将弱毒菌株WS–01及脱毒菌株WS–01–D分别接种于PDA平板,置于28 ℃恒温培养,7 d后观察菌落及菌丝形态,结果(图6)显示,WS–01–D菌落边缘规则化,生长速度较快,7 d即可基本扩展到整个培养皿。WS–01菌丝内部囊泡较多。

图6 WS–01和WS–01–D的菌落及菌丝形态
比较WS–01和WS–01–D的生长速度发现,生长速度分别为0.55 cm/d及1.09 cm/d,WS–01–D生长速度明显快于WS–01。
观察接种莴苣叶片发现,接种WS–01基本不发病,而接种WS–01–D可产生较大病斑,致病性明显增强,接种3 d时开始形成黄褐色病斑,5 d时病斑直径达到1.4 cm左右(图7),由此推测WS–01可引起致病力减弱。

图7 WS–01和WS–01–D的致病力
3 结论与讨论
匍柄霉叶斑病已经成为近年来新发生及流行的一种病害[17],笔者对感染叶斑病的莴苣叶进行了病原菌的分离纯化,得到4个纯培养菌株WS–01、WS–02、WS–03、WS–04,ITS序列系统进化树分析的结果表明,这些菌株均为匍柄霉(spp.。匍柄霉在形态学鉴定中,多根据分生孢子的长宽比对匍柄霉属真菌相似种进行区分[7],但是在培养中并未发现孢子,曾经采取一系列诱导真菌产孢的方法,都未能得到孢子,因此暂未能鉴定到种。在对菌株进行纯化培养和致病力测定时发现,菌株WS–01与菌株WS–02、WS–03、WS–04相比,生长速度较慢,致病力较弱。
弱毒相关真菌病毒可引起寄主生长速度变慢,致病力减弱。笔者推测菌株WS–01的弱毒现象与真菌病毒有关,因此采用纤维素吸附提取法对菌株WS–01进行dsRNA提取,发现其确实含有病毒。
通过高温–利巴韦林–尖端方法进行病毒消除,得到脱毒菌株WS–01–D,并比较了脱毒菌株和弱毒菌株在菌落形态、菌丝形态、菌丝生长速度和致病力方面的差异。结果表明,病毒的存在可以改变寄主的菌落和菌丝形态及生长速度,甚至引起弱毒现象。真菌病毒引起低毒力的现象有不少报道,原因不尽相同,病毒降低莴苣匍柄霉菌株WS–01致病力的作用机制需要进一步研究。
参考文献:
[1] 薛峰.暗色丝孢真菌细基格孢属()、匍柄霉属()及链格孢属()的分类和分子系统学研究[D].泰安:山东农业大学,2005.
[2] 张天宇.中国真菌志:第三十一卷[M].北京:科学出版社,2009:158–177.
[3] Zhou Y F,Shi Y X,Xie X W,et al.Leaf spot of spinach caused bysp.nov[J]. Mycosystema,2011,30(3):379–383.
[4] 周艳芳,郭英兰,李宝聚.落葵上匍柄霉一新种[J].菌物学报,2012,31(2):165–167.
[5] Chai A L ,Du G F,Shi Y X,et al.Leaf spot on sweet potato() caused by,a new disease in China[J].Journal Phytopathology,2015,163:1046–1049.
[6] 李玉中,杨芳,刘春,等.衡阳地区莴笋叶斑病病原菌的鉴定及其室内药剂筛选[J].江苏农业科学,2014,42(2):102–104.
[7] 郑露.大蒜白斑病病原学、防治技术及其毒素致病病理研究[D].武汉:华中农业大学,2010.
[8] Ghabrial S A,Suzuki N.Viruses of plant pathogenic fungi[J].Annu Rev Phytopathol,2009,47:353–384.
[9] Xie J,Wei D,Jiang D,et al.Characteriation of debilitation-associated mycovirus infecting the plant pathogenic fungus[J].J Gen Virol,2006,87:241–249.
[10] Liu L,Xie J,Cheng J,et al.Fungal negative-stranded RNA virus that is related to bornaviruses and nyaviruses[J].PNAS,2014,111(33):12205–12210.
[11] Yu Xiao,Li Bo.Age minivirus-related DNA mycovirus that confers hypovirulenceto a plant pathogenic fungus[J].PNAS,2010(4):8387–8392.
[12] Nuss D L.Hypovirulence:mycoviruses at the fungal- plant interface[J].Nat Rev Microbiol,2005(3):632– 642.
[13] 邓小军,李桂芳,魏颖,等.油菜菌核病菌致病性分化及弱毒现象[J].湖南农业大学学报(自然科学版),2016,42(3):317–321.
[14] Yu X,Li B,Fu Y,et al.Extracellular transmission of a DNA mycovirus and its use as a natural fungicide[J]. PNAS,2013,110:1452–1457.
[15] Roberts R G.sp.nov.on Ya Li pear fruit:From interception to identification[J].Plant Disease,2005,89 (2):134–145.
[16] Morris T J,Dodds J A.Isolation and analysis of double stranded RNA from virus-infected plant and fungal tissue[J].Phytopathology,1979,69:854–858.
[17] 杜公福,周艳芳,石延霞,等.海南省冬季北运蔬菜匍柄霉叶斑病病原的鉴定[J].植物保护,2013,39(2):122–127.
Isolation of the pathogens causing leaf spot of lettuce and analysis of the reason causing the attenuated virulence
Pan Xianting1,2, Lu Xun1,2, Pang Xidan1,2, Gao Bida1,2,Zhou Qian1,2*
(1.College of Plant Protection, Hunan Agricultural University, Changsha 410128, China; 2.Hunan Provincial Key Laboratory for Biology and Control of Plant Diseases and Insect Pests, Changsha 410128, China)
Fourstrains were isolated from lettuce with leaf spot disease by tissue isolation method and identified asspp. with ITS sequences analysis. An attenuated strain with debilitated pathogenicity and slower growth rate named WS–01 was found by artifical inoculation. The cellulose CF11 method was used to extract dsRNA to determine the relation between the debilitated pathogenicity and its dsRNA mycovirus, three dsRNAs ranged from 1 kb to 5 kb were detected in the WS–01 strain. High temperature-ribavirin-hyphal tip isolation method for elimination of virus was conducted. The results showed that the pathogenicity of mycovirus-eliminated strain WS–01–D was enhanced and the phenotype returned to normal compared to the original strain, indicating the abnormal phenotype of strain WS–01 was related to its dsRNA.
.; attenuated strain; dsRNA mycovirus; virus elimination
S436.36
A
1007-1032(2016)05-0538-05
2016–03–30
2016–04–13
湖南省大学生科技创新项目(XCX16080)
潘显婷(1991—),女,湖南邵阳人,硕士研究生,主要从事植物病理学研究,541879123@qq.com;*通信作者,周倩,博士,副教授,主要从事植物病理学研究,zhouqian2617@hunau.edu.cn
投稿网址:http://xb.ijournal.cn
责任编辑:罗慧敏
英文编辑:罗维
