黄杞叶总黄酮的提取纯化工艺优化及3种有效成分的含量测定Δ
2016-10-26郑义静周福军王红敏侯文彬天津医科大学研究生院天津300070天津药物研究院天津300193天津市中药质量控制技术工程实验室天津300193天津中医药大学研究生院天津300193
郑义静,单 淇,周福军,华 洁,王红敏,侯文彬#(1.天津医科大学研究生院,天津 300070;2.天津药物研究院,天津 300193;3.天津市中药质量控制技术工程实验室,天津 300193;.天津中医药大学研究生院,天津 300193)
黄杞叶总黄酮的提取纯化工艺优化及3种有效成分的含量测定Δ
郑义静1*,单 淇2,3,周福军2,3,华 洁2,3,王红敏4,侯文彬2,3#(1.天津医科大学研究生院,天津 300070;2.天津药物研究院,天津 300193;3.天津市中药质量控制技术工程实验室,天津 300193;4.天津中医药大学研究生院,天津 300193)
目的:优化黄杞叶总黄酮的提取与纯化工艺,并建立其中3种有效成分的含量测定方法。方法:以落新妇苷的提取转移率为指标,采用单因素试验对提取工艺中的提取溶剂、提取方式、渗漉溶剂乙醇的体积分数、渗漉料液比、渗漉前浸泡时间、渗漉速度和AB-8树脂纯化工艺中洗脱剂乙醇的体积分数进行考察,并采用正交试验优化提取工艺。采用高效液相色谱法对纯化后黄杞叶总黄酮中3种有效成分(落新妇苷、花旗松素、黄杞苷)进行含量测定。结果:优化后的黄杞总黄酮的提取工艺为以70%乙醇体积为提取和渗漉溶剂,采用渗漉法提取,渗漉前浸泡8 h,渗漉料液比1∶16(g/ml),渗漉速度30 ml/(min·kg);纯化工艺为取渗漉液加水稀释至0.5 g(生药)/ml,乙酸乙酯萃取,萃取液蒸干后以50%乙醇溶解,AB-8树脂上样,50%乙醇洗脱,浓缩、干燥;验证试验中落新妇苷提取转移率>80%(RSD=0.42%,n=3)。纯化后黄杞叶总黄酮中落新妇苷、花旗松素、黄杞苷的含量分别为57.94%、3.72%、2.83%,三者含量之和占总黄酮的64.00%。结论:建立的提取和纯化工艺稳定、合理、可靠;黄杞叶总黄酮中3种有效成分的含量测定方法准确、简单、重复性好。
黄杞叶;总黄酮;提取工艺;纯化工艺;正交试验;AB-8树脂;落新妇苷;花旗松素;黄杞苷;含量测定
黄杞叶为胡桃科黄杞属植物黄杞(Engelhardia roxburghi- ana Wall)的干燥叶,主要分布在广东、广西、云南、福建等地,资源丰富。在广西等地,黄杞叶又被称为罗汉茶,具有清热解毒、生津止渴、解暑胜湿的功效,可以消除暑热口渴、食滞、腹痛[1-3]。孙彤等[4]分离并鉴定了来源于广西的黄杞叶中的13个黄酮类化合物。落新妇苷、花旗松素和黄杞苷等二氢黄酮是黄杞叶中的主要活性成分[5],其中,尤以落新妇苷的含量非常高[6]。现代研究表明,落新妇苷能够降低胆固醇[7],保护肝脏以及具有镇痛、抗水肿作用[8];此外,落新妇苷还具有选择性免疫抑制等多种生物活性作用[9]。花旗松素为落新妇苷的苷元,具有抗癌、抗炎、抗病毒[10]等作用;黄杞苷为二氢黄酮醇类化合物,有较强的抗氧化活性[11]。为更合理地利用黄杞叶资源,本试验以落新妇苷为指标成分,对黄杞叶中总黄酮的提取工艺进行了研究;并以落新妇苷、花旗松素、黄杞苷为有效成分,对黄杞叶总黄酮的质量控制方法进行了研究。
1 材料
1.1 仪器
Agilent-1260高效液相色谱(HPLC)仪,包括四通道梯度泵、自动进样器、柱温箱、二极管阵列检测器(美国Agilent公司);BP211D分析天平(德国Sartorius公司);SB-3200DTN超声波清洗机(宁波新芝生物科技有限公司);DZF-6050真空干燥箱(巩义市予华仪器有限责任公司)。
1.2 药材、药品、试剂与树脂
黄杞叶产地为广西[采摘日期:2014年10月,经天津药物研究院中药部侯文彬研究员鉴定为胡桃科植物黄杞(Engelhardia roxburghiana Wall)的干燥叶];落新妇苷对照品(批号:111798-201303,纯度:92.4%)、黄杞苷对照品(批号:111906-201102,纯度:93.7%)、花旗松素对照品(批号:111816-201102,纯度:98.9%)均来源于中国食品药品检定研究院;磷酸、甲醇、乙醇(95%)均为分析纯;水为纯净水(杭州娃哈哈集团有限公司)。
AB-8大孔吸附树脂(南开大学化工厂)。
2 方法与结果
2.1 药材中落新妇苷的含量测定
2.1.1 色谱条件 参考2015年版《中国药典》(一部)[12]土茯苓中落新妇苷的含量测定方法和文献[3,13]方法,并对其进行优化,最终确定以下色谱条件:色谱柱为Acchrom Unitary C1(8250 mm×4.6 mm,5 μm);流动相为甲醇(A)-0.1%甲酸水(B),梯度洗脱(0~35 min,33%A;35~50 min,33%~40%A;50~65 min,40%~50%A;65~75 min,50%~70%A;75~80 min,70%~90%A;80~90 min,100%A;90.1~100 min,33% A);流速为1.0 ml/min;检测波长为290 nm;进样量为10 μl;柱温为30 ℃ 。
2.1.2 对照品溶液的制备 取落新妇苷对照品适量,精密称定,用60%甲醇充分溶解并定容至50 ml,即得0.039 6 mg/ml落新妇苷对照品溶液。
2.1.3 供试品溶液的制备 取2份黄杞叶粗粉250 mg,精密称定,置于100 ml三角瓶中,加入60%甲醇50 ml,精密称定,超声60 min(180 W,40 kHz,30 ℃),再用60%甲醇补足减失的质量,摇匀,滤过,取续滤液,稀释10倍即得。
2.1.4 落新妇苷的含量测定 方法学考察内容见“2.4.2”项。经测定,药材中落新妇苷的含量为8.06%。
2.2 总黄酮提取工艺
2.2.1 提取溶剂选择 称取10份黄杞叶粉末,每份2.5 g,每2份药材为1组,各组药材分别以50 ml水和30%、50%、70%、95%乙醇超声提取1 h。提取液稀释100倍,进样测定,根据药材中落新妇苷的含量计算提取转移率(药材提取溶液中落新妇苷的含量×提取溶液体积/药材中应含落新妇苷的量×药材质量×100%)。结果,以水和30%、50%、70%、95%乙醇为溶剂的提取转移率依次为53.7%、83.9%、88.9%、95.8%、75.6%(以落新妇苷计,n=2)。据此确定以70%乙醇为提取溶剂进行进一步考察。
2.2.2 提取方法选择 称取6份黄杞叶粉末,每份100 g,每2份药材为1组,各组药材分别以冷浸、回流和渗漉方式进行提取。冷浸组以70%乙醇浸泡药材24 h;回流组以1 000 ml 70%乙醇回流提取,连续提取2次;渗漉组以70%乙醇渗漉提取,渗漉速度控制在10 ml/(min·kg)(kg为药材量)。每份药材的提取总溶剂量均为2 000 ml,提取液稀释100倍后进样检测,根据药材中落新妇苷的含量,计算提取转移率。结果,冷浸、回流、渗漉3种提取方式的平均提取转移率分别为70.1%、87.9%、95.3%(n=2),以渗漉提取的转移率最高。因此选择渗漉法提取黄杞叶中的落新妇苷。
2.2.3 渗漉溶剂选择 称取6份黄杞叶粉末,每份100 g,每2份药材为1组,各组药材分别以60%、70%、80%乙醇浸泡8 h后进行渗漉提取。每份药材的提取总溶剂量均为2 000 ml,提取液稀释100倍后进样检测,根据药材中落新妇苷的含量,计算提取转移率。结果,60%、70%、80%乙醇的平均提取转移率分别为93.9%、95.5%、90.1%(n=2)。故确定以70%乙醇为渗漉溶剂。
2.2.4 料液比选择 称取5份黄杞叶粉末,每份100 g,以药材量5、10、15、20、25倍(即料液比为1∶5、1∶10、1∶15、1∶20、1∶25,g/ml)体积的70%乙醇浸泡8 h后,进行渗漉提取,渗漉速度为30 ml/(min·kg),计算落新妇苷的提取转移率。结果,各倍量下提取转移率分别为75.2%、97.7%、98.5%、98.7%、94.5%。为节约溶剂,选取中间水平的料液比1∶8、1∶12、1∶16进行下一步考察。
2.2.5 浸泡时间选择 称取4份黄杞叶粉末,每份100 g,药材浸泡4、8、16、24 h后以药材量10倍体积(ml)的70%乙醇进行渗漉提取,渗漉速度为30 ml/(min·kg),计算落新妇苷的提取转移率,结果分别为80.0%、98.2%、98.5%、98.7%。为提高提取效率,选取浸泡时间为8、16、24 h进行下一步考察。
2.2.6 渗漉速度选择 称取3份黄杞叶粉末,每份100 g,药材浸泡8 h后以药材量10倍体积(ml)的70%乙醇进行渗漉提取,渗漉速度分别为10、30、50 ml/(min·kg),计算落新妇苷的提取转移率,结果分别为98.5%、98.1%、80.7%。选取渗漉速度为10、20、30 ml/(min·kg)进行下一步考察。
2.2.7 正交试验法优化渗漉条件 结合落新妇苷的提取转移率,确定提取料液比(A)为1∶8、1∶12、1∶16,浸泡时间(B)为8、16、24 h,渗漉速度(C)为10、20、30 ml/(min·kg)进行正交试验。因素与水平见表1。

表1 因素与水平Tab 1 Factors and levels
称取9份黄杞叶粉末,每份100 g,各份药材进行正交试验后取样检测,计算提取转移率。正交设计及试验结果、方差分析结果分别见表2、表3。
由表2、表3可知,因素A有显著性,考虑试验效率和操作的方便,优化的渗漉工艺确定为A3B1C3:渗漉前浸泡8 h,以药材量16倍的70%乙醇渗漉,渗漉速度控制在30 ml/(min·kg)。
称取3份黄杞叶粉末,每份100 g,各份药材按优化后的渗漉条件进行提取。结果落新妇苷的提取转移率分别为97.8%、98.0%、98.1%(RSD=0.16%,n=3),表明该渗漉提取工艺稳定、可靠。
2.3 总黄酮纯化工艺
2.3.1 萃取除杂 由于落新妇苷等二氢黄酮苷具有一定的脂溶性,故考虑采用有机溶剂萃取的方法来除去部分极性大的杂质。
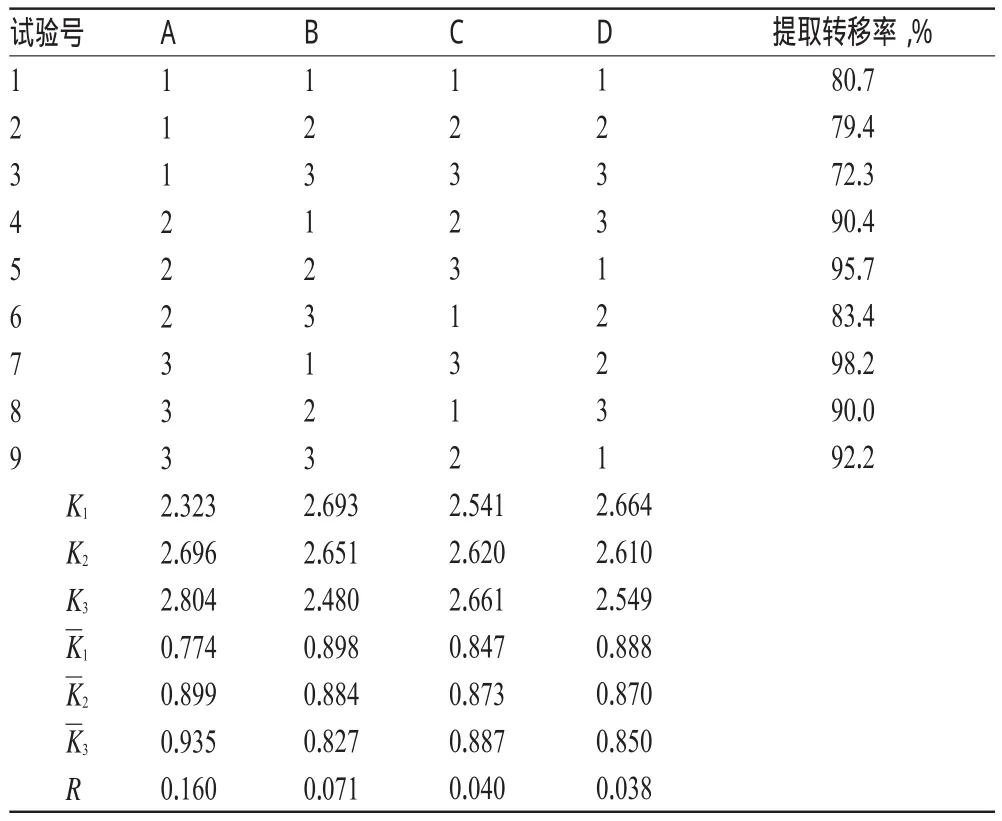
表2 正交试验设计与结果Tab 2 Orthogonal design and test results

表3 方差分析结果Tab 3 Analysis results of variance
将黄杞叶渗漉液(5 kg药材加入80 L渗漉液)浓缩至无醇味,再以水稀释至20 L[相当于0.25 g(生药)/ml]。加入同体积的乙酸乙酯萃取,50 ℃ 加热破乳分层,重复萃取2次,第3次无需加热。将3次萃取液合并蒸干,得干膏686.56 g(1 g干膏相当于7.28 g药材)。经检测得落新妇苷的含量由粗提物(未经除杂)的35%富集至48%,提取物色泽较深,仍有进一步纯化的必要。
2.3.2 萃取后再纯化 (1)树脂动态洗脱曲线的绘制。前期研究表明,大孔树脂对落新妇苷的吸附和解析性能较好。取AB-8大孔树脂40 ml(水中)装柱,以蒸馏水平衡。取黄杞叶萃取后干膏适量,用水溶解至落新妇苷质量浓度约10 mg/ml,将析出的沉淀过滤,滤液上样120 ml,再分别用水和10%、20%、30%、40%、50%、60%、70%、80%、90%的乙醇洗脱。色谱法检测洗脱液中的落新妇苷的质量浓度,以确定洗脱剂乙醇体积分数。AB-8大孔树脂的动态洗脱曲线见图1。

图1 动态洗脱曲线Fig 1 Dynamic elution curves
(2)树脂纯化 由动态洗脱曲线可知,当乙醇的体积分数为50%以上时落新妇苷的累积洗脱量几乎不再增大。因此,采用2.5倍柱体积(BV)的50%乙醇进行复溶上样(树脂量约为药材量的5倍,V/m),之后用50%乙醇洗脱,洗脱液与上样流出液合并蒸干,称质量。经测定并计算得落新妇苷含量为57.2%,总转移率(相对于药材)为84.3%。
萃取后再经树脂纯化所得的含落新妇苷的总黄酮中,落新妇苷的含量接近60%,颜色微黄。
2.3.3 验证试验 取100 g黄杞叶样品,按上述确定的提取纯化工艺制备3批黄杞叶总黄酮,测定落新妇苷总转移率,结果分别为85.1%、85.3%、85.8%(RSD<2%)。3批总转移率相近,表明该工艺稳定,可用于提取纯化黄杞叶中的总黄酮。
2.4 纯化后质量控制
2.4.1 含量测定 由于黄杞苷、花旗松素的紫外吸收特征与落新妇苷基本一致,因此可在同一波长(290 nm)按“2.1.1”项相同条件下对3个化合物进行测定。
(1)对照品溶液的制备。取落新妇苷、黄杞苷、花旗松素对照品适量,精密称定,加甲醇充分溶解制成含落新妇苷、黄杞苷、花旗松素质量浓度分别为0.579 0、0.177 2、0.135 2 mg/ml的对照品贮备液各25 ml;从中均分别精密量取0.2、0.5、1.0、1.5、2.0、2.5 ml,以甲醇稀释定容至10 ml,制成各对照品的浓度梯度溶液。(2)供试品溶液的制备。称取纯化后黄杞叶总黄酮5 mg,精密称定,置于25 ml量瓶中,以甲醇充分溶解并定容至刻度,过滤得供试品溶液。取落新妇苷、黄杞苷、花旗松素对照品与供试品溶液进样分析,结果3个指标峰的纯度分别达到999.408、999.209、998.653,色谱图见图2。

图2 高效液相色谱图Fig 2 HPLC chromatograms
2.4.2 方法学考察 (1)线性关系考察。取落新妇苷、黄杞苷、花旗松素对照品各浓度梯度溶液10 μl注入色谱仪,以质量浓度(x)为横坐标、峰面积(y)为纵坐标绘制标准曲线,并进行线性回归分析,结果见表4。

表4 3种对照品的线性关系考察Tab 4 Linear relationship of 3kinds of substance control
(2)定量限考察。分别取“2.4.1(1)”项下对照品溶液,等倍逐步稀释,进样测定,记录峰面积。当信噪比为10∶1时,得落新妇苷、黄杞苷、花旗松素的定量限分别为3.2、3.1、0.9 ng。
(3)精密度试验。分别精密吸取质量浓度为115.80 μg/ml的落新妇苷、8.64 μg/ml的黄杞苷和6.76 μg/ml的花旗松素对照品溶液10 μl,各连续进样6次,记录峰面积。结果3种成分峰面积的RSD分别为0.12%、0.21%、0.29%(n=6),表明仪器精密度较好。
(4)重复性试验。按“2.4.1(2)”项下方法制备6份供试品溶液,进样分析。结果落新妇苷、黄杞苷、花旗松素的平均含量分别为57.72%、3.35%、2.67%(RSD分别为0.31%、0.43%、0.36%,n=6),表明该方法重复性较好。
(5)稳定性试验。精密称取“2.4.2(4)”项下供试品溶液10 μl,分别于制备后的0、3、6、9、12 h进样,记录峰面积。结果落新妇苷、黄杞苷、花旗松素峰面积的RSD分别为0.72%、0.85%、0.91%(n=5),表明供试品溶液在12 h内稳定。
(6)加样回收率试验。取已知含量的样品共9份,每份5 mg,精密称定,平均分为3组,各分别加入“2.4.1(1)”项下的落新妇苷对照品贮备液4.0、5.0、6.0 ml,黄杞苷和花旗松素对照品贮备液各0.8、1.0、1.2 ml,以甲醇稀释定容至50 ml。进样测定,计算加样回收率。结果,3种成分的平均回收率分别为100.41%、97.54%、98.70%(RSD分别为0.94%、1.40%、2.88%,n=3)。
2.4.3 样品含量测定 取“2.3.3”项下制备的3批黄杞叶总黄酮按“2.4.1(1)”项下方法制成供试品溶液,各精密吸取10 μl进样分析,计算黄杞叶总黄酮中落新妇苷、花旗松素、黄杞苷的含量,结果见表5。
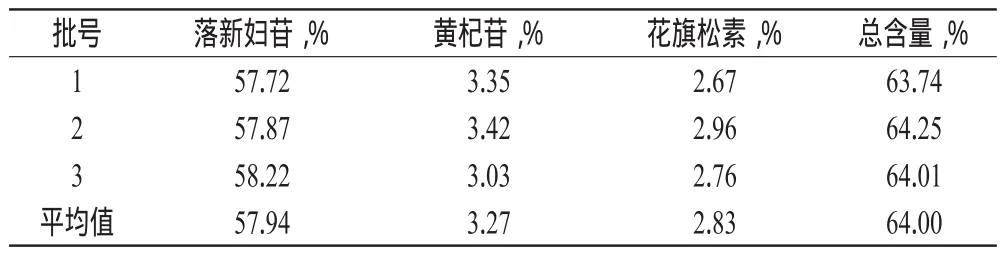
表5 3批纯化后黄杞叶总黄酮中3种成分的含量测定结果Tab 5 Content determination results of 3 effective components in purified total flavonoids from 3 batches of E.roxburghiana
3 讨论
本研究提取的总黄酮中主要成分是二氢黄酮类化合物,这也是黄杞总黄酮中的主要生物活性成分。落新妇苷在黄杞叶药材中的含量达到了8.06%,在黄杞总黄酮中的含量高达50%以上,是黄杞叶中含量最为丰富的化合物。本试验以落新妇苷以指标,不仅因为其含量最高,还因为其理化性质、极性等与其他类二氢黄酮成分相似,可以用同样的方法提取纯化得到。除此之外,采用高效液相色谱法测定落新妇苷的含量比采用紫外-可见分光光度法测定总黄酮的含量具有更强的专属性。
不同填料对落新妇苷的吸附解析性能差异较大,本研究的前期工作完成了对聚酰胺(100目)、HPD-417、NKA-9、AB-8、HPD-100、HPD-400、D101-I等吸附填料的静态、动态吸附以及解吸附数据的比较,优选出了载样量大且指标成分能够被中、低体积分数的乙醇洗脱完全的AB-8和NKA-9树脂。考虑成本优势,最终在工艺研究中使用AB-8树脂纯化黄杞总二氢黄酮。
黄杞叶粗提物的水溶性不佳,混悬液上样大孔树脂后,大量固体析出阻塞树脂,不仅造成操作不便,更影响树脂的洗脱效果。本试验增加了乙酸乙酯萃取这步操作,代替大孔树脂的水洗或低体积分数醇洗步骤,以除去大极性杂质。萃取精制后的提取物可用一定体积的中等体积分数(30%~60%)的乙醇溶解澄清。根据树脂性能优选乙醇体积分数(50%)后,可在保证二氢黄酮类成分被洗脱的同时,实现脱色除杂的目的。
随着对二氢黄酮类衍生物药理活性的深入研究,该类成分的成药性前景逐渐受到更多关注。天然来源的二氢黄酮成分具有储量丰富、立体选择性高的特点,成为新药开发的重要资源。作为地方绿化树种的黄杞是获取落新妇苷等二氢黄酮类成分的理想来源,其叶中的落新妇苷含量远高于以此为指标成分的百合科菝葜属植物。黄杞可以落叶入药,适于持续开发,成本低廉。
本研究通过对黄杞叶总黄酮制备纯化工艺研究,可获得高纯度的总二氢黄酮。笔者曾采用紫外法测定了总黄酮的含量,在确定的工艺条件下制备的黄杞总黄酮中,总黄酮的含量为82.4%,落新妇苷、黄杞苷、花旗松素三者含量之和占总黄酮的77.7%;这与本试验采用高效液相色谱法测定的结果有一定差异。
本试验可为二氢黄酮类成分的富集纯化以及该地方药材品种的深入开发提供技术支持。
[1]王芬,张雪玲,李建绪.大孔树脂分离黄杞叶总黄酮的研究[J].中国医药指南,2014,12(34):22.
[2]张霞,傅旭春,白海波.广西地产黄杞叶指纹图谱研究[J].中国现代应用药学,2014,31(1):54.
[3]曲佳,周军,侯文彬,等.HPLC法测定黄杞叶中落新妇苷和黄杞苷[J].中草药,2009,40(2):306.
[4]孙彤,邓安珺,李志宏,等.黄杞叶中黄酮类化学成分的研究[J].中国药学杂志,2012,47(20):1 617.
[5]李翔,陈冠铭,王明强.我国代茶植物资源及其开发利用现状[J].饮料工业,2008,11(2):4.
[6]姚毅,周翔,陈婷.高效液相色谱法测定罗汉茶中落新妇苷的含量[J].中国现代应用药学,2006,23(9):920.
[7]Chen TH,Liu JC,Chang JJ,et al.The in vitro inhibitory effect of flavonoid astilbin on 3-hydroxy-3-methylglutaryl coenzyme A reductase on vero cells[J].Chinese Medical Journal:Taipei,2001,64(7):382.
[8] Haraguchi H,Ohmi I,Fukuda A,et al.Inhibition of aldose reductase and sorbitol accumulation by astilbin and taxifolin dihydroflavonols in Engelhardtia chrysolepis[J].Bioscience,Biotechnology and Biochemistry,1997,61 (4):651.
[9]Chen T,Li J,Cao J,et al.A new flavanone isolated from rhizoma smilacis glabrae and the structural requirements of its derivatives for preventing immunological hepatocyte damage[J].Planta Medica,1999,65(1):56.
[10]Zhang XX,Xiao XF,Shan Q,et al.Recent advance on plant sources,bioactivities,pharmacological effects and pharmacokinetic studies of taxifolin[J].Asian Journal of Pharmacodynamics and Pharmacokinetics,2010,10(1):35.
[11]周艳林,闵建国,王力生,等.TLC-生物自显影法导向分离菝葜中抗氧化活性成分[J].中华中医药杂志,2012,27 (4):799.
[12]国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:18.
[13]蔡果,龚春燕,申国庆.HPLC法同时测定复方土茯苓胶囊中落新妇苷和芦丁的含量[J].中国药房,2012,23 (47):4 486.
Optimization of Extraction and Purification Technology of Total Flavonoids from Engelhardia roxburghiana and Content Determination of 3 Kinds of Effective Components
ZHENG Yijing1,SHAN Qi2,3,ZHOU Fujun2,3,HUA Jie2,3,WANG Hongmin4,HOU Wenbin2,3(1.Graduate School,Tianjin Medical University,Tianjin 300070,China;2.Tianjin Institute of Pharmaceutical Research,Tianjin 300193,China;3.Tianjin Engineering Laboratory for Quality Control Technology of Chinese Herbal Medicines,Tianjin 300193,China;4.Graduate School,Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China)
OBJECTIVE:To optimize the extraction and purification technology of total flavonoids from Engelhardia roxburghiana,and to establish the method for the content determination of 3 kinds of effective components.METHODS:Using the extraction transfer rate of astilbin as index,single factor test was used to investigate extraction solvent,extraction method,volume fraction of percolation solvent ethanol,percolation material-liquid ration,soaking time before percolation and percolation rate of extraction technology,and volume fraction of eluant ethanol in AB-8 resin purification technology.The contents of 3 effective components as astilbin,texifolin and engelitin in total flavonoids from E.roxburghiana were determined by HPLC.RESULTS:The optimal extraction technology was using 70%ethanol as extraction and percolation solvent,percolation extraction,soaking for 8 h before percolation,percolation material-liquid ratio of 1∶16(g/ml),percolation rate of 30 ml/(min·kg).The purification technology was diluting the solution to 0.5 g(crude drug)/ml with water,ethyl acetate extraction,dissolved extract with 50%ethanol after evaporated to dryness,AB-8 resin for sampling,eluted with 50%ethanol,concentrating and drying.In verification test,extraction transfer rate of astilbin was more than 80%(RSD=0.42%,n=3).The contents of astilbin,taxifolin and engeletin in total flavonoids from E.roxburghiana by purified were 57.94%,3.72%and 2.83%,respectively;the contents of 3 components accounted for 64.00%of total flavonoids.CONCLUSIONS:The extraction and purification technology is stable,rational and reliable;the content determination method of 3 effective components in total flavonoids of E.roxburghiana is accurate,simple and producible.
Engelhardia roxburghiana;Total flavonoid;Extraction technology;Purification technology;Orthogonal test;AB-8 resin;Astilbin;Taxifolin;Engeletin;Cotent determination
R284.2
A
1001-0408(2016)25-3545-04 DOI 10.6039/j.issn.1001-0408.2016.25.27
2016-04-12
2016-05-23)
(编辑:刘 萍)
天津市应用基础及前沿技术研究计划(青年基金项目)(No.12JCQNJC08700)
*硕士研究生。研究方向:天然药物。E-mail:741465087@qq.com
研究员,博士。研究方向:天然药物。电话:022-23006295。E-mail:houwb@tjipr.com
