呼吸系统疾病吸入粉雾剂的特性研究进展Δ
2016-10-26马银玲庞国勋邱志宏董占军河北省人民医院药学部石家庄05005河北医科大学药学院石家庄05007
马银玲,赵 锋,庞国勋,邱志宏,董占军#(.河北省人民医院药学部,石家庄 05005;.河北医科大学药学院,石家庄 05007)
呼吸系统疾病吸入粉雾剂的特性研究进展Δ
马银玲1,2*,赵 锋2,庞国勋1,邱志宏1,董占军1#(1.河北省人民医院药学部,石家庄 050051;2.河北医科大学药学院,石家庄 050017)
目的:总结呼吸系统疾病用吸入粉雾剂(DPI)中药物选择、新型辅料、装置研究、吸入技巧等因素的研究进展,为今后剂型研究提供参考。方法:以“吸入粉雾剂”“吸入装置”“呼吸疾病”“Dry powder inhaler”“Respiratory disease”“Inhalation device”“Inhalation skill/technique”等为关键词,组合查询1995年1月-2015年7月在中国知网、万方、维普和PubMed、Sciencedirect、Springer-Link、Wiley Online Library等数据库以及FDA官网中有关吸入粉雾剂的相关文献,对影响制剂疗效的因素进行综述与分析。结果与结论:共筛选出相关文献62篇,其中有效文献35篇。设计DPI时,应将药物的选择、辅料的特性、装置的内部构造、使用技巧等方面协同考虑。药物应选择作用强、持续时间长的新型化合物;辅料应注重粒径、分布、圆整度、表面形态等方面;装置应能诱导足够的湍流通过碰撞将药物粒子解聚,剪切力与湍流是装置的核心;患者的吸入技巧教育也非常重要。
吸入粉雾剂;呼吸系统疾病;吸入装置
吸入粉雾剂(DPI)是将药物或药物辅料粉末化后通过特定给药装置经患者口部主动吸入的制剂,通过患者主动吸入产生气流将药物粉末吸入呼吸系统产生疗效。该制剂是由粉末制剂与其相对应的给药装置共同构成,其治疗效果受粉末处方、吸入装置、患者吸入技巧等多种因素影响[1]。
呼吸系统疾病主要病变在气管、支气管、肺部及胸腔,以呼吸受阻、咳嗽、疼痛等为表症,易受冷空气、污浊空气、空气清新剂等因素影响[2-3]。近年来,随着大气污染的加重,呼吸系统疾病发病率呈明显的上升趋势[4-5]。
DPI因具有局部浓度高利于治疗、避免首关效应、起效快速、患者依从性好、处方简单、成本低、药物稳定、易精确定量等特点,已成为呼吸系统疾病的研究热点剂型之一[1,5]。目前,国内外已批准上市的DPI近20余种[6-13],但仍存在对患者吸入力量的依赖、药物解离低、有效药物吸入比例低等方面的不足。笔者以“吸入粉雾剂”“吸入装置”“呼吸疾病”“Dry powder inhaler”“Respiratory disease”“Inhalation device”“Inhalation skill/technique”等为关键词,组合查询1995年1月-2015年7月在中国知网、万方、维普和PubMed、Sciencedirect、Springer-Link、Wiley Online Library等数据库以及FDA官网中有关吸入粉雾剂的相关文献。结果,共筛选出相关文献62篇,其中有效文献35篇。现主要围绕药物、辅料、装置、使用技巧方面进行综述,旨在为DPI的剂型研究提供参考。
1 药物选择
目前,已批准上市的DPI制剂主要用于支气管哮喘、慢性阻塞性肺疾病(COPD)、儿童哮喘、肺部感染等疾病的预防与治疗,见表1。
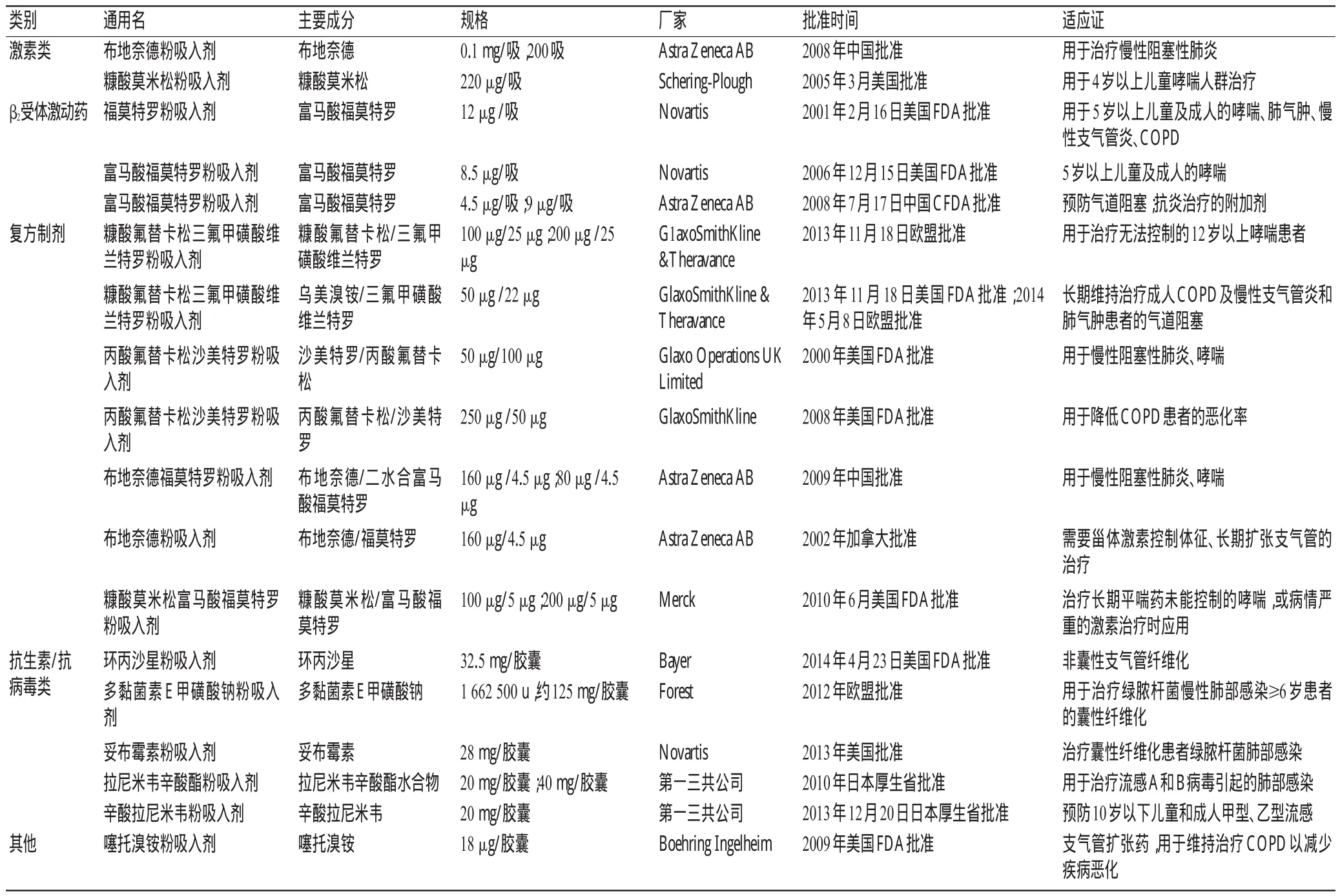
表1 近年已批准上市的DPI产品
1.1 用于扩张支气管的药物
上市药物:富马酸福莫特罗、沙美特罗、非诺特罗、丙卡特罗、三氟甲磺酸维兰特罗、马来酸茚达特罗、盐酸克仑特罗、硫酸沙丁胺醇、噻托溴铵、异丙托溴铵等β2受体激动药和乙酰胆碱拮抗剂类药物等。
1.2 用于改善呼吸系统症状的激素类药物
上市药物:布地奈德、环索奈德、曲安奈德、丙酸倍氯美松、丙酸氟替卡松、糠酸莫米松等。
1.3 用于治疗或预防呼吸系统感染、肺结核的药物
上市药物:环丙沙星、多黏菌素E、氟康唑、扎那米韦、妥布霉素、拉尼米韦辛酸酯、卷曲霉素[14]、利福平[6]等。
综上所述,作为呼吸系统疾病的粉雾剂型药物一般以激素类、β受体激动药、抗生素以及上述药物的复方形式,均具有药理活性高、靶点明确、理化性质适合呼吸给药的特点。结合给药频率考虑,宜选半衰期长、代谢慢的药物,发挥长效作用。
2 新型辅料
2.1 辅料特性的研究
DPI处方中,辅料主要用于改善药物粉末的流动性、吸附性/解吸附性、吸湿性等,其种类包括表面活性剂、分散剂、润滑剂、抗静电剂、多孔类载体、胶囊壳材料等。常用辅料有甘露醇、球形乳糖、一水合葡萄糖、麦芽糖、环糊精、二棕榈酰磷脂酰胆碱、磷酸卵磷脂、磷脂酰甘油、磷脂酰肌醇、磷脂酰乙醇胺等[15-16]。胶囊壳一般采用羟丙甲纤维素、明胶等材料。
辅料的种类、用量、粒径、表面形态等是DPI的影响因素。一般根据药物的粒子性质选择合适的辅料及用量。乳糖较为常用,其与药物常用比例为1∶67.5(m/m)[17],但福莫特罗粉吸入剂中每吸含福莫特罗12 μg、乳糖25 μg[18];富马酸福莫特罗粉吸入剂中每吸含乳糖450 μg、药物为6或12 μg。Kadota K等[6]对高分支环糊精与利福平经过乙醇水溶液溶解后再经喷雾干燥制粒,其排空率、有效吸入比例分别为95.7%、39.5%,且高分支环糊精表面为皱缩状态,可以吸附药物粉末,表明该辅料可以提高药物粉末的肺部吸入率。Healy AM等[19]将乳糖颗粒的圆整度、均一性作为DPI处方组成的重要因素。因此,在DPI处方设计时,应根据药物性质与辅料特征选择适宜的制备方法,并考虑辅料粒径、表面形态、圆整度、用量等因素。
2.2 辅料作为载体的研究
Martinelli F等[18]对DPI的辅料作用进行研究。将喷雾制得的胰岛素粉末(无载体)与福莫特罗粉末(乳糖载体)进行装置刺孔位置研究,发现胰岛素粉末(无载体)的有效吸入比例与DPI胶囊的刺孔位置无关,仅与装置构造有关;而福莫特罗粉末与刺孔位置、装置内部结构有关。载体对药物的粉末气雾化有一定的影响,不同的药物粉末性质(流动性、聚集性、吸湿性、松密度、粒径等)对药物的气雾化有一定的影响,如胰岛素经喷雾干燥得到的粉末流动性较好、密度小、粒径较大,可不经载体的吸附完成粉末气雾化过程。
Hassoun M等[20]将Respitose®ML006、Respitose®ML001、Lactohale®LH200、Lactohale®LH300等4种乳糖与沙美特罗昔萘酸酯粉末分别混合后测定有效吸入比例,发现Respitose®ML006粒径最小,Dv90为59.7 μm[Dv:球体直径(the volume diameter),Dv90为粉体粒径分布中,占总量90%球体的直径数值],其中细颗粒(Dv<10 μm)占20.9%(m/m);Lactohale®LH200粒径最大,Dv90为156.8 μm,其中细颗粒(Dv<10 μm)占6.7%(m/m)。载体中细微颗粒越多,越有利于载体-药物聚集体解聚。Respitose®ML001作为载体,其有效吸入比例是Lactohale®LH200的8倍。另外,载体颗粒参与的气雾化过程中所造成的气流阻力越大,胶囊剩留量越小。Sim S等[21]对不同类型的乳糖作为载体进行研究,结果Respitose®ML001 (Dv90:160.02 μm)中细粉多(1.66%,Dv<5 μm),有利于药物与载体间的解聚和药物粉末气雾化;药物有效吸入比例与乳糖颗粒的形状、堆积密度、压实系数无明显相关性。Cordts E等[22]将2种乳糖Respitose®SV 003(Dv90:93 μm)、Lactohale®LH 300(Dv90:7.46 μm)与布地奈德分别组成两元、三元处方,调节处方中2种乳糖的用量,考察药物的渗透性及有效粒径。结果,在两元系统中,粒径较大的Respitose®SV 003组成比例为7.5%时,药物的有效粒径比例达15%;在三元系统中,Lactohale®LH 300组成比例为7.5%时,有效粒径比例达20%。可见,在载体系统中,细颗粒所占比例增大,会提高药物有效吸入比例。
目前,DPI上市制剂中约有20%~30%的制剂,其粉末颗粒均具有较强黏性与聚集性质,平均粒径约为1~5 μm。粒径、处方组成、制备工艺均对药物颗粒分布、递送剂量等产生影响。药物粉末需要足够的黏性与载体形成聚集体,其分散与载体表面的形态与尺寸有关[23]。
3 DPI装置研究
DPI装置可使胶囊中的药物-载体聚集体形成粉末气流化,以及气流化后与装置内壁碰撞解离成药物颗粒,供口部吸入治疗。常用的吸入装置有Aerolizer®、Autohaler®、Breezehaler®、Diskus®、Handihaler®、MDI without spacer、Miat-haler®、Novolizer®、Respimat®和Turbohaler®等[6-13],其作用机制主要为气流湍流、剪切流与粒子的作用,粒子与装置间的作用,粒子间的作用三方面。计算流体动力学结果显示,装置内部结构的局部改变将导致较大的有效吸入比例差异,增加药物的孔隙率会减少聚集体颗粒中药物的解离,从而不利于药物到达肺部[24]。按装置作用的过程,DPI装置可分为粉末气流化、药物解吸附(湍流、剪切流)两个过程递送药物粉末[8,24-26]。
3.1 粉末气流化
粉末气流化是粉末与气流、粒子与胶囊的作用,过程包括胶囊刺破和胶囊内容物气流化两个阶段。
胶囊的释药孔位置与内容物气流化有关。胶囊内容物气流化是将刺破胶囊壳的内容物在气流驱动下从释药孔中释放出来,形成烟雾状气流的过程。Martinelli F等[18]对5种胶囊壳刺破方式(胶囊底部刺单孔、胶囊底部与头部的中心刺单孔、胶囊底部与头部的侧面刺单孔、胶囊底部侧面刺双孔、胶囊头部与底部中心各刺四孔)进行研究,发现胶囊底部与头部的侧面刺单孔得到的有效吸入比例(有效吸入的颗粒直径<5 μm)较大,占37.29%。一般情况下,装置的气流速度为60 L/min。
胶囊的旋转与内容物的气流化有关。Martinelli F等[18]对Aerolizer、RS01、HandiHaler、Turbospin 4种装置进行考察,其中Aerolizer装置将胶囊以垂直于长径方向旋转,将内容物释出;RS01、HandiHaler、Turbospin以长径方向为轴旋转,将内容物释出。结果显示,内容物气流化程度越高,离心力越强,相应的胶囊旋转速度较大。可见,装置的内部构造不同可导致胶囊不同类型的旋转,进而产生不同的气流化效果。
为加强粉末撞击解离,化解粉末颗粒间的弱作用力引起的聚集现象,Tonnis WF等[27]将给药装置进行改进,将Penn-Century insufflator的一步气化改为两步气雾化。研究者将测定粉末置于平台上,粉末经边缘部进入装有定向排列挡板的下一平台,快速进入的聚集粉末撞击后解离,形成气溶胶后进入筒体,筒体底部直接与实验小鼠口部软管连接。结果发现,装置的口部形状不会影响装置的滞留量,但会影响动物喉部滞留量。
在粒子间相互作用方面,Zellnitz S等[28]用玻璃珠(粒径400~600 μm)代替DPI粉末,发现1~5 μm的载体粒子通常具有较大的黏性和较差的流动性;50~200 μm的载体粒子具有粗糙的表面,可影响药物与载体的相互作用。
因此,粉末气流化是此类制剂的重要一环,与胶囊的刺孔位置、孔数、胶囊在气流中的运行方式、装置的内部结构、聚集体的大小、形态等因素有关。设计时应综合考虑,通过实验筛选出最适合药物的因素。
3.2 药物解吸附
药物解吸附是气流化的聚集体在气流中经过装置的内壁及气道挡板的碰撞,将载体上吸附的药物颗粒解吸附形成药物气溶胶,随气流吸入患者的气管、肺部。其受装置的内部构造影响。而气流的变化增加了粉末撞击内壁、挡板的几率,提高了载体颗粒上吸附药物的解离效果。Selvam P等[29]通过改变吸入装置的口部形状、吸入气流速率等因素,考察药物解吸附对药物有效吸入比例的影响。结果表明,装置的内部结构、尺寸大小均影响药物的有效吸入比例,锥形(长度5 cm,底部直径为1.2 cm,顶部1 mm)外观的装置会产生更高的振动,使有效吸入比例高达57.5%。
Sim S等[21]对硫酸沙丁胺醇气雾剂的装置进行改进,将整体装置尺寸、底部进气口的尺寸、形状均进行修改,具体将进气口两侧条状开口减小至一半。在主室内增加一片气流扰动板,在主室与接近口部室间增加一个网状筛板,将装置制备为透明的管体便于观察。结果表明,药物的有效吸入比例跟聚集体粉末与胶囊的吸附力、胶囊在气流中的旋转速度、静止时胶囊的位置等因素密切相关。小口径的进气口有利于提高胶囊的旋转速度,提升胶囊的排空率;扰动板及网状筛板均会提升与气流化的聚集体粉末的碰撞几率,有利于药物与载体的分离。另外,粉末的渗透性、可压缩性可用来预测药物-载体粉末的流动性及气流化能力。可压缩性、渗透性强,预示药物-载体聚集体的流动性好,表面光滑,其气流化能力强。Sim S等[21]采用FT4粉末流量计测定粉末的渗透性与可压缩性,结果发现,粉末的细颗粒数量与可压性、渗透性呈正相关。如选用Rotahaler装置,对不同类型的乳糖研究发现,与LH100乳糖(35.9%,<60 μm)相比,ML001乳糖的细颗粒比例较多(52%,<60 μm),其压缩性、渗透性均占明显优势。可压性、渗透性与有效吸入比例成正比(在压差为15 kPa时,相关系数为0.98),因此,通过对粉末渗透率的测定,可预测辅料与药物聚集体的有效吸入比例。
药物-载体聚集体粉末粒径在粉末气流中的解聚情况与装置、气流种类有关。气流湍流的强度与药物解吸附比例的增加呈正相关[26]。Ning Z等[30]模拟粒子与装置内壁碰撞诱导乳糖聚集体的破裂,形成粒子粒径为9~11 μm,研究发现松弛的颗粒聚集体动力学特征、负载特性与固体或紧密聚集体不同。Tong ZB等[31]采用分立元件法建立甘露醇颗粒聚集体与装置内壁的碰撞模型,同时优化碰撞角度(45°)以提升气流速度、促进碰撞破裂。研究发现,受气流阻力的影响,粒子聚集体在气流通道前、中段快速崩碎,在末端崩碎速度减缓;药物-辅料聚集体在接近装置内壁时易被分散;碰撞速度和碰撞角度与分散呈正相关,黏附性与分散呈负相关;碰撞速度在分散中起重要作用,颗粒与内壁的碰撞诱导分散跟韦布尔分布接近,由碰撞能量与黏附力比值决定。
药物解吸附是在药物-载体聚集体中药物颗粒与载体相互分离的过程,与装置内部的结构、聚集体的大小、载体形态、气流形式及速度密切相关,设计DPI时应充分考察上述因素的影响。
4 吸入技巧
各个系列干粉吸入装置的最佳吸入方法都应灵敏而迅速。但特殊人群如儿童、老年人和气道严重阻塞患者不能通过产生足够快的吸入速率来实现最佳药物传输[32]。吸入技巧是DPI产生高效作用的重要因素[24]。目前,国外DPI用于支气管哮喘使用率为43.3%,使用错误率达82.3%。吸入装置的错误使用已成为DPI用于呼吸系统疾病治疗一大障碍[32-33]。Chorão P等[34]对DPI装置的使用情况进行调查,发现被认为最易使用的Turbohaler®、Diskus®、Novolizer®,错误使用率却高达21%、19%、18%。另外,不同人群对培训的效果不同,不同住院频度、疾病、学历的群体,培训前后会有较大的差别,但培训后出错率均较低。但老年人在培训后仍有较高的使用错误率,值得相关人员注意[33]。
装置的选择依赖于患者的需求、喜好、疾病等特点。无论选择何种吸入装置,医护人员对患者的培训在改善吸入技术和患者依从性方面都有重要作用。适宜的装置操作训练,不仅能有效控制症状,而且能降低用药剂量,从长远角度看,可全面降低治疗费用[35]。因此,患者培训对吸入装置的正确使用有重要影响。
5 其他研究
5.1 装置微结构及气流研究
DPI将处方内容物填装于胶囊内,以单个胶囊或多个胶囊填装于装置中。一般胶囊依赖气流的流速带动旋转,从而将内容物气流化。Selvam P等[29]考察了不同装置的几何形状、尺寸、涂膜类型、气流抵抗等因素,将胶囊改为膜剂,将药物粉末黏附于薄膜上,并将薄膜置于装置中。结果表明:(1)装置吸入部分的形状会影响胶囊的振动强度,影响有效吸入率。逐渐变细的圆柱体有较高的有效吸入率值(57.5%),圆锥体次之(50%),而上市装置Inhalator、Rotahaler其值分别为15%~ 20%、25%。(2)气流出口的内径较小,有利于湍流的产生,有利于气流对薄膜振动强度的增加,有利于药物解聚成可吸入的有效部分。(3)雷诺系数越大,越有利于气流阻力的形成,有利于药物粉末间的解聚和提高有效吸入比例。膜厚度增加亦能增加雷诺系数。(4)气流抵抗越大,越有利于装置内粉末气流的撞击,有利于粉末的解聚、离心发散。
5.2 动物体内评价
在DPI的动物实验中,一般采用被动方式,将动物置于气溶胶空气中,通过鼻腔途径吸入,其吸入量一般占总体积的0.02%~0.2%。该方法需要较大剂量的气溶胶,用于自由活动动物的给药。
对动物固定后给药,一般使用气体量,如小鼠为200 μl,豚鼠为5 ml。给药前必须将药物粉碎、气化后定量给药。Penn-Century insufflator装置用于小鼠,肺部沉积率为19%,而Aerosol generator装置可达49%。新装置Aerosol generator与Penn-Century insufflator装置比较,吸入量的偏离常数较小,药物进入肺部的量更多,并可进入全肺组织[27]。
6 结语
综上,设计DPI时,药物的选择、辅料的特性、装置的内部构造、使用技巧方面应协同考虑。药物应选择作用强、持续时间长的新型化合物;辅料应注重粒径、分布、圆整度、表面形态等方面;装置应能诱导足够的湍流通过碰撞将药物粒子解聚,剪切力与湍流是装置的核心;患者的吸入技巧教育也非常重要。在计算流体动力学和粒子工程等新技术的辅助支持和吸入药物治疗学的推动下,研发不依赖患者的呼吸、高效率递送、重复性好、使用简单的DPI是今后该领域的热点。
[1]Hoppentocht M,Hagedoorn P,Frijlink HW,et al.Technological and practical challenges of dry powder inhalers and formulations[J].Adv Drug Deliv Rev,2014,75(2):18.
[2] Martins V,Minguillón MC,Moreno T,et al.Deposition of aerosol particles from a subway microenvironment in the human respiratory tract[J].J Aerosol Sci,2015,90 (12):103.
[3]Janke K.Air pollution,avoidance behaviour and children’s respiratory health:evidence from England[J].J Health Econ,2014,38(12):23.
[4]Ozcan NS,Cubukcu KM.Evaluation of air pollution effects on asthma disease:the case of Izmir[J].Procedia-Social and Behavioral Sciences,2015,202(8):448.
[5]Mentese S,Mirici NA,Otkun MT,et al.Association between respiratory health and indoor air pollution exposure in Canakkale,Turkey[J].Build Environ,2015,93(1):72.
[6] Kadota K,Senda A,Ito T,et al.Feasibility of highly branched cyclic dextrin as an excipient matrix in dry powder inhalers[J].Eur J Pharm Sci,2015,79(11):79.
[7]Horhota ST,van Noord JA,Verkleij CB,et al.In vitro,pharmacokinetic,pharmacodynamic,and safety comparisons of single and combined administration of tiotropium and salmeterol in COPD patients using different dry powder inhalers[J].AAPS J,2015,17(4):871.
[8]Yang MY,Chan JG,Chan HK.Pulmonary drug deliveryby powder aerosols[J].J Control Release,2014,doi:10.1016/j.jconrel.2014.04.055.
[9]Tucker IG,Das SC,Stewart PJ.A view on the less-thanrational development of drug delivery systems:the example of dry powder inhalers[J].J Drug Deliv Sci Technol,2015,30(B):310.
[10] de Boer AH,Hagedoorn P,Gjaltema D,et al.Air classifier technology(ACT)in dry powder inhalation Part 3.Design and development of an air classifier family for the Novolizer®multi-dose dry powder inhaler[J].Int J Pharm,2006,310(1/2):72.
[11] Berkenfeld K,Lamprecht A,McConville JT.Devices for dry powder drug delivery to the lung[J].AAPS Pharm Sci Tech,2015,16(3):479.
[12]Soulele K,Macheras P,Silvestro L,et al.Population pharmacokinetics of fluticasone propionate/salmeterol using two different dry powder inhalers[J].Eur J Pharm Sci,2015,80(1):33.
[13] Voshaar T,Spinola M,Linnane P,et al.Comparing usability of NEXThaler®with other inhaled corticosteroid/ long-acting β2-agonist fixed combination dry powder inhalers in asthma patients[J].J Aerosol Med Pulm Drug Deliv,2014,27(5):363.
[14] Schoubben A,Blasi P,Giontella A,et al.Powder,capsule and device:an imperative ménage à trois for respirable dry powders[J].Int J Pharm,2015,494(1):40.
[15] Pilcer G,Amighi K.Formulation strategy and use of excipients in pulmonary drug delivery[J].Int J Pharm,2010,392(1/2):1.
[16]Possmayer F,Nag K,Rodriguez K,et al.Surface activity in vitro:role of surfactant proteins[J].Comp Biochem Physiol A Mol Integr Physiol,2001,129(1):209.
[17] Zeng XM,Martin GP,Tee SK,et al.Effects of particle size and adding sequence of fine lactose on the deposition of salbutamol sulphate from a dry powder formulation[J].Int J Pharm,1999,182(2):133.
[18]Martinelli F,Balducci AG,Rossi A,et al.“Pierce and inhale”design in capsule based dry powder inhalers:effect of capsule piercing and motion on aerodynamic performance of drugs[J].Int J Pharm,2015,487(1/2):197.
[19]Healy AM,Amaro MI,Paluch KJ,et al.Dry powders for oral inhalation free of lactose carrier particles[J].Adv Drug Deliv Rev,2014,75(8):32.
[20] Hassoun M,Ho S,Muddle J,et al.Formulating powderdevice combinations for salmeterol xinafoate dry powder inhalers[J].Int J Pharm,2015,490(1/2):360.
[21] Sim S,Margo K,Parks J,et al.An insight into powder entrainment and drug delivery mechanisms from a modified Rotahaler®[J].Int J Pharm,2014,477(1/2):351.
[22] Cordts E,Steckel H.Capabilities and limitations of using powder rheology and permeability to predict dry powder inhaler performance[J].Eur J Pharm Biopharm,2012,82 (2):417.
[23] Milenkovic J,Alexopoulos AH,Kiparissides C,et al.Deposition and fine particle production during dynamic flow in a dry powder inhaler:a CFD approach[J].Int J Pharm,2014,461(1/2):129.
[24]Yang JC,Wu CY,Adams M.DEM analysis of the effect of particle-wall impact on the dispersion performance in carrier-based dry powder inhalers[J].Int J Pharm,2015,487(1/2):32.
[25] Wong W,Fletcher DF,Traini D,et al.Particle aerosolisation and break-up in dry powder inhalers:evaluation and modelling of impaction effects for agglomerated systems[J].J Pharm Sci,2011,100(7):2 744.
[26]Voss A,Finlay WH.Deagglomeration of dry powder pharmaceutical aerosols[J].Int J Pharm,2002,248(1/2):39.
[27]Tonnis WF,Bagerman M,Weij M,et al.A novel aerosol generator for homogenous distribution of powder over the lungs after pulmonary administration to small laboratory animals[J].Eur J Pharm Biopharm,2014,88(3):1 056.
[28]Zellnitz S,Redlinger-Pohn JD,Kappl M,et al.Preparation and characterization of physically modified glass beads used as model carriers in dry powder inhalers[J].Int J Pharm,2013,447(1/2):132.
[29]Selvam P,McNair D,Truman R,et al.A novel dry powder inhaler:effect of device design on dispersion performance[J].Int J Pharm,2010,401(1/2):1.
[30]Ning Z,Boerefijn R,Ghadiri M,et al.Distinct element simulation of impact breakage of lactose agglomerates[J].Adv Powder Technol,1997,8(1):15.
[31] Tong ZB,Yang RY,Yu AB,et al.Numerical modelling of the breakage of loose agglomerates of fine particles[J].Powder Technol,2009,196(2):213.
[32]Price D,Roche N,Virchow JC,et al.Device type and real-world effectiveness of asthma combination therapy:an observational study[J].Respir Med,2011,105(10):1 457.
[33]Aydemir Y.Assessment of the factors affecting the failure to use inhaler devices before and after training[J].Respir Med,2015,109(4):451.
[34] Chorão P,Pereira AM,Fonseca JA.Inhaler devices in asthma and COPD:an assessment of inhaler technique and patient preferences[J].Respir Med,2014,108(7):968.
[35] Arora P,Kumar L,Vohra V,et al.Evaluating the technique of using inhalation device in COPD and bronchial asthma patients[J].Respir Med,2014,108(7):992.
R944.9;R318.13;R974
A
1001-0408(2016)25-3574-05
10.6039/j.issn.1001-0408.2016.25.36
2015-11-30
2016-01-20)
(编辑:余庆华)
2012年河北省医学科学研究重点课题计划项目(No.20120217)
*硕士研究生。研究方向:临床药学、循证药学。E-mail:malingshz@163.com
主任药师,硕士生导师。研究方向:医院药学、药事管理。电话:0311-86988604。E-mail:13313213656@126.com
