介孔二氧化硅纳米粒的形貌对其与细胞相互作用及在生物体内行为的影响
2016-10-26阎雪莹黑龙江中医药大学药学院哈尔滨150040
李 燕,耿 雪,阎雪莹(黑龙江中医药大学药学院,哈尔滨 150040)
介孔二氧化硅纳米粒的形貌对其与细胞相互作用及在生物体内行为的影响
李 燕*,耿 雪,阎雪莹#(黑龙江中医药大学药学院,哈尔滨 150040)
目的:探讨介孔二氧化硅纳米粒(MSNs)的形貌对细胞及其体内行为的影响。方法:以“介孔二氧化硅纳米粒”“形貌”“体内行为”“Mesoporous silica nanoparticles”“Shape”“in vivo behavior”等为关键词,检索2010年1月-2016年4月在中国知网、维普、万方、PubMed、Web of Science、Elsevier、Springer Link等数据库中的相关文献及其参考文献,就MSNs不同形貌对其与细胞相互作用及在生物体内行为的影响进行综述。结果与结论:共检索到相关文献68篇,其中有效文献32篇。MSNs具有球状、棒状和一些特殊形貌(如内部完全中空或内部有部分空穴等)。MSNs与细胞之间的相互作用依赖于形貌,即随着纵横比的降低,MSNs在肝脏中的分布显著降低,在小肠和其他器官的吸收程度逐渐增加;棒状磁-MSNs的细胞内吞比传统球状磁-MSNs具有优势;随着纵横比的升高,MSNs被细胞摄取的数量越多;空心结构的MSNs内部空腔可以在装载更多药物的同时发挥缓释作用。未来研究应将粒径、纵横比、中空情况等形貌特征与化学组成、表面电荷等结构参数相结合,以设计出高载药量、高抑瘤率、高细胞摄取率、低毒性的MSNs。关键词 介孔二氧化硅;纳米粒;形貌;体内行为
介孔二氧化硅具有无毒、比表面积和总孔容大、孔径可调、表面易被修饰且载药量高等诸多特点[1-5]。在过去的10年中,以二氧化硅为基础的介孔材料成为研究热点,如可通过对作为药物载体的介孔二氧化硅进行表面功能化修饰以实现不同药物的装载和缓释[6-7]。介孔二氧化硅纳米粒(MSNs)的制备方法多种多样,如碱性介质合成法[8]、酸性介质合成法[9]和中性介质合成法[10]等,其中氢氧化钠(NaOH)碱性介质合成法较为经典[11]。MSNs的载药方法多种多样,常用的是吸附平衡法[12]。研究表明,颗粒与细胞之间的相互作用受颗粒的粒径、形貌、化学组成和表面电荷的影响[13-15]。有关粒径、化学组成和表面电荷的影响已得到充分的研究证实,但形貌对其影响的报道尚不多见。因此,笔者以“介孔二氧化硅纳米粒”“形貌”“体内行为”“Mesoporous silica nanoparticles”“Shape”“in vivo behavior”等为关键词,检索了2010年1月-2016年4月中国知网、维普、万方、PubMed、Web of Science、Elsevier、Springer Link等数据库中的相关文献及其参考文献,就MSNs的形貌对其与细胞相互作用及在生物体内行为的影响进行综述。共查阅到相关文献68篇,其中有效文献32篇,现报道如下。
1 一般形貌对MSNs在生物体内行为的影响
1.1 长棒状与短棒状的比较
Huang X等[16]通过改变反应试剂的浓度设计出一系列具有相同粒径、化学组成和表面电荷,但具有不同形貌的MSNs。该试验主要研究2种具有规则的六边形孔排列的纳米粒,即短棒MSNs-异硫氰酸荧光素[NSRs-FITC,纵横比(AR)约为1.5,长度为(185±22)nm]和长棒MSNs-异硫氰酸荧光素[NLRs-FITC,AR约为5,长度为(720±65)nm]。为了量化颗粒在小鼠体内的分布,Huang X等[16]通过静脉注射不同形貌的MSNs,采用电感耦合等离子体发射光谱仪(ICP-OES)测定小鼠血液和器官中的硅含量,结果表明NSRs主要分布在肝脏中,而NLRs主要分布在脾脏中。注射2、24 h和7 d后各器官中的硅含量随时间的推移均明显下降,表明MSNs可在肝脏、脾脏、肺脏和肾脏中发生生物降解或清除作用,且NLRs的清除速率高于NSRs。在给药的不同时间点检测血液中的硅含量以测定NLRs和NSRs的浓度,结果NLRs的血液循环时间长于NSRs,表明随着AR的增加,MSNs在血液中循环的时间也越长。从代谢笼中收集尿液和粪便样品,发现MSNs可通过尿液和粪便排出体外,且NSRs在这2种路线中的清除速率均快于NLRs,表明随着AR的增加,MSNs在这2种途径中的清除速率越低。综上所述,随着AR的降低,MSNs在肝脏中的分布显著降低,即不同形貌的MSNs的器官分布不同。这一发现不仅阐明了MSNs的体内行为,也提示不同形貌的MSNs对不同器官具有靶向性,可将其用于靶向治疗。
1.2 长棒状、短棒状与球状的比较
Li L等[17]研究了不同形貌对MSNs在小鼠体内的分布、排泄和毒性的影响,分别采用球型颗粒(NSs,AR约为1)、NSRs (AR约为1.75)和NLRs(AR约为5),检测方法同Huang X等[16]的研究。口服给药后发现3种形貌的MSNs在肝脏、肺、脾、肾、肠道中的分布情况均不相同,随后通过检测尿液和粪便中的硅含量,发现3种形貌的MSNs主要从尿液和粪便排出体外,且排出速率的变化表现出不同的趋势,即随着AR的降低,尿液的排出速率降低。在进一步研究MSNs的超微结构定位后发现,NSs存在于十二指肠、回肠和空肠的固有层中,而在这些部位并未发现非球型颗粒NSRs和NLRs。研究MSNs的生物降解时发现,降解速率由快到慢依次为NSs>NSRs>NLRs。同时,不同的形貌也可以导致不同程度的肾损伤,其中NSs导致的肾损伤最严重,包括出血和肾小管坏死;而NLRs导致的损伤最轻,只有轻微的出血现象。结果表明,随着AR的降低,小肠和其他器官对MSNs的吸收程度逐渐增加。因此,MSNs的形貌改变时,清除速率和毒性也发生了不可忽略的变化,由此可见,MSNs的形貌对其在生物体内的行为具有重要的作用。
2 形貌对MSNs与细胞之间的相互作用的影响
2.1 形貌对磁-MSNs细胞内吞的影响
肖轩昂[18]利用非控核生长法成功合成出3种不同形貌的磁-MSNs,分别为核壳磁-MSNs(M-MANP0)、短棒磁-MSNs (M-MANP1)和长棒磁-MSNs(M-MANP2),并利用荧光共定位分析、流式细胞术和普鲁士蓝染色法比较了被荧光标记的3种不同形貌的磁-MSNs在正常细胞和肿瘤细胞中的内吞作用。结果显示M-MANP2和M-MANP1的细胞内吞优于MMANP0,且M-MANP2的细胞内吞优于M-MANP1,表明棒状磁-MSNs的细胞内吞比传统核壳球状磁-MSNs具有优势。
2.2 MSNs的形貌对人黑色素瘤A375细胞功能的影响
Huang X等[19]研究了不同形貌的MSNs对人黑色素瘤A375细胞功能的影响,3种MSNs分别为NSs(AR约为1)、NSRs(AR约为2)和NLRs(AR约为4);并采用FITC和异硫氰酸罗丹明B(RITC)对MSNs进行功能化(功能化的MSNs可用于成像和MSNs细胞摄取的定量研究);随后比较不同形貌的MSNs被转运至A375细胞内的能力,并研究不同形貌的MSNs对细胞骨架形成、黏附、迁移、凋亡和增殖的影响。结果表明,NLRs与NSRs、NSs相比更容易被转运至细胞内,且经转运的NLRs的数量是NSRs的2倍,细胞摄取速率快于NSs。研究不同形貌的MSNs对细胞骨架的影响时发现,NSs和NSRs不会对细胞骨架产生标志性改变,而NLRs会导致细胞骨架的破坏和紊乱。考察不同形貌的MSNs对细胞黏附的影响时发现,细胞附着在细胞板上的数量随着颗粒AR的降低而逐渐增加。研究不同形貌的MSNs对细胞迁移的影响时发现,NSs在加快细胞迁移速度方面强于NSRs和NLRs。观察不同形貌的MSNs对细胞活力的改变时发现,NSs的细胞毒性低于NSRs状,而NSRs稍低于NLRs。综上所述,NLRs更容易被细胞摄取,即当其他条件相同时,AR越大,MSNs被细胞摄取的数量越多,这对提高颗粒的细胞摄取具有重要意义;同时,AR大的MSNs对细胞骨架与迁移也可产生显著的影响。因此,纳米粒不应仅仅视为简单的生物医药载体,而可为设计出有效的药物传递纳米载体、治疗体系和深入了解纳米毒理学提供理论依据。
3 特殊形貌的介孔二氧化硅药物传递系统
空心结构的MSNs近期成为了研究热门,如内部完全中空型(Hollow)、内部有部分空穴的摇铃型(Rattle type)或蛋黄-蛋壳型(Yolk-shell type)的MSNs等[20-23]。自2010年以来,尽管MSNs在药物传递方面的应用已被深入研究,但如何提高其载药量和体内靶向效率,同时减少对正常组织的副作用仍是一个巨大的挑战[24]。与传统的MSNs相比,空心结构的MSNs内部具有空穴结构,还有密度低、比表面积大的优点,内部空腔可以在装载更多药物的同时发挥缓释的作用[25-26]。
3.1 多层结构MSNs
Huang CC等[27]利用聚(苯乙烯-苯乙烯磺酸钠)纳米核(PS),通过“内保护外钝化”的策略制备了多层结构MSNs,且可通过改变核大小及刻蚀时间等来调控壳与壳之间的距离[27]。该多层结构可用作成像探针、载药及多种药物的共同传递,丰富了多功能纳米载药体系。
3.2 蛋黄-蛋壳型MSNs
Dong C等[28]通过结构选择性刻蚀技术制备了以四氧化三铁或金纳米粒子为核、介孔二氧化硅为外壳的蛋黄-蛋壳型MSNs。该复合纳米材料的透射电子显微镜(TEM)图见图1[29]。该复合纳米材料不仅可以用于诊断和治疗多种疾病,还可以实现药物的靶向和控制释放。
3.3 摇铃型MSNs
Li L等人[30]制备了摇铃型MSNs(SN),并将其作为疏水性抗肿瘤药物多烯紫杉醇(Docetaxel)的载体。该SN的药物传递系统结构见图2。该系统可用于动物体内肝癌治疗的评估,研究表明,使用该载体的肿瘤抑制率(72%)显著高于单独应用多烯紫杉醇注射剂(57%)。
3.4 介孔二氧化硅纳米管
Yang YJ等[31]选用针状碳酸钙纳米粒为无机模板,借助溶胶-凝胶法制备介孔二氧化硅纳米管(MSNTs)、氨基化介孔二氧化硅纳米管(NH2-MSNTs)及量子点修饰的氨基化介孔二氧化硅纳米管(CdS-NH2-MSNTs),通过对布洛芬的装载与释放发现,3种纳米管的载药量相当,而CdS-NH2-MSNTs是具有pH和离子响应的药物载体,更加有利于药物传递的控制和疾病的治疗。3种纳米管的电子显微镜图见图3[31]。
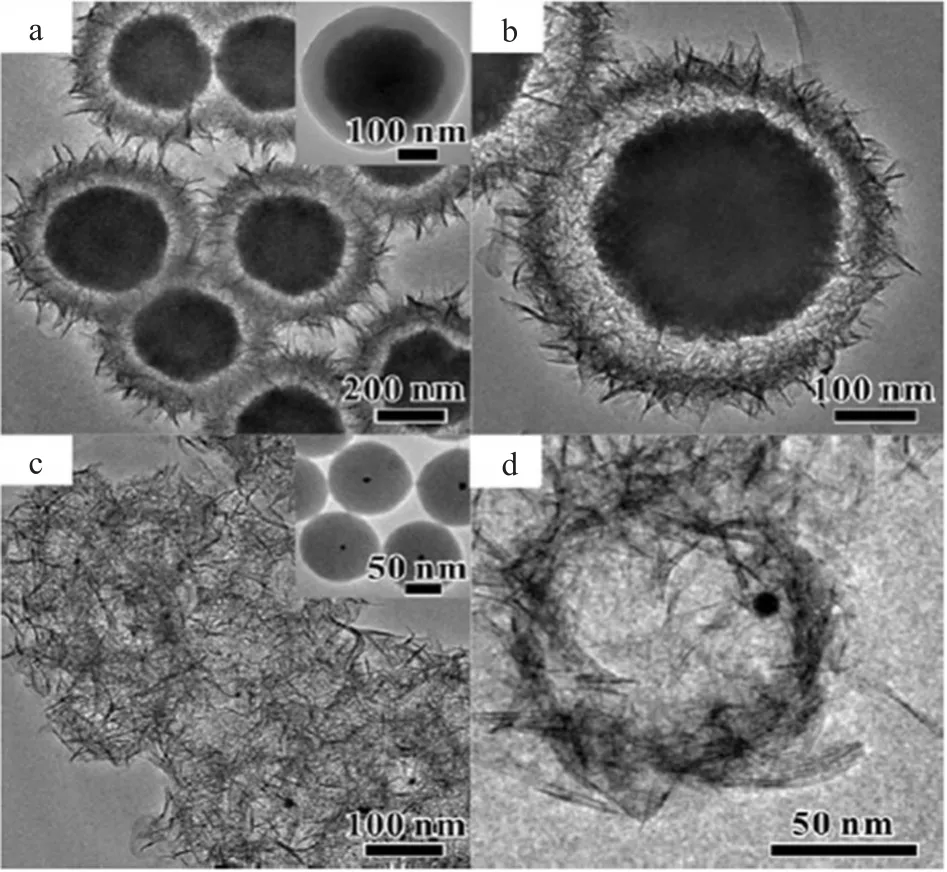
图1 TEM图

图2 SN的药物传递系统结构示意图

图3 电子显微镜图
3.5 特殊形貌的MSNs的体内行为
目前,关于特殊形貌的MSNs的体内行为的研究较少。Huang CC等[27]证明了多层结构的介孔二氧化硅对细胞没有明显的毒性。Liu T等[32]连续14 d给小鼠静脉注射中空介孔二氧化硅纳米粒(MHSN)后发现,MHSN具有低毒性;且借助ICPOES和TEM观察到MHSN主要分布在肝脏和脾脏的单核巨噬细胞中;此外,发现这些颗粒从身体中全部排泄至少需要4周的时间。
4 结语
以上研究均可证实,形貌对介孔二氧化硅的体内行为是有影响的。介孔二氧化硅不再是单一的球型,而可被改造成棒状、内部完全中空或内部有部分空穴等其他一些特殊的形貌,从而具有高载药量、高抑瘤率、高细胞摄取率等优点。这一发现也给其他材料的研究提供了启发。介孔二氧化硅与细胞之间的相互作用受颗粒的粒径、形貌、化学组成和表面电荷的影响,针对以上问题,建议未来的研究重点应是将这些结构参数相结合,以设计出更适用于临床诊断和治疗的介孔二氧化硅。因此,只有充分认识介孔二氧化硅的性质和特点等,结合某些药物靶向性差、毒性大、消除速率快等自身特点,对其进行正确的改造才能使其在药学、临床上发挥更大的作用。
[1]陈日来,李玉珍,李衡梅,等.介孔二氧化硅纳米材料的皮肤安全性研究[J].中国药房,2014,25(41):3 878.
[2]Hu L,Sun H,Zhao Q,et al.Multilayer encapsulated mesoporous silica nanospheres as an oral sustained drug delivery system for the poorly water-soluble drug felodipine [J].Mater Sci Eng C Mater Biol Appl,2015,doi:10.1016/ j.msec.2014.
[3] Gao Y,Chen Y,Ji X,et al.Controlled intracellular release of doxorubicin in multidrug-resistant cancer cells by tuning the shell-pore sizes of mesoporous silica nanoparticles[J].Acs Nano,2011,5(12):9 788.
[4]Wu L,Wu M,Zeng Y,et al.Multifunctional PEG modified DOX loaded mesoporous silica nanoparticle@CuS nanohybrids as photo-thermal agent and thermal-triggered drug release vehicle for hepatocellular carcinoma treatment[J].Nanotechnology,2015,26(2):025 102.
[5] Bi Y,Wu C,Xin M,et al.Facile large-scale preparation of mesoporous silica microspheres with the assistance of sucrose and their drug loading and releasing properties[J].Int J Pharm,2016,500(1/2):77.
[6]Wang Y,Zhao Q,Han N,et al.Mesoporous silica nanoparticles in drug delivery and biomedical applications[J].Nanomedicine,2015,11(2):313.
[7]Hu L,Sun C,Song A,et al.Alginate encapsulated mesoporous silica nanospheres as a sustained drug delivery system for the poorly water-soluble drug indomethacin[J].Asian J Pharm Sci,2014,9(4):183.
[8]Chan MH,Lin HM.Preparation and identification of multifunctional mesoporous silica nanoparticles for in vitro and in vivo dual-mode imaging,theranostics,and target-ed tracking[J].Biomaterials,2015,doi:10.1016/j.Biomaterials.2014.12.034.
[9]Tsai CH,Chang WC,Saikia D,et al.Functionalization of cubic mesoporous silica SBA-16 with carboxylic acid via one-pot synthesis route for effective removal of cationic dyes[J].J Hazard Mater,2016,doi:10.1016/j.jhazmat.2015.08.051.
[10]Shen J,He Q,Gao Y,et al.Mesoporous silica nanoparticles loading doxorubicin reverse multidrug resistance:performance and mechanism[J].Nanoscale,2011,3(10):4 314.
[11]Zhao Q,Liu J,Zhu W,et al.Dual-stimuli responsive hyaluronic acid-conjugated mesoporous silica for targeted delivery to CD44-overexpressing cancer cells[J].Acta Biomater,2015,doi:10.1016/j.actbio.2015.05.010.
[12] Chang D,Gao Y,Wang L,et al.Polydopamine-based surface modification of mesoporous silica nanoparticles as pH-sensitive drug delivery vehicles for cancer therapy[J].J Colloid Interface Sci,2016,doi:10.1016/j.jcis.2015.11.001.
[13]Karaman DS,Desai D,Senthilkumar R,et al.Shape engineering vs organic modification of inorganic nanoparticles as a tool for enhancing cellular internalization[J].Nanoscale Res Lett,2012,7(1):358.
[14] Lin X,Zhao N,Yan P,et al.The shape and size effects of polycation functionalized silica nanoparticles on gene transfection[J].Acta Biomater,2015,doi:10.1016/j.actbio.2014.09.004.
[15]Zhang P,Wu T,Kong JL.In situ monitoring of intracellular controlled drug release from mesoporous silica nanoparticles coated with pH-responsive charge-reversal polymer[J].Acs Appl Mater Interfaces,2014,6(20):17 446.
[16]Huang X,Li L,Liu T,et al.The shape effect of mesoporous silica nanoparticles on biodistribution,clearance,and biocompatibility in vivo[J].Acs Nano,2011,5(7):5 390.
[17]Li L,Liu T,Fu C,et al.Biodistribution,excretion,and toxicity of mesoporous silica nanoparticles after oral administration depend on their shape[J].Nanomedicine,2015,11(8):1 915.
[18]肖轩昂.不同形貌的磁-介孔二氧化硅纳米粒子的细胞内吞及内吞机制研究[D].长春:吉林大学,2014.
[19]Huang X,Teng X,Chen D,et al.The effect of the shape of mesoporous silica nanoparticles on cellular uptake and cell function[J].Biomaterials,2010,31(3):438.
[20] Liu J,Luo Z,Zhang J,et al.Hollow mesoporous silica nanoparticles facilitated drug delivery via cascade pH stimuli in tumor microenvironment for tumor therapy[J].Biomaterials,2016,doi:10.1016/j.biomaterials.2016.01.008.
[21]Zhang Y,Ang CY,Li M,et al.Polymeric prodrug grafted hollow mesoporous silica nanoparticles encapsulating NIR absorbing dye for potent combined photothermalchemotherapy[J].Acs Appl Mater Interfaces,2016,8(11):6 869.
[22]Lan F,Hu H,Jiang W,et al.Synthesis of superparamagnetic Fe3O4/PMMA/SiO2nanorattles with periodic mesoporous shell for lysozyme adsorption[J].Nanoscale,2012,4(7):2 264.
[23] Chen Y,Wang Q,Wang T,et al.One-pot synthesis of M (M=Ag,Au)@SiO2yolk-shell structures via an organosilane-assisted method:preparation,formation mechanism and application in heterogeneous catalysis[J].Dalton Trans,2015,44(19):8 867.
[24]Vallet-Regi M,RámilaA,Real RPD,et al.Anew property of MCM-41:drug delivery system[J].Chem Mater,2000,13(2):308.
[25] Luo Z,Hu Y,Cai K,et al.Intracellular redox-activated anticancer drug delivery by functionalized hollow mesoporous silica nanoreservoirs with tumor specificity[J].Biomaterials,2014,35(27):7 951.
[26] Xu H,Zhang H,Wang D,et al.A facile route for rapid synthesis of hollow mesoporous silica nanoparticles as pH-responsive delivery carrier[J].J Colloid Interface Sci,2015,doi:10.1016/j.jcis.2015.03.057.
[27] Huang CC,Huang W,Yeh CS.Shell-by-shell synthesis of multi-shelled mesoporous silica nanospheres for optical imaging and drug delivery[J].Biomaterials,2011,32(2):556.
[28]Dong C,Li L,Tang F,et al.Facile and scalable synthesis of tailored silica“nanorattle”structures[J].Advanced Materials,2009,21(37):3 804.
[29]Zheng J,Wu BH,Jiang ZY,et al.General and facile syntheses of metal silicate porous hollow nanostructures[J].Chem Asian J,2010,5(6):1 439.
[30] Li L,Tang F,Liu H,et al.In vivo delivery of silica nanorattle encapsulated docetaxel for liver cancer therapy with low toxicity and high efficacy[J].Acs Nano,2010,4 (11):6 874.
[31] Yang YJ,Tao X,Hou Q,et al.Fluorescent mesoporous silica nanotubes incorporating CdS quantum dots for controlled release of ibuprofen[J].Acta Biomater,2009,5(9):3 488.
[32]Liu T,Li L,Teng X,et al.Single and repeated dose toxicity of mesoporous hollow silica nanoparticles in intravenously exposed mice[J].Biomaterials,2011,32(6):1 657.
R944.9
A
1001-0408(2016)25-3582-04
10.6039/j.issn.1001-0408.2016.25.38
2016-04-09
2016-07-14)
(编辑:刘明伟)
*硕士研究生。研究方向:缓控释制剂、中药体内代谢、中药新药研发。E-mail:3092904188@qq.com
教授,博士。研究方向:缓控释制剂、中药体内代谢、中药新药研发。电话:0451-87266988。E-mail:15159267@qq.com
