大鼠球结膜滤过泡模型中转化生长因子β1及转化生长因子β2动态表达的实验研究△
2016-10-26王玲杨丽萍刘梦迎王大博
王玲 杨丽萍 刘梦迎 王大博
大鼠球结膜滤过泡模型中转化生长因子β1及转化生长因子β2动态表达的实验研究△
王玲杨丽萍*刘梦迎王大博
目的建立大鼠球结膜滤过泡模型,观察滤过泡形成及瘢痕化过程中结膜及结膜下组织转化生长因子β1(TGF-β1)及转化生长因子β2(TGF-β2)的动态表达情况,探讨TGF-β1及TGF-β2在滤过泡瘢痕化中的作用。方法选用健康成年雄性SD大鼠64只,随机选取8只作为正常对照组,其余56只大鼠作为实验组。右眼成功建立球结膜滤过泡模型。将实验组平均随机分为7组,每组8只,术后观察滤过泡的形成情况,监测眼压波动情况;并于术后各时间点分别处死,分别采用免疫荧光组织化学及Western印迹法检测术区TGF-β1及TGF-β2的表达部位及动态表达量的变化。结果①所观察术眼在术后第1天均能形成不同程度隆起明显的滤过泡。滤过泡生存时间为7~22 d,平均13 d。②所观察术眼在术后眼压均明显下降,后缓慢上升。平均于术后7 d时回归术前基线水平,保持至观察期结束。③免疫荧光组织化学结果显示在滤过泡结膜组织上皮层、固有层均可见到TGF-β1及TGF-β2强阳性表达。④Western印迹法结果显示TGF-β1在术后1 d开始明显增高,持续增高至术后5、7 d达峰值,随后逐渐降低至术后28 d,但仍高于对照组,差异具有统计学意义(F=431.918 ,P<0.01)。TGF-β2在术后1 d开始明显增高,持续增高至术后7 d达峰值,随后逐渐降低至术后28 d,但仍高于对照组,差异具有统计学意义(F= 674.323,P<0.01)。结论前房引流管植入术可成功建立大鼠球结膜滤过泡模型。TGF-β1及TGF-β2参与了球结膜滤过泡的形成及瘢痕化进程。(中国眼耳鼻喉科杂志,2016,16:313-318)
青光眼滤过性手术;转化生长因子β1;转化生长因子β2;瘢痕化;大鼠
青光眼是一组以视神经萎缩和视野缺损为共同特征的疾病,病理性眼压增高是其发生、发展的重要危险因素。青光眼滤过性手术是当前公认降低眼压最理想的干预措施,但其失败率依然达10%~30%[1]。目前研究[2]显示,青光眼滤过区滤过泡消失主要是由于伤口周围成纤维细胞大量增殖造成的。细胞外基质(extracellular matrix,ECM)是存在于细胞间的动态网状结缔组织,在病理情况下,ECM的原有平衡也会被打破,在炎症反应、新生血管生成、肿瘤局部浸润及远处转移的病理进程中起到重要作用。转化生长因子β(transforming growth factor β,TGF-β)能够特异性增加ECM的合成,刺激胶原蛋白、层粘连蛋白和纤连蛋白等分泌增加,同时抵制其降解酶的活化,减少ECM降解,促使ECM 沉积[3]。TGF-β通过对炎症细胞和成纤维细胞强烈的趋化、吸引作用,使得这些细胞创伤局部大量聚集,增强炎症反应。TGF-β还可以刺激成纤维细胞分泌纤维粘连蛋白,并增加它们在ECM 中积聚[4]。
为进一步研究青光眼滤过术后滤过泡形成及瘢痕化进程中TGF-β发挥的作用,我们通过在大鼠前房内植入引流管成功建立球结膜滤过泡模型,术后观察滤过泡形成及眼部反应,监测眼压波动情况,采用Western印迹法观察TGF-β1及TGF-β2在滤过区结膜及结膜下组织中的动态表达,并用免疫荧光组织化学检测TGF-β1及TGF-β2在滤过区的表达部位。研究TGF-β1及TGF-β2在大鼠球结膜滤过泡模型中的动态表达,为下一步青光眼术后瘢痕化的干预治疗提供理论依据。
1 材料与方法
1.1实验动物及分组选取健康成年雄性Sprague-Dawley(SD)大鼠64只,6~8周,重250~300 g。于青岛大学附属医院动物实验室(SPF级)饲养。所有鼠眼术前均经裂隙灯、直接检眼镜检查,排除眼部疾患。从中随机选取8只作为正常对照组,不做任何处理;其余56只大鼠作为实验组,并随机平均分为7组,每组8只。随机选取5只实验组大鼠,剪取大鼠滤过术区结膜及结膜下组织进行Western印迹法检测;取另3只大鼠完整眼球做冷冻切片进行免疫荧光组织化学染色。于动物实验室饲养1周后,实验眼行前房引流管植入术,成功建立大鼠球结膜滤过泡模型。
1.2球结膜滤过泡动物模型的制备将10%水合氯醛按0.3 mL/100 g的剂量腹腔注射入大鼠体内(推注不宜过快),诱导其全身麻醉;眼部滴用0.4%盐酸奥布卡因滴眼液表面麻醉,0.25%氯霉素滴眼液冲洗Tenons囊2次;0.5%聚维酮碘(碘伏)消毒术眼,范围为眼睑以外2 cm,铺无菌洞巾内。参照Sherwood等[5]前房引流管植入法,大鼠眼球颞上方角膜缘后2~2.5 mm处以角膜缘为基底做长2~3 mm的结膜瓣;剪开球结膜,钝性分离Tenons囊至巩膜面,距角膜缘约0.5 mm处用24 G胰岛素针针头穿刺巩膜进入前房;并向前房内注入黏弹剂,以维持前房。取25 G长3~4 mm的微管(硅胶管,北京医用橡胶制品研究所),将穿入前房端剪成斜面,末端为平面,保持斜面向上,沿巩膜隧道穿刺入前房。因植管与巩膜隧道连接相对紧密,不需要缝线等固定位置。植管后即可见管末端有液体流出。10-0丝线连续缝合球结膜及Tenons囊。术后结膜囊内涂红霉素眼膏。术后注意保温,待大鼠麻醉完全苏醒后,送回动物房饲养。手术操作及术后观察均由同一人完成。术后3 d内常规双眼滴用0.25%氯霉素滴眼液,2次/d,预防手术区感染。
1.3试剂和仪器立体显微镜(解剖显微镜)(OLYMUS MODEL SZ2-ILST,日本);冷冻切片机(LEICA CM1950,德国);荧光显微镜(LEICA DFC480,德国);最佳切削温度(optimal cutting temperature, OCT)包埋剂(美国樱花);电转移装置(Bio-Rad公司,美国);垂直板蛋白电泳槽(Bio-Rad公司,美国);24 G胰岛素穿刺针(日本);硅胶管(北京医用橡胶制品研究所);眼压计(陕西达明生物科技有限公司);免疫荧光一抗:兔抗大鼠单克隆抗体TGF-β1( 美国Abcam公司,按1∶100稀释成工作液)、小鼠抗大鼠单克隆抗体TGF-β2 ( 美国Abcam公司,按1∶500稀释成工作液);免疫荧光二抗:Cy3标记的山羊抗兔抗体(中国康为世纪公司,按1∶100稀释成工作液);Western一抗:兔抗大鼠单克隆抗体TGF-β1 ( 美国Abcam公司,按1∶400稀释成工作液),小鼠抗大鼠单克隆抗体TGF-β2(美国Abcam公司,1∶5 000);Western二抗:山羊抗兔抗体(中国康为世纪公司,按1∶5 000稀释成工作液);Western内参:抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)鼠单克隆抗体(中国康为世纪公司,按1∶3 000稀释成工作液);4′, 6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)(中国碧云天公司,按1∶4 000稀释成工作液)。
1.4术后一般情况的观察及处理手术后观察大鼠的一般情况及在裂隙灯显微镜下的术眼反应。术后1周内每天观察,手术1周后观察频率改为每2天1次。每次观察后双眼结膜囊内均涂布适量红霉素眼膏。
1.5正常及术后各时间点的眼压测量用Tonolab眼压计测量正常对照组及实验组各时间点的大鼠眼压(选取用于Western印迹法检测的5只大鼠眼球)。按0.3 mL/100 g体重的剂量对大鼠腹腔注射10%水合氯醛诱导全麻,眼角膜表面点用0.4%盐酸奥布卡因表面麻醉药。取Tonolab眼压计,保持测量探头水平,使其在距离角膜3~ 5 mm 的角膜顶点处与视轴的夹角在25°范围内[6]。每只观察眼均测量6次,记录所有数据。
1.6取材及标本的处理对照组的8只大鼠在购买后于实验室饲养1周处死。7个实验组大鼠,各组随机选取5只大鼠用于Western印迹法检测,同时测量各时间点大鼠眼压;另3只大鼠用于免疫组织化学染色。实验组56只大鼠于手术完成后1、3、5、7、14、21、28 d分别处死。对随机选取的5只大鼠,剪取大鼠滤过区结膜及结膜下组织,用细胞裂解液提取总蛋白,利用标准蛋白含量曲线对样本定量后行Western印迹法检测;对另3只大鼠完整眼球,仔细解剖摘除后用磷酸盐缓冲液(phosphate-buffered saline, PBS)冲净血迹,OCT包埋,做冷冻切片进行免疫荧光组织化学染色。
1.7Western印迹法测各样本TGF-β1及TGF-β2表达各样本使用等量总蛋白进行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳,蛋白印迹转至聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜上。封闭液置室温封闭1 h。加入一抗稀释液;兔抗大鼠单克隆抗体TGF-β1(1∶400)或小鼠抗大鼠单克隆抗体TGF-β2(1∶5 000),室温孵育2 h。PBS-T漂洗,每次10 min,共3次。再加入二抗;山羊抗兔抗体(1∶5 000),室温孵育1 h。PBS-T漂洗,每次10 min,共3次。采用增强的化学发光法显迹,在柯达感光底片上曝光1 min,保存分析结果。每个标本在实验中至少重复检测3次。将显影后X线片扫描成图片后,应用凝胶图像分析系统对蛋白条带进行灰密度值读数,数值以测得GAPDH的灰度扫描为基线水平。
1.8免疫荧光化学染色检测各样本MMP-2及TIMP-2表达摘除大鼠眼球,用PBS冲净眼球上的血迹,用OCT 包埋后,置于冷冻切片机切片(6 μm)。4%多聚甲醛固定15 min,PBS-T缓冲液冲洗2次,阻断液(5%BSA,PBS-T,0.5%TritonX-100)室温封闭30 min;加入按说明书说明的以及根据预实验结果稀释至适当浓度一抗工作液:兔抗大鼠单克隆抗体TGF-β1(1∶100)、小鼠抗大鼠单克隆抗体TGF-β2(1∶500),4 ℃孵育(阴性对照一抗加PBS)过夜;PBS-T缓冲液漂洗3次;加入二抗:Cy3标记的山羊抗兔抗体(1∶100),37 ℃恒温箱孵育1 h(从二抗孵育开始注意避光);PBS-T缓冲液漂洗3次;DAPI(1∶4 000)染核5 min,缓冲液漂洗后用荧光显微镜观察拍照。
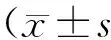
2 结果
2.1术后大鼠全身一般情况和眼前节情况术后大鼠全身一般情况良好,饮食正常,精神尚佳,活动灵活。眼前节情况:眼睑无明显红肿,结膜囊干净,球结膜切口对合好,缝线在位。滤过泡完整无渗漏,呈不同程度隆起。角膜透明,无明显水肿及上皮缺损。前房深度正常,无出血,房水中可见不同程度的房水闪辉和房水细胞,均在术后2~4 d内消失。瞳孔圆形居中,光反应良好。晶状体透明。
2.2结膜滤过泡形成情况以手术后有无形成结膜滤过泡作为判断手术效果的标准[2]。观察组术眼在术后第1天均能形成不同程度隆起明显的滤过泡。滤过泡维持时间为7~22 d,平均生存时间是13 d。4~5 d滤过泡表面开始出现血管化。
2.3正常及术后眼压情况用Tonolab眼压计测量正常组大鼠眼压及实验组大鼠球结膜滤过泡模型制作术后的眼压情况,测量结果见图1。利用SPSS17.0进行各组间眼压值单因素方差分析:F=4.382,P=0.007,各组间眼压相比差异具有统计学意义。组间两两相比:术后1、3、5 d眼压低于正常组,术后1 d眼压与正常组相比差异具有统计学意义(P=0.004),术后3、5 d眼压与正常组相比差异有统计学意义(P=0.011、0.036);术后7、14、21、28 d眼压与正常组相比差异均无统计学意义(P=0.900、1.000、0.974、0.988)。
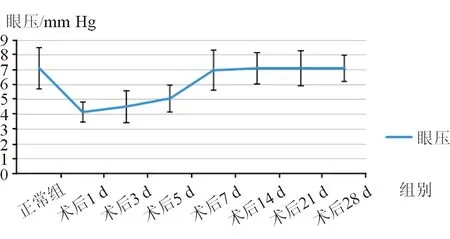
图1. 正常及青光眼滤过泡模型制作术后各组眼压情况
2.4Western印迹法检测TGF-β1及TGF-β2的表达术后不同时间点大鼠结膜及结膜下组织TGF-β1及TGF-β2的表达情况(图2)。
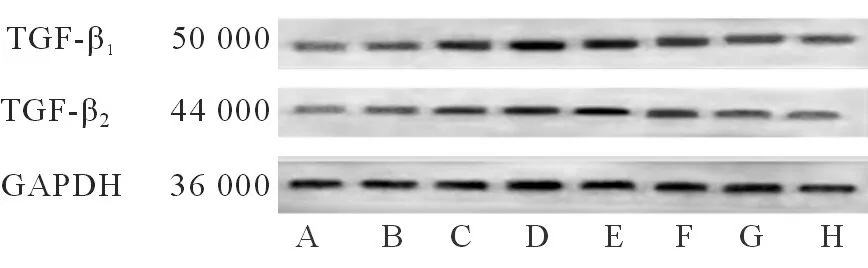
图2. Western印迹法TGF-β1及TGF-β2的水平表达
术后实验组中TGF-β1随手术后时间变化呈明显峰型变化,术后1 d即明显增加,术后5、7 d表达量达到峰值,以后呈现降低趋势,但仍高于正常对照组(图3)。各组间比较差异具有统计学意义(F=431.918,P=0.000),术后不同时间点TGF-β1蛋白相对表达量与术前相比差异均具有统计学意义(P=0.000)。实验组滤过术后不同时间点间两两比较结果显示,TGF-β1含量在术后1 d与术后28 d以及术后5 d和术后7 d间的差异无统计学意义(P=0.097、0.621),其余两时间点间比较差异均具有统计学意义。
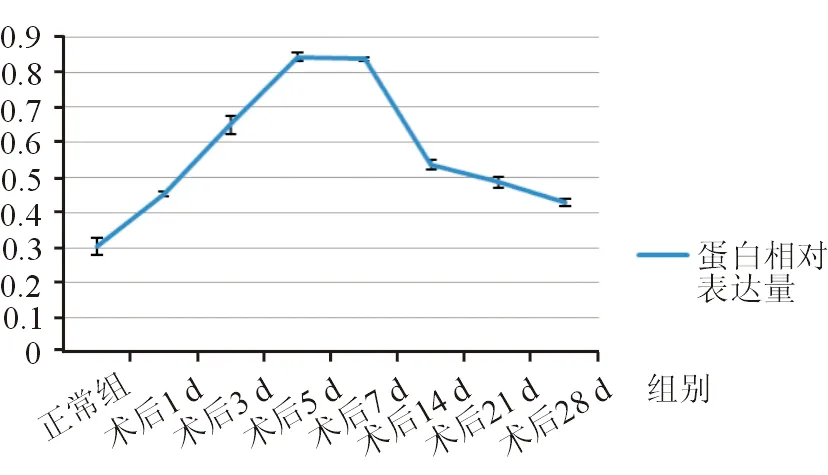
图3. Western印迹法检测大鼠滤过术区组织中TGF-β1蛋白相对表达量
术后实验组中TGF-β2随手术后时间变化呈明显峰型变化,术后1 d即明显增加,术后7 d表达量达到峰值,以后呈现降低趋势,但仍高于正常对照组(图4)。各组间比较差异具有统计学意义(F=674.323,P=0.000)。术后不同时间点TGF-β2蛋白相对表达量与术前相比差异均具有统计学意义(P=0.000)。实验组滤过术后不同时间点间两两比较结果显示,TGF-β2含量在术后1 d与术后28 d间差异无统计学意义(P=0.779),其余2个时间点间比较差异均具有统计学意义。
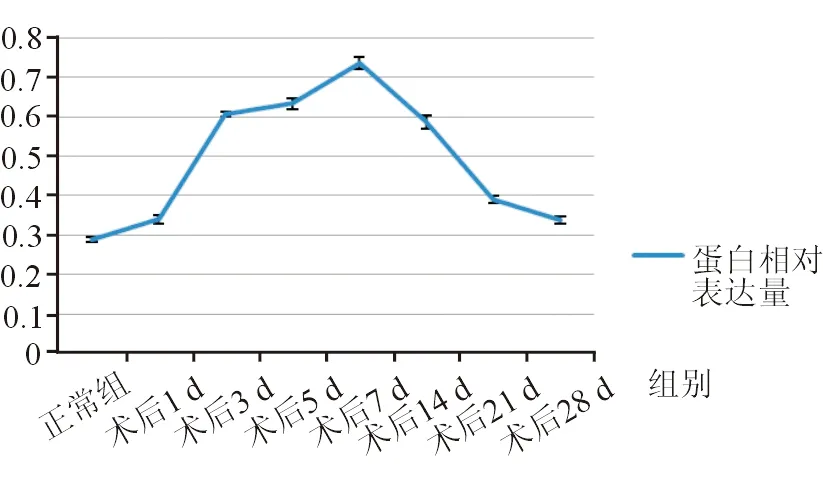
图4. Western印迹法检测大鼠滤过术区组织中TGF-β2蛋白相对表达量
2.5免疫荧光组织化学检测TGF-β1及TGF-β2的表达正常组织及滤过泡组织中TGF-β1的表达结果显示,正常对照组:在正常结膜组织中可观察到TGF-β1在结膜上皮层有较弱阳性表达,固有层基本无表达;实验组:术后7、28 d显示TGF-β1在滤过泡结膜组织上皮层、固有层,可见到强阳性表达(图5)。正常组织及滤过泡组织中TGF-β2的表达结果显示,正常对照组:TGF-β2正常组织结膜上皮层见较弱阳性表达,固有层基本无表达;实验组术后7、28 d显示TGF-β2在滤过泡结膜组织上皮层、固有层可见到强阳性表达(图6)。
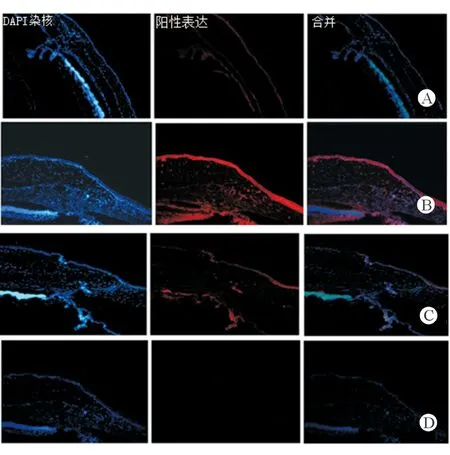
图5. 正常组织及滤过泡组织中TGF-β1的表达(免疫荧光化学染色×100倍) A为正常对照组:在正常结膜组织中可观察到TGF-β1在结膜上皮层有较弱阳性表达,固有层基本无表达;B为术后7 d,C为术后28 d:TGF-β1在滤过泡结膜组织上皮层、固有层,可见到强阳性表达;D为阴性对照组(术后7 d一抗用PBS代替):无阳性表达
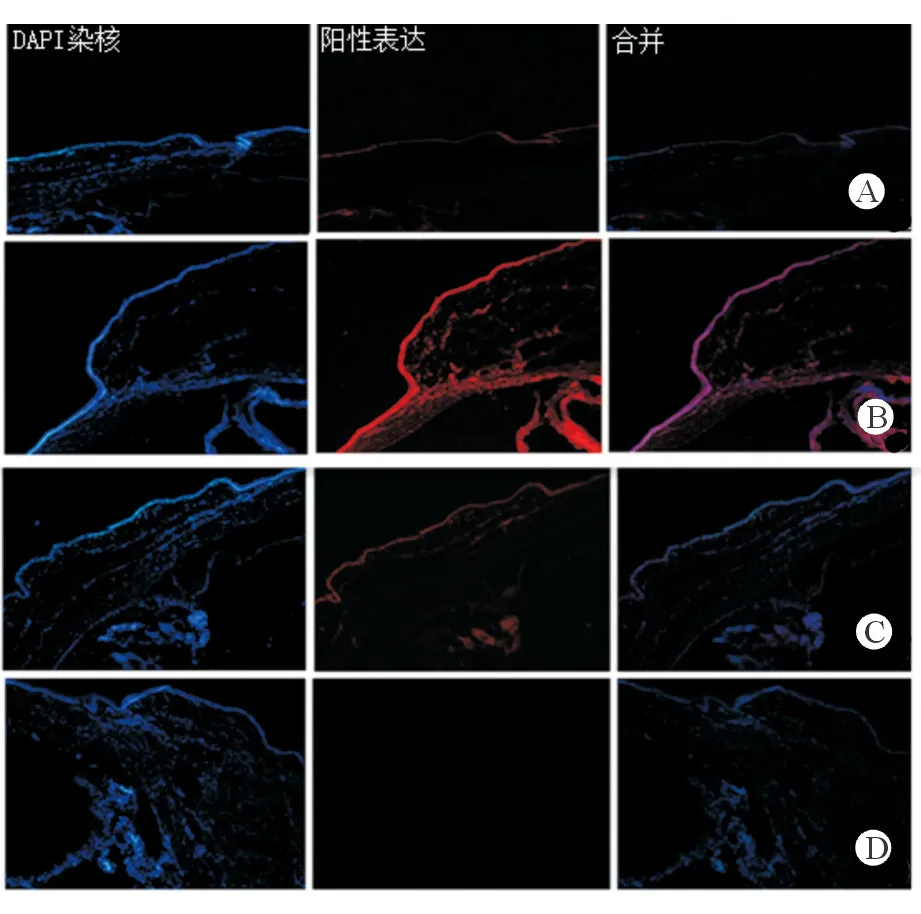
图6. 正常组织及滤过泡组织中TGF-β2的表达(免疫荧光化学染色×100倍) A为正常对照组:TGF-β2正常组织结膜上皮层见较弱阳性表达,固有层基本无表达;B为术后7 d, C为术后28 d:TGF-β2在滤过泡结膜组织上皮层、固有层,可见到强阳性表达;D为阴性对照组(术后7 d一抗用PBS代替):无阳性表达
3 讨论
我们采用前房引流管植入术成功制作大鼠球结膜滤过泡模型。与正常组大鼠眼压相比,大鼠滤过术后1 d眼压明显降低,后呈现缓慢上升趋势,直至术后7 d时达到正常眼压水平并一直保持稳定。Sherwood等[5]在SD大鼠眼前房内植入30 G硅胶管将房水引流至结膜下,制作大鼠球结膜滤过泡瘢痕化模型,结果显示滤过术后眼压迅速下降,术后5~6 d时恢复至术前平均水平。本实验研究大鼠术后眼压回归术前基线水平长于以上研究的原因:可能在于本实验所用硅胶管为24 G,略粗于30 G,因此滤过道较为粗大,滤过更为通畅,滤过道因周围组织瘢痕化而完全闭合所需时间相对较长。
本研究中采用免疫荧光组织化学观察了正常大鼠及球结膜滤过泡模型中球结膜及结膜下组织中TGF-β1及TGF-β2的表达部位。结果显示,TGF-β1及TGF-β2表达部位基本一致,在正常结膜组织中只有结膜上皮层有弱阳性表达,固有层基本无表达;而在滤过泡模型的结膜组织上皮层、固有层均可见到强阳性表达。术后7 d球结膜滤过泡弥散隆起,结膜下组织疏松,可见强阳性表达弥散分布;术后28 d球结膜滤过泡不明显,结膜下致密结缔组织也可见到阳性表达。Western印迹法检测TGF-β1及TGF-β2在滤过区结膜及结膜下组织中的动态表达,结果显示两者呈明显峰型变化,术后1 d表达量显著升高,术后7 d表达量最高,其后呈现逐渐降低趋势,但仍高于正常对照组。手术操作本身可导致血-房水屏障的破坏,血浆及血小板分泌释放TGF-β前体至伤口周围,同时手术区局部组织亦可分泌TGF-β,因此出现术后1 d的TGF-β局部表达量明显增加。滤过术区局部高浓度的TGF-β刺激滤过术区结膜囊成纤维细胞,使其分泌TGF-β的功能上调;然后滤过术区活化的单核细胞及巨噬细胞等开始分泌TGF-β。因此创伤初期阶段局部TGF-β浓度持续上升,至7 d时达峰值。
学者们试图以TGF-β抗体来干预青光眼滤过术后瘢痕的形成,预期达到延长滤过泡寿命的效果,做了相关研究[7-9]。在动物模型研究中,应用抗TGF-β2抗体时没有发现严重并发症,对周围组织也没有产生明显毒副作用,组织耐受性好[10-13]。Siriwardena等[9]将人TGF-β2单克隆抗体CAT-152用于临床试验,在手术即刻的前后,手术后1、7 d结膜下分别注射CAT-152或安慰剂,经过手术后12个月的随访,发现实验组青光眼滤过泡形态弥散、滤过泡组织无囊变及无血管化;眼压降低的程度在手术后3个月和6个月最为明显;2组间手术并发症的发生率无显著性差异,且实验组也没有发生与CAT-152应用相关的严重副作用。根据该实验结果,他们认为CAT-152在青光眼滤过术后抗瘢痕化形成中能够发挥全新、有效的作用,在临床应用中具有乐观的发展空间。初步的实验结果着实令人鼓舞,因此吸引了更多学者参与CAT-152的抗瘢痕化研究中,然而另有学者[14-15]所做CAT-152的Ⅲ期临床试验并未得到人们所期待的结果,研究显示CAT-152对青光眼患者滤过术后预防滤过术失败并无明显作用。分析既然TGF-β可促进滤过泡的瘢痕形成,但抑制TGF-β后并没有提高滤过手术的成功率,这可能与其复杂的生物学特性及多种细胞因子参与滤过泡的瘢痕形成有关。因此,有必要采用系列研究进一步探讨滤过泡的形成及瘢痕化进程中结膜及结膜下组织TGF-β的动态表达及滤过泡形态学改变的相关性。在前期研究中,我们采用前房引流管植入术成功制作大鼠球结膜滤过泡模型,发现术后1周左右,滤过泡表现出活跃的创伤愈合反应;而在2周内创伤修复中的瘢痕形成最为关键,成纤维细胞增生活跃,致使瘢痕化形成。在本研究滤过泡结膜及结膜下组织TGF-β的动态表达中,我们也发现术后1周左右,TGF-β1及TGF-β2的表达达高峰,与术区成纤维细胞的增生及胶原纤维的堆积密切相关且相一致。本研究从TGF-β的角度入手,寻求抑制青光眼滤过术后瘢痕形成的新治疗手段或新干预药物,提供了坚实的理论基础。
[1]Melamed S, Fiore PM. Molteno implant surgery in refractory glaucoma[J]. Surv Ophthalmol, 1990, 34 (6):441-443.
[2]Chang L, Crowston JG, Cordeiro MF, et al. The role of the immune system in conjunctival wound healing after glaucoma surgery[J]. Surv Ophthalmol, 2000, 45(1):49-68.
[3]Eisenstein R, Grant-Bertacchini D. Growth inhibitory activities in avascular tissues are recognized by anti-transforming growth factor beta antibodies[J]. Curr Eye Res, 1991, 10(2):157-62.
[4]Corderio MF. Beyond Mitomycin: TGF- and wound healing [J]. Prog Retin Eye Res, 2002, 21(1):75-89
[5]Sherwood MB, Esson DW, Neelakantan A,et al. A new model of glaucoma filtering surgery in the rat[J]. J Glaucoma, 2004, 13(5): 407-412.
[6]Kontiola AI, Goldblum D, Mittag T, et al. The induction/impact tonometer: a new instrument to measure intraocular pressure in the rat[ J] . Exp Eye Res, 2001, 73( 6) :781- 785.
[7]Pena RA, Jerdan JA, Glaser BM.Effects of TGF-beta and TGF-beta neutralizing antibodies on fibroblast-induced collagen gel contraction: implications for proliferative vitreoretinopathy[J].Invest Ophthalmol Vis Sci,1994,35(6):2804-2808.
[8]Cordeiro MF,Gay JA,Khaw PT.Human anti-transforming growth factor-beta2 antibody:a new glaucoma anti-scarring agent[J].Invest Ophthalmol Vis Sci,1999,40(10):2225-2234.
[9]Siriwardena D,Khaw PT,King AJ,et a1.Human antitransforming growth factor-beta(2) monoclonal antibody-a new modulator of wound healing in trabeculectomy:a randomized placebo controlled clinical study[J].Ophthalmology, 2002,109(3):427-431.
[10]Cordeiro MF,Gay JA,Khaw PT.Human anti-Transforming growth factor-bata2 antibody:a new glaucoma anti-scarring agent[J].Invest Ophthalmol Vis Sci , 1999, 40(12):2225-2232.
[11]Mead AL ,Wong TT,Cordeiro MF,et a1.Evaluation of anti-TGF-beta2 antibody as a new postoperative anti-scarring agent in glaucoma surgery[J].Invest Ophthalmol Vis Sci ,2003,44(8):3394-340l.
[12]Wong TT,Mead AL,Khaw PT.Prolonged antiscarring effects of ilomastat and MMC after experimental glaucoma filtration surgery[J]. Invest Ophthalmol Vis Sci, 2005,46(6):20l8-2022.
[13]Siriwarden D,Khaw PT,Kinq AJ,et a1.Human antitransforming growth factor beta(2) monoclonal antibody--a new modulator of wound healing in trabeculectomy:a randomized placebo controlled clinical study[J]. Ophthalmology ,2002,109(3):427-43l.
[14]Mead AL,Wong TT,Cordeiro MF,et a1.Evaluation of anti-TGF-beta 2 antibody as a new postoperative anti-scarring agent in glaucoma surgery[J].Invest Ophthalmol Vis Sci,2003,44(8):3394-3401.
[15]CAT-152 0102 Trabeculectomy Study Group,Khaw P,Grehn F,et a1.A phase III study of subconjunctival human anti-transforming growth factor beta(2)monoclonal antibody(CAT-152)to prevent scarring after first-time trabeculectomy[J] .Ophthalmology,2007,114(10):1822-1830.
(本文编辑 诸静英)
Dynamic expression of transforming growth factor β1 and transforming growth factor β2 in conjunctival filtering bleb of rats
WANGLing,YANGLi-ping*,LIUMeng-ying,WANGDa-bo.
DepartmentofOphthalmology,AffiliatedHospitalofMedicalCollege,QingdaoUniversity,Qingdao266003,China
WANG Ling, Email: tsingtaowl@hotmail.com
ObjectiveTo establish a model of conjunctival filtering bleb in rats and to observe the expression and discuss the effects of transforming growth factor β1 (TGF-β1) and transforming growth factor β2(TGF-β2) in conjunctival and subconjunctival tissue in the filtering bleb formation and scarring. MethodsSixty-four healthy and adult male SD rats were included. Eight rats were randomly selected as the normal control group. The remaining 56 rats were chosen as the experimental group, whose right eyes were established conjunctival bleb model by anterior chamber drainage tube implantation.The experimental group was randomly divided into 7 subgroups. The formations of filtering bleb were observed, and the intraocular pressure fluctuations were monitored after the surgery. The expression and sites of TGF-β1 and -β2 were detected by semi-quantitative Western blot analysis and immunofluorescent staining . Results①Different extents and obviously bulgy filtering blebs can be formed in all the eyes of the rats on the first day after the surgery. All the filtering blebs maintained 7~22 days, with average of 13 days. ②All the intraocular pressures of the eyes declined obviously right after surgery, then slowly rose. The intraocular pressures returned to preoperative level on the 7th day after the surgery on average,and kept normal to the end of the observation period. ③The results of immunofluorescent staining showed that TGF-β1 and -β2 were found to be expressed in conjunctival epitheliumin and subconjunctival tissue in the conjunctival filtering bleb tissue. ④Results of Western blot showed that TGF-β1 began to rise on the first day after the surgery, and kept rising to the peak on the 5th day or 7th day after the surgery, then gradually reduced until 28 days after the surgery, but still higher than that in the control group. There was significant difference between the two groups (F=431.918 ,P<0.01). TGF-β2 began to rise on the first day after the surgery, and kept rising to the peak on the 7th day after the surgery, then gradually reduced until 28 days after surgery, but still higher than that in the control group. There was significant difference between the two groups (F= 674.323,P<0.01).ConclusionsThe rat model of conjunctival filtering bleb can be established by drainage tube implantation.TGF-β1 and -β2 participate in the process of conjunctival filtering bleb formation and scarring. (Chin J Ophthalmol and Otorhinolaryngol,2016,16:313-318)
Glaucoma filtering surgery;Transforming growth factor β1; Transforming growth factor β2; Scarring; Rat
山东省优秀中青年科学家科研奖励基金项目(BS2010SW008)
青岛大学附属医院眼科青岛266003;*山东省青岛市黄岛区人民医院眼科青岛266003
王玲(Email: tsingtaowl@hotmail.com)
10.14166/j.issn.1671-2420.2016.05.003
2015-10-29)
