褐飞虱IR56种群的致害特征
2016-10-25郑瑜何佳春万品俊赖凤香孙燕群林晶晶傅强
郑瑜 何佳春 万品俊 赖凤香 孙燕群 林晶晶 傅强
(中国水稻研究所 水稻生物学国家重点实验室, 杭州310006;*通讯联系人, E-mail: fuqiang@caas.cn)
褐飞虱IR56种群的致害特征
郑瑜何佳春万品俊赖凤香孙燕群林晶晶傅强*
(中国水稻研究所 水稻生物学国家重点实验室, 杭州310006;*通讯联系人, E-mail: fuqiang@caas.cn)
ZHENG Yu, HE Jiachun, WAN Pinjun, et al. Virulence characteristics ofNilaparvatalugens(Stål) reared on resistant rice variety IR56. Chin J Rice Sci, 2016, 30(5): 552-558.
含Bph3抗褐飞虱基因的水稻品种自20世纪80年代在东南亚推广后,迄今仍对褐飞虱有较好的抗性,受到我国抗褐飞虱育种专家的重视。在IR56水稻(含Bph3基因)上连续40多代胁迫饲养获得褐飞虱IR56寄主种群,从褐飞虱的生长、发育、繁殖以及水稻品种的抗感反应(SSST法测定)两方面对该种群的致害性进行了研究。结果表明:1)在抗性水稻IR56上,褐飞虱IR56种群的羽化率、初羽化成虫体质量、成虫寿命、产卵量、蜜露排泄量、体质量增量等均较褐飞虱TN1种群显著增加,若虫历期则显著缩短;与感虫水稻TN1上的IR56种群或TN1种群相比,除成虫寿命、蜜露排泄量和体质量增量显著下降外,羽化率、产卵量、卵孵化率无显著差异,初羽化成虫体质量、若虫历期尽管差异显著但数值上较接近(其差值不及IR56水稻上IR56种群与TN1种群差值的1/2)。2)水稻品种苗期抗性反应显示IR56水稻对褐飞虱IR56种群的抗性级别为7级,明显弱于对褐飞虱TN1种群的3级,但略强于TN1水稻对褐飞虱IR56种群或TN1种群的9级。显然,与褐飞虱TN1种群相比,褐飞虱IR56种群对抗性水稻IR56有较强的致害能力,与IR56种群或TN1种群对TN1水稻的强致害水平尽管有一定的差距,但多数指标较为接近。含Bph3基因的水稻品种RathuHeenati对IR56种群抗性为1级,推测可能与该水稻品种存在Bph3以外的其他抗虫基因有关。
褐飞虱; 致害性; IR56种群;Bph3基因
褐飞虱[Nilaparvatalugens(Stål)]属于迁飞性、暴发性害虫。20世纪70年代以来,开始成为我国华南及长江流域等地水稻生产上的主要害虫,给水稻生产造成了严重损失[1]。抗虫水稻品种的种植是控制褐飞虱最为经济有效的方法。1973年以来,国际水稻研究所(IRRI)相继在东南亚等地推广含抗虫基因Bph1的IR26以及含抗虫基因bph2的IR36等抗性水稻品种,但IR26、IR36分别在推广2~3年、7~8年后丧失抗性[2-4];1982年,IRRI又开始 在该地区推广含抗虫基因Bph3的IR56、IR60、IR62、IR72等抗虫水稻品种[5]。除监测到越南南部褐飞虱田间种群对抗虫水稻RathuHeenati(含Bph3基因)具较强致害性[6-7]外,这些品种迄今仍普遍在东南亚国家表现出较好的褐飞虱抗性[8]。在我国,IRRI育成的抗褐飞虱品种种植面积不大,但其衍生系被广泛用作杂交水稻的恢复系[9],其抗性丧失进程晚于东南亚。据监测,IR26等含Bph1抗虫基因的水稻品种20世纪80年代后期开始丧失抗性[2,6,10],而含bph2抗虫基因的ASD7等品种则在21世纪初丧失抗性[11-12],迄今未见Bph3抗虫基因抗性丧失的报道。
褐飞虱在抗性水稻品种的胁迫下发生致害性变异,是水稻品种丧失抗性的主要原因[13]。在含Bph1基因的Mudgo、IR26、H105或含bph2基因的ASD7、IR36、Samba等抗性品种上胁迫饲养,褐飞虱一般在10代以内就能致害相应的抗性品种[13-14],是IR26、IR36等抗性水稻品种在推广后迅速丧失抗性的关键。值得注意的是,含Bph3抗虫基因水稻品种具有相对持久的抗性,但目前关于褐飞虱对该类品种的致害性研究较少。已知田间能致害该类品种的褐飞虱种群仅见于印度Hyderabad、Guttac[15]和越南九龙江、胡志明市(可致害RathuHeenati)[6-7];尚未见饲养于其他含Bph3基因抗虫水稻的褐飞虱寄主种群的报道。
近年来,Bph3抗虫基因在我国受到重视,并得到克隆,具有良好应用前景[17],研究褐飞虱对该基因的致害性变异规律对其可持续利用具有重要意义。笔者以采自浙江省杭州市富阳区田间的褐飞虱种群为初始虫源,通过在IR56(含Bph3基因)水稻上连续40多代的胁迫饲养初步获得了褐飞虱IR56种群。本研究从褐飞虱的生长、发育、取食、繁殖及水稻品种的苗期抗感反应(SSST法)两方面开展研究,以期明确该种群的致害特性,为进一步开展褐飞虱对Bph3抗虫基因的致害性变异规律和机制研究提供依据。
1 材料与方法
1.1试验材料
供试水稻品种包括感虫品种TN1、抗虫品种IR42(含bph2基因)、IR56(含Bph3基因)和RathuHeenati(含Bph3基因,下文简称RHT)。供试昆虫为2010年10月采集于浙江省富阳区田间的褐飞虱种群,在TN1与IR56水稻品种上连续强迫饲养40代以上,分别称之为褐飞虱TN1种群和IR56种群。
1.2实验方法
1.2.1褐飞虱在不同水稻品种上的若虫期生长发育
取健壮无虫的供试稻苗(播种后45 d左右)移栽于泥盆,待稻株存活后去除老叶并洗净,每盆留2个健壮水稻分蘖,接入孵化24 h以内的褐飞虱IR56种群或TN1种群1龄若虫25头,外罩透明无毒、有透气窗的薄膜笼罩(高50 cm,直径6 cm)。逐日观察若虫发育情况,待若虫开始羽化时,将每天的羽化试虫(羽化24 h内)取出,称单头成虫鲜质量,同时记录雌雄成虫数、翅型和羽化日期,直至试虫全部羽化完全。每个处理10个重复。待试虫全部羽化后,计算试虫的羽化率、雌雄虫的若虫发育历期及雌雄虫体质量。
1.2.2褐飞虱在不同水稻品种上的成虫寿命、产卵量与卵孵化情况
每盆稻株(试苗处理同若虫期实验设计)内接入初羽化24 h内的褐飞虱IR56种群或TN1种群短翅型雌、雄成虫1对。接虫后每天观察记录雌、雄成虫的存活数和存活天数。待成虫产卵后,记录观察若虫孵化时间,随后每隔两日记录若虫数(并移除孵化若虫),直至雌虫死亡且稻苗上无若虫孵出一周后,解剖稻苗并记录未孵化卵量,统计各处理试虫的雌、雄成虫的存活天数,单雌产卵量及卵孵化率。每处理20个重复。
1.2.3褐飞虱在不同水稻品种上的单雌蜜露量与体质量增量
褐飞虱在水稻品种上的蜜露排泄量与取食量成正比,并常被用作评价褐飞虱致害性或水稻抗性的重要参数[18-20]。参照王桂荣等[3]采用的“Parafilm”小袋法,将羽化24 h内的褐飞虱IR56种群或TN1种群雌虫逐头称重(初重)并标记,每袋1头接于分蘖末期至拔节期的TN1或IR56水稻茎秆上,48 h后测定袋中蜜露排泄量和每头雌虫的体质量,该体质量与同一试虫初重之差为虫体体质量增量。每处理重复45个以上。
1.2.4不同水稻品种对褐飞虱的抗性级别
将催芽至露白的TN1、IR42、IR56、RHT水稻种子呈正方形穴播于大苗盆中(直径14 cm,高10 cm),每个品种播20~25粒正常发芽的种子,之后用细土覆盖。待秧苗长到2叶1心时,剔除弱苗,每行留18~20株健壮稻苗,按每株苗平均8~10头虫量接入TN1种群或IR56种群的2龄若虫。参照标准苗期集团筛选法(SSST法)抗性级别判别标准[21],待TN1苗受害达7级后开始每日观察稻苗的抗感反应,以TN1达9级时供试稻苗的抗性级别作为抗级结果。每处理3次重复。
1.2.5实验的温湿度条件
水稻抗性级别测定及褐飞虱若虫生长发育、成虫寿命及繁殖力试验在阳光温室中进行,温度 28.0℃±2.0℃,相对湿度80.0%±5.0%;蜜露量与体质量增量实验在培养箱中进行,温度28.0℃±0.5℃,相对湿度80.0%±5.0%。
1.2.6数据分析
采用DPS数据分析软件进行方差分析,其中百分数分析前经反正弦平方根转换[22];方差分析差异显著(P<0.05)时,再进一步对不同处理进行Duncan新复极差法多重比较。
2 结果与分析
2.1褐飞虱在不同水稻品种上的若虫期生长发育
从若虫的羽化率来看(表1),在IR56上,IR56种群为80.6%,显著高于TN1种群的7.1%(高73.5个百分点)(P<0.05);在TN1水稻上,IR56种群和TN1种群分别为85.6%和84.7%,两者无显著差异(P>0.05);TN1种群在TN1和在IR56上的羽化率有显著性差异(P<0.05)。IR56种群在IR56和TN1上的羽化率无显著差异,与TN1种群在TN1上亦无显著差异(P>0.05)。
就若虫发育历期而言(表1),在IR56上,TN1种群的雌、雄试虫的发育历期分别为19.5 d和16.1 d,较IR56种群同性试虫分别延长38.3% (5.4 d)和22.9% (3.0 d),且差异显著(P<0.05);在TN1上,TN1种群与IR56种群的同性试虫间无显著差异(P>0.05)。IR56种群在IR56稻苗上的雌、雄试虫较其在TN1稻苗上的同性试虫分别延长11.0% (1.4 d)和7.4%(0.9 d),较TN1种群在TN1苗上的同性试虫分别仅延长12.8%(1.6 d)、7.4%(0.9 d),尽管差异显著(P<0.05),但数值上相差不大。
在IR56上,TN1种群的雌、雄虫的体质量分别为1.27 mg和0.78 mg,分别较IR56种群同性试虫轻33.6% (0.64 mg)和31.6% (0.36 mg),且差异显著(P<0.05);在TN1水稻上,TN1种群与IR56种群的雌雄虫体质量之间无显著差异(P>0.05)。IR56种群在IR56上的雌雄试虫分别较其在TN1上的同性试虫减轻9.9%、10.9%,较TN1种群在TN1水稻上的同性试虫减轻7.3%、14.9%,尽管差异显著(P<0.05),但数值上相差亦不大。
表1褐飞虱IR56种群和TN1种群在TN1和IR56上若虫的生长发育与初羽化成虫鲜质量(平均值±标准误)
Table 1. Nymph developmental duration and fresh body weight of newly emerged adults of BPH of IR56 population and TN1 population that fed on TN1 and IR56, respectively(Mean±SE).
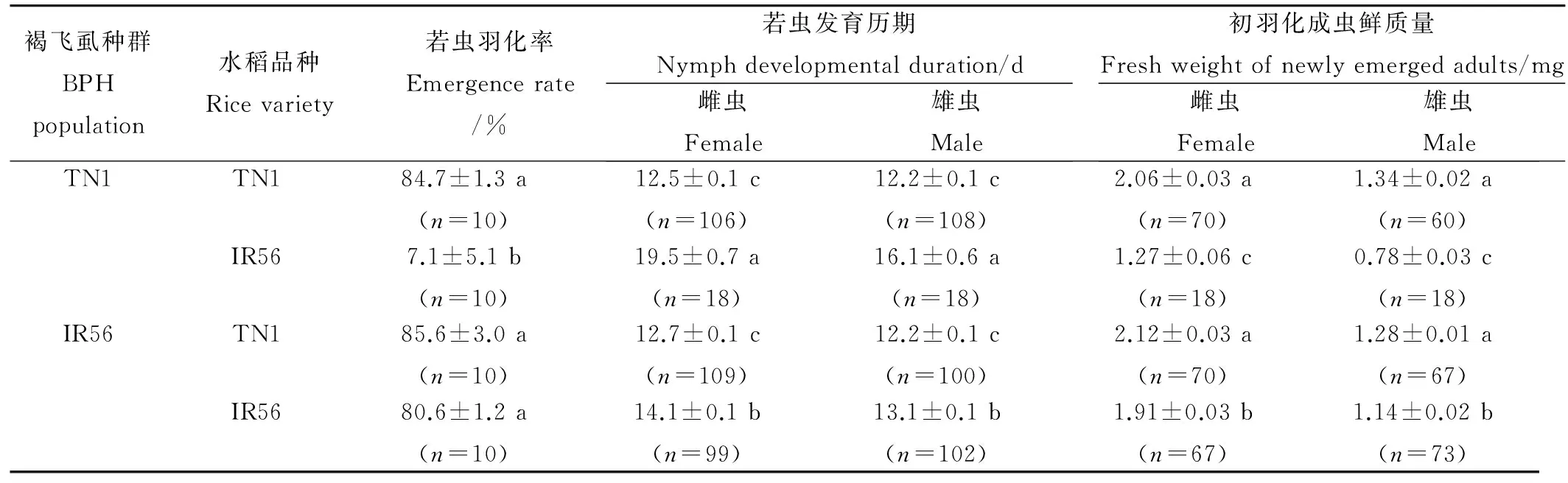
褐飞虱种群BPHpopulation水稻品种Ricevariety若虫羽化率Emergencerate/%若虫发育历期Nymphdevelopmentalduration/d雌虫Female雄虫Male初羽化成虫鲜质量Freshweightofnewlyemergedadults/mg雌虫Female雄虫MaleTN1TN184.7±1.3a(n=10)12.5±0.1c(n=106)12.2±0.1c(n=108)2.06±0.03a(n=70)1.34±0.02a(n=60)IR567.1±5.1b(n=10)19.5±0.7a(n=18)16.1±0.6a(n=18)1.27±0.06c(n=18)0.78±0.03c(n=18)IR56TN185.6±3.0a(n=10)12.7±0.1c(n=109)12.2±0.1c(n=100)2.12±0.03a(n=70)1.28±0.01a(n=67)IR5680.6±1.2a(n=10)14.1±0.1b(n=99)13.1±0.1b(n=102)1.91±0.03b(n=67)1.14±0.02b(n=73)
“n”表示样本数; 同一列数据间跟相同字母者表示不同处理间无显著差异(Duncan新复极差法,P>0.05)。表2同。
“n” indicates the sample size. The data that followed by same letters in the same column show no significant difference among different treatments (Duncan’s test,P>0.05). The same as in the Table 2.
表2褐飞虱IR56种群和TN1种群在TN1和IR56水稻品种上的成虫寿命、产卵量及卵孵化率(平均值±标准误)
Table 2. Adult longevity, number of eggs laid per female and egg hatchability of BPH of IR56 population and TN1 population that fed on TN1 and IR56 respectively (Mean±SE).

褐飞虱种群BPHpopulation水稻品种Ricevariety成虫寿命Adultlongevity/d雌虫Female雄虫Male单雌产卵量Numberofeggslaidperfemale卵孵化率Egghatchability/%TN1TN115.7±1.5ab(n=21)22.8±1.9a(n=22)378.5±32.2a(n=19)93.3±1.9a(n=19)IR565.8±0.9c(n=32)6.4±1.1c(n=25)81.4±32.8b(n=14)96.4±6.3a(n=14)IR56TN117.8±1.7a(n=24)22.8±2.2a(n=25)409.0±37.7a(n=21)85.2±5.2a(n=21)IR5612.9±1.3b`(n=29)16.3±1.9b(n=28)316.8±21.4a(n=23)86.7±5.3a(n=23)
2.2褐飞虱在不同水稻品种上的成虫寿命、产卵量及卵孵化率
在IR56上,褐飞虱IR56种群的雌、雄成虫期寿命分别为12.9 d和16.3 d,均显著长于TN1种群的同性成虫(分别长7.1 d和9.9 d,P<0.05);在TN1水稻上,两个种群的同性成虫间寿命无显著差异(P>0.05)。IR56种群在IR56上的雌雄成虫寿命均显著短于其在TN1水稻上的同性成虫(分别缩短4.9 d和6.5 d,P<0.05),且IR56种群在IR56上的雄虫寿命显著短于在TN1水稻上饲养的TN1种群同性试虫(缩短6.5 d),IR56种群在IR56上的雌虫寿命与TN1水稻上的TN1种群的雌虫间差异不显著(P>0.05)(表2)。
在IR56水稻上的单雌产卵量,IR56种群为316.8粒,显著高于TN1种群(高235.4粒,P<0.05);在TN1水稻上,IR56种群和TN1种群单雌产卵量分别为409.0粒和378.5粒,二者无显著差异(P>0.05);TN1种群在TN1水稻和IR56上的单雌产卵量有显著性差异(P<0.05)。IR56种群在IR56和TN1上的产卵量无显著差异,与TN1种群在TN1稻苗上的产卵量亦无显著差异(P>0.05);TN1种群在TN1上的单雌产卵量显著高于其在IR56上的单雌产卵量(P<0.05)。从卵孵化率来看,两个褐飞虱种群在TN1、IR56稻苗上的平均卵孵化率介于85.2%~96.4%,相互间无显著差异(P>0.05)(表2)。这一结果表明IR56抗性水稻影响褐飞虱种群的产卵但对卵孵化影响较小。
2.3褐飞虱雌虫在不同水稻品种上的蜜露排泄量与体质量增量
就48 h单雌蜜露排泄量来看(图1-A),在IR56上,IR56种群和TN1种群的蜜露量分别为18.96 mg和4.38 mg,IR56种群显著性高于TN1种群的14.58 mg(P<0.05),该差值是IR56水稻上TN1种群蜜露排泄量的3.3倍之多;在TN1水稻上,IR56种群和TN1种群分别为26.97 mg和58.61 mg,二者差异亦显著(P<0.05),TN1种群的蜜露排泄量是IR56种群的两倍之多。IR56种群在IR56水稻上的蜜露排泄量与其在TN1水稻上的无显著差异(P>0.05),但显著低于TN1种群在TN1水稻上的蜜露排泄量(P<0.05)。
从雌虫48h体质量变化来看(图1-B),在IR56上,褐飞虱IR56种群和TN1种群体质量增量分别为0.44 mg和-0.13 mg,TN1种群在IR56上的体质量变化为负增长,二者差异显著(P<0.05);在TN1水稻上,褐飞虱IR56种群和TN1种群的体质量增量比分别为0.73 mg和1.13 mg,TN1种群的体质量增量比IR56种群高54%(0.4 mg),差异达显著水平(P<0.05)。在IR56上的IR56种群雌虫的体质量增量显著低于在TN1水稻上的IR56种群和TN1种群(P<0.05)。
2.4不同水稻品种对褐飞虱的抗性级别
SSST法测定结果表明,感虫水稻品种TN1和抗虫水稻品种IR42、IR56、RHT对褐飞虱IR56种群的抗性级别分别为9级、9级、7级和1级,对褐飞虱TN1种群的抗性级别则分别为9级、9级、3级和1级。与褐飞虱TN1种群相比,褐飞虱IR56种群对IR56水稻的致害能力明显增强,而对TN1、IR42、RHT水稻的致害性无明显变化。两个褐飞虱种群对水稻品种IR42都具有强致害力,说明IR42已经基本失去抗性;而水稻品种RHT则不同,对两个褐飞虱种群仍具有高抗性。
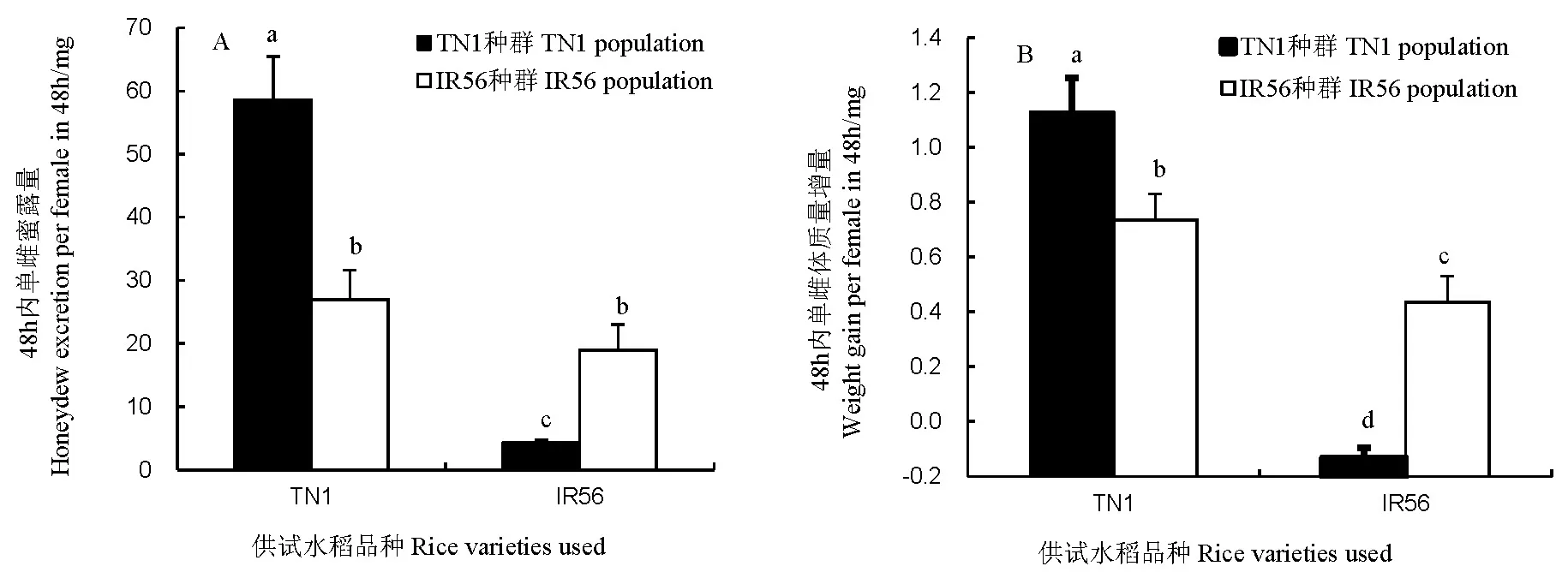
图中标有相同字母者表示不同处理间Duncan新复极差检验差异不显著 (P>0.05)。
The same lowercase letters show no significant difference among different treatments (Duncan’s test,P>0.05).
图1褐飞虱IR56种群和TN1种群雌虫在TN1和IR56水稻品种上的48 h单雌蜜露量与体质量增量(平均值±标准误)
Fig. 1. Honeydew excretion and weight gain in 48 h of the BPH females of IR56 population and TN1 population that fed on TN1 and IR56, respectively(Mean±SE).
3 讨论
本研究通过对褐飞虱IR56种群在不同抗感水稻品种上的若虫期生长发育和成虫期繁殖、取食行为以及不同水稻品种苗期对该种群的抗感反应的研究,明确褐飞虱IR56种群的致害特性:在IR56上连续40多代胁迫饲养,已经初步形成了褐飞虱IR56种群,该种群具备较强致害IR56水稻的能力,能在IR56上生长、繁殖,较好地完成世代发育,并可以通过若虫发育历期、初羽化雌雄虫体质量、蜜露排泄量、体质量增量比以及雌成虫寿命、单雌产卵量等指标与TN1种群进行明显区分。这为下一步开展褐飞虱对抗性品种IR56致害性变异机制分子生物学研究提供了重要基础。
研究中观察到,IR56水稻上IR56种群与TN1水稻上的IR56种群或TN1种群之间,羽化率、产卵量、卵孵化率无显著差异,初羽化成虫体质量、若虫历期尽管差异显著但数值上较接近(其差值不及IR56水稻上IR56种群与TN1种群差值的1/2),仅成虫寿命、蜜露排泄量和体质量增量差异明显且差距相对较大。水稻苗期品种反应显示褐飞虱IR56种群对IR56水稻的致害力为7级(感虫),亦略强于TN1种群对IR56水稻或TN1水稻的致害力(9级,高感)。由此表明褐飞虱IR56种群对抗性水稻IR56的致害力尽管在多数指标上与该种群对感虫品种TN1水稻的强致害水平接近,但仍存在一定的差距,这种差距可能并不能随着在IR56水稻上的进一步胁迫饲养而消失,是一种褐飞虱适应抗性水稻品种的“代价”。笔者还观察到,在Mudgo上饲养了180多代的褐飞虱种群的初羽化成虫体质量仍小于在TN1上饲养的试虫(未发表资料)。
本研究还发现,TN1水稻上IR56种群与TN1种群的若虫生长发育、成虫繁殖与卵孵化等指标均无显著差异,说明IR56种群与TN1种群在水稻抗性压力缺失时的生物学表现无明显差异,生活力相似;但初羽化雌虫48 h内的蜜露排泄量和体质量增量显示,TN1水稻上的IR56种群较TN1种群蜜露排泄和虫体增量明显减少,与TN1水稻上两种群雌虫寿命及产卵量无显著差异的现象并不一致。鉴于寄主经历影响褐飞虱的致害特性[23],推测IR56水稻上羽化的IR56种群雌虫转移到TN1水稻时可能有一个短期的适应过程,但该过程对整个成虫期的生物学影响并不大。
陈峰等[24]报道,褐飞虱TN1种群在水稻TN1、IR56上的产卵量差异显著,而卵孵化率无显著差异,与本研究结果一致。本研究还观察到,TN1种群在IR56水稻上的若虫羽化率降低,若虫发育延缓,初羽化成虫变轻,成虫寿命缩短,蜜露排泄量减少,推测IR56对褐飞虱的抗性主要体现于抑制了该虫的生存、取食以及产卵,而不影响卵的正常发育和孵化,但导致该现象的生理生化及分子生物学机制还不清楚,也是IR56种群对IR56水稻适应性机制不明之所在。
本研究中,含Bph3基因的水稻品种RathuHeenati(RHT)对IR56种群的抗性达1级(高抗),表明在含Bph3基因水稻IR56上饲养获得的褐飞虱IR56种群尽管对IR56水稻表现出较强的致害性,但对RHT水稻的致害性无明显变化,这可能与RHT中存在Bph3以外其他抗褐飞虱基因有关。Sun等[25]报道了RHT中含有的Bph17抗虫基因,Wang等[26]则认为RHT存在一系列与褐飞虱抗性有关的基因。
[1]程遐年, 吴进才, 马飞. 褐飞虱研究与防治. 北京: 中国农业出版社, 2003: 18-20.
Cheng X N, Wu J C, Ma F. Brown planthopper: Occurrence and control. Beijing: China Agriculture Press, 2003: 18-20. (in Chinese)
[2]陶林勇, 俞晓平, 巫国瑞. 我国褐飞虱生物型监测初报. 中国农业科学, 1992, 25(3): 9-13.
Tao L Y, Yu X P, Wu G R. Preliminary monitoring the biotypes of the brown planthopper(NilaparvatalugensStål) in China.SciAgricSin, 1992, 25(3): 9-13. (in Chinese with English abstract)
[3]王桂荣, 赖凤香, 傅强, 等. 稻褐飞虱致害性变异的研究. 中国水稻科学, 1999, 13(4): 229-232.
Wang G R, Lai F X, Fu Q, et al.Virulent shift in population ofNilaparvatalugens(Homptera:Delphacidae).ChinJRiceSci, 1999, 13(4): 229-232. (in Chinese with English abstract)
[5]Khush G S, Brar D S. Genetics of resistance to insects in crop plants.AdvAgron, 1991, 45(45): 223-274.
[6]李青, 罗善昱, 韦素美, 等. 褐飞虱生物型测定及其与迁飞关系分析. 昆虫知识, 1999, 36 (5): 257-260.
Li Q, Luo S Y, Wei S M, et al. An analysis of the relationship of biotypes and seasonal migration of brown planthoppers in China.EntomolKnowl, 1999, 36 (5): 257-260. (in Chinese with English abstract)
[7]陈燕, 吴碧球, 黄所生, 等. 中国南宁和越南褐飞虱不同地理种群比较. 应用生态学报, 2013, 24(1): 190-196.
Chen Y, Wu B Q, Huang S S, et al. Geographical populations of brown planthopper in Nanning of South China and in Vietnam:A comparative study.ChinJApplEcol, 2013, 24(1): 190-196. (in Chinese with English abstract)
[8]Horgan F G, Ramal A F, Bentur J S, et al. Virulence of brown planthopper (Nilaparvatalugens) populations from South and South East Asia against resistant rice varieties.CropProt, 2015, 78: 222-231.
[9] 陈峰, 傅强, 罗举, 等. 水稻品种对褐飞虱的抗性及褐飞虱致害性变异研究进展. 长江大学学报:自然科学版, 2008, 5(1): 5-10.
Chen F, Fu Q, Luo J, et al. Study progress on resistance of rice varieties to brown planthopper,NilaparvatalugensStål and its virulence variations.JYangtzeUniv:NatSciEdit, 2008, 5(1): 5-10. (in Chinese)
[10]肖英方, 顾正远, 邱光. 江苏省褐稻虱生物型研究初报. 植物保护, 1994, 20(6): 2-3.
Xiao Y F,Gu Z Y, Qiu G. Research of brown planthopper (NilaparvatalugensStål) biological type in Jiangsu Province.PlantProt, 1994, 20(6): 2-3. (in Chinese)
[11]吕亮, 陈其志, 张舒, 等. 褐飞虱田间致害型监测. 湖北农业科学, 2009, 48(6): 1367-1368.
Lu L, Chen Q Z, Zhang S, et al. Determination of the biotype of brown planthopper(NilaparvatalugensStål).HubeiAgricSci, 2009, 48(6): 1367-1368. (in Chinese with English abstract)
[12]刘芳, 傅强, 张志涛, 等. 稻褐飞虱田间种群不同世代致害性检测. 江苏农业科学, 2003(6): 55-57.
Liu F, Fu Q, Zhang Z T, et al. Determination of the virulence by the different generation field BPH populations.JiangsuAgricSci, 2003(6): 55-57. (in Chinese)
[13] Sogawa K. Biological and genetic nature of biotype populations of the brown planthopper,Nilaparvatalugens.JpnAgricResQuart, 1980, 14(3): 186-190.
[14]吕仲贤, 俞晓平, 郑许松, 等. 褐飞虱致害性变异过程及其体内酶的变化. 昆虫学报, 1997, 40(1): 122-127.
Lu Z X, Yu X P, Zheng X S, et al. Variation in virulence of the brown planthopper to resistant rice varieties and its relation to the changes in the activities of endogenous enzymes.ActaEntomolSin, 1997, 40(1): 122-127. (in Chinese with English abstract)
[15]李青, 罗善昱, 师翱翔, 等. 我国褐稻虱生物型研究. 西南农业学报, 1994, 7(3): 89-96.
Li Q, Luo S Y, Shi A X, et al. Studies on the biotypes of the brown planthopper(NilaparvatalugensStål) in China.SouthwestChinaJAgricSci, 1994, 7(3): 89-96. (in Chinese with English abstract)
[16] 黄凤宽, 韦素美, 罗善昱, 等. 稻褐飞虱不同生物型致害特性研究. 广西农业生物科学, 2003, 22(2): 84-88.
Huang F K, Wei S M, Luo S Y, et al. Studies on the virulence characteristics of different rice brown planthopper biotypes.JGuangxiAgricBiolSci, 2003, 22(2): 84-88. (in Chinese with English abstract)
[17]Liu Y Q, Wu H, Chen H, et al. A gene cluster encoding lectin receptor kinases confers broad-spectrum and durable insect resistance in rice.NatBiotechnol, 2015, 33(3): 301-305.
[18]Sogawa K. The rice brown planthopper: Feeding physiology and host plant interactions.AnnRevEntomol, 1982, 27(1): 49-73.
[19]Paguia P, Pathak M D, Heinrichs E A. Honeydew excretion measurement techniques for determining differential feeding activity of biotypes ofNilaparvatalugenson rice varieties.JEconEntomol, 1980, 73(1): 35-40.
[20]Ghaffar M B, Pritchard J, Ford-Lloyd B. Brown planthopper (N.lugensStål) feeding behaviour on rice germplasm as an indicator of resistance.PloSOne, 2011, 6(7): e22137.
[21]Heinrichs E A, Medrano E G, Rapusas H R. Genetic evaluation for insect resistance in rice. Manila,Philippines: International Rice Research Institute, 1985: 72-177.
[22]唐启义. DPS 数据处理系统. 3版. 北京: 科学出版社, 2013.
Tang Q Y.Applied Statistic Analysis and Data Processing System. 3ed. Beijing: Science Press, 2013. (in Chinese)
[23]傅强, 张志涛, 胡萃. 寄主经历对稻褐飞虱致害特性的影响. 昆虫学报, 1997, 40(1): 116-121.
Fu Q, Zhang Z T, Hu C. The effects of host-related experiences on the infestation of rice brown planthopper,NilaparvatalugensStål.ActaEntomolSin, 1997, 40(1): 116-121. (in Chinese with English abstract)
[24]陈峰, 傅强, 罗举,等. 苗期抗性不同的水稻品种成株期对褐飞虱的抗性. 中国水稻科学, 2009, 23(2): 201-206.
Chen F, Fu Q, Luo J, et al.Adult stage resistances to brown planthopper,Nilaparvatalugensof rice varieties with different seedling resistances.ChinJRiceSci, 2009, 23(2): 201-206.(in Chinese with English abstract)
[25]Sun L,Su C, Wang C, et al. Mapping of a major resistance gene to the brown planthopper in the rice cultivar RathuHeenati.BreedingSci, 2005, 55: 391-396.
[26]Wang Y, Li H, Si Y, et al. Microarray analysis of broad-spectrum resistance derived from an indica cultivar RathuHeenati.Planta, 2012, 235: 829-840.
Virulence Characteristics of Nilaparvata lugens(Stål) Reared on Resistant Rice Variety IR56
ZHENG Yu, HE Jia-chun, WAN Pin-jun, LAI Feng-xiang, SUN Yan-qun, LIN Jing-jing, FU Qiang*
(State Key Laboratory of Rice Biology, China National Rice Research Institute, Hangzhou 31006, China;*Corresponding author, E-mail:fuqiang@caas.cn)
Rice varieties with the planthopper resistance geneBph3were initially released and promoted in the Southeast Asia in the early 1980s. These varieties are still resistant to the brown planthopper [BPH,Nilaparvatalugens(Stål)], which has attracted much attention of rice breeders in China. A local BPH population that was forced to feed on IR56 withBph3 gene for over 40 generations (IR56p) was used to study the virulence characteristics from perspectives of insects (development and reproduction) and rice variety reaction (SSST test). The results were as follows: 1) IR56p reared on resistant rice IR56 (IR56p-IR56) showed significantly increased emergence rate (ER), newly emerged adult body weight (BW), adult longevity (AL), number of eggs laid (NE), honeydew excretion (HE), and adult weight gain (WG), as well as markedly decreased nymphal duration (ND), compared to TN1 population (TN1p, a normal population reared on a susceptible rice variety TN1) on rice IR56 (TN1p-IR56). In contrast, IR56p-IR56 showed similar ER, NE and egg hatchability(EB), compared to TN1p or IR56p reared on rice TN1 (TN1p-TN1 or IR56p-TN1), despite significantly lower ND, AL, HE, WG and longer ND. The difference in BW and ND between IR56p-IR56 and TN1p-TN1 (or IR56p-TN1) was less than half of that between IR56p-IR56 and TN1p-IR56. 2) SSST test showed that the resistance of rice IR56 to IR56p was Grade 7, higher than Grade 3 of IR56 to TN1p. The resistance of TN1 to IR56p and TN1p was Grade 9 (total loss). It is concluded that the virulence of IR56p to IR56 is much higher than that of TN1p to IR56. Although the virulence of IR56p to IR56 was lower than that of IR56p or TN1p to TN1, most evaluations were similar among the three groups. In addition,the resistance of anotherBph3-containing variety RathuHeenati to IR56p was Grade 1 (high resistance). Such an unexpected result implies that other BPH resistance genes contributes to the resistance of RathuHeenati to IR56p.
Nilaparvatalugens; virulence; IR56 population;Bph3
2015-12-29; 修改稿收到日期: 2016-03-12。
水稻产业技术体系资助项目(CARS-01-18); 国家科技支撑计划资助项目(2012BAD19B03)。
S435.112+.3
A
1001-7216(2016)05-0552-07
郑瑜, 何佳春, 万品俊, 等. 褐飞虱IR56种群的致害特征. 中国水稻科学, 2016, 30(5): 552-558.
