水稻粒宽基因GS5的功能标记开发和单倍型鉴定
2016-10-25裔传灯王德荣蒋伟李玮成晓俊王颖周勇梁国华顾铭洪
裔传灯 王德荣 蒋伟 李玮 成晓俊 王颖 周勇 梁国华 顾铭洪
(扬州大学 江苏省作物遗传生理国家重点实验室培育点/粮食作物现代产业技术协同创新中心/教育部植物功能基因组学重点实验室, 江苏 扬州225009;*通讯联系人, E-mail: cdyi@yzu.edu.cn)
水稻粒宽基因GS5的功能标记开发和单倍型鉴定
裔传灯*王德荣蒋伟李玮成晓俊王颖周勇梁国华顾铭洪
(扬州大学 江苏省作物遗传生理国家重点实验室培育点/粮食作物现代产业技术协同创新中心/教育部植物功能基因组学重点实验室, 江苏 扬州225009;*通讯联系人, E-mail: cdyi@yzu.edu.cn)
YI Chuandeng, WANG Derong, JIANG Wei, et al. Development of functional markers and identification of haplotypes for rice grain width geneGS5. Chin J Rice Sci, 2016, 30(5): 487-492.
水稻粒宽是影响籽粒粒形的重要因素之一,也是一个与水稻产量和稻米品质密切相关的重要性状。在基因GS5序列分析的基础上,对该基因第2外显子的ACC/CTA和第9外显子A/C的两个变异位点分别开发了功能标记,并将其用于294份水稻微核心种质和2007-2013年江苏省审定的65份粳稻品种的基因型鉴定。研究结果表明,这两个变异位点的等位变异在水稻籽粒的粒长、粒宽和长宽比性状上存在显著或极显著的差异;其在水稻微核心种质中组成的4种单倍型在水稻籼亚种的粒宽、粒厚和长宽比性状上存在极显著的差异,在粳亚种的粒宽和长宽比性状上存在极显著的差异;而江苏省审定的粳稻品种中仅发现Hap1和Hap2两种单倍型,其分别有64个和1个代表性品种。这些研究结果为水稻产量和稻米品质育种中充分利用GS5的优异等位基因或单倍型奠定了基础。
水稻; 粒形; 基因GS5; 功能标记; 单倍型
水稻粒形性状包括粒长、粒宽、粒厚和长宽比[1]。它对稻米品质有着重要的影响[2],尤其是稻米的外观品质(垩白粒率、垩白度)和碾磨加工品质(糙米率、精米率和整精米率),如GW8[3]和GW7[4]。同时,通过影响千粒重、水稻粒形性状对水稻单产水平也有着重要的作用[5]。如GW8[3]、GS3[6]、qGL3[7]、qSW5/GW5[8, 9]、GS5[10]和TGW6[11]。因此,水稻粒形性状遗传调控机理的研究对水稻产量育种和稻米品质育种都有着重要的指导意义。
GS5是决定水稻粒形的重要基因之一。Li等[10]研究发现GS5是编码类丝氨酸羧肽酶的蛋白质,其对粒宽、籽粒灌浆速率和粒重有着正调控作用。相对于水稻品种H94的gs5而言,水稻品种珍汕97的GS5正向调节细胞周期上游的基因促进有丝分裂和增加细胞数量,从而增加粒宽,加快籽粒灌浆,结果导致粒重和单株产量得以提高;同时转基因证实来自水稻品种珍汕97的GS5启动子表达水平比较高,并与籽粒增大有着高度的相关性。Xu等[12]进一步研究表明转录起始点上游-1109 bp和-1032 bp的两处单碱基变异对启动子的差异表达有重要的影响。目前,该基因其他的变异位点对水稻粒形性状有何效应还不清楚。为了全面认识GS5不同等位变异的效应,本研究对该基因未知功能的错义突变开发了相应的功能标记,结合水稻微核心种质和近年来江苏审定的粳稻的基因型检测,分析了这些变异位点和组合(单倍型)对水稻粒形性状的影响,以期为水稻产量和稻米品质育种提供理论依据和快捷的选择手段。
1 材料与方法
1.1供试材料
供试水稻材料包括来自国内外不同稻作区的水稻微核心种质294份[13]以及2007-2013年江苏省审定的粳稻品种65份[14],它们分别引自中国农业大学和江苏省农业科学院。鉴于上述研究材料感光性存在明显的差异,为了确保正常抽穗,将所有供试水稻品种于2014年11月种植在海南陵水(短日照条件),2015年1月移栽大田,田间管理同常规水稻品种。待水稻籽粒蜡熟后收种,充分晒干后进行水稻籽粒相关性状的测量。
1.2水稻籽粒粒形相关性状的测定
水稻种子收获风干后,挑选饱满成熟种子,用游标卡尺(精确到0.01 mm)测量粒长、粒宽和粒厚,5次重复,计算平均值。用电子天平测定1000粒成熟烘干种子的质量,3次重复,计算千粒重的平均值。
1.3基因GS5 序列变异的分析和功能标记的设计
根据水稻粒形基因GS5的研究结果[10],从NCBI网站(http://www.ncbi.nlm.nih.gov/)下载基因到GS5的相关DNA序列,即来源于籼稻品种珍汕97的cDNA序列(JN256056)和基因组DNA序列(JN256058),来源于籼稻品种H94的cDNA序列(JN256055)和基因组DNA序列(JN256057)。以上述序列作为种子序列,在NCBI网站水稻基因组数据库中检索到1条高度同源的基因组DNA序列(NC_008398.2);在水稻基因组注释计划(Rice Genome Annotation Project)网站cDNA数据库中检索到2条高度同源的cDNA序列(AK106800和CT833291)。借助BioEdit软件对上述序列进行比对分析。
利用Primer Premier 5.0 软件,本研究对GS5第2和第9外显子的两个错义突变分别设计了酶切扩增多态性序列(cleaved amplified polymorphic sequence, CAPS)标记和衍生酶切扩增多态性序列(derived cleaved amplified polymorphic sequence, dCAPS) 标记。引物的合成和序列的测定在上海生工生物工程股份有限公司完成。
1.4DNA提取
收集供试材料分蘖盛期新鲜幼嫩的叶片,采用SDS法提取水稻基因组DNA。
1.5PCR扩增、酶切和电泳
PCR反应体系含50 ng/μL基因组DNA 2.0 μL,2 μmol/L引物F和R各2.5 μL,10×缓冲液2.0 μL,25 mmol/L MgCl22.0 μL,2.5 mmol/L dNTP 1.6 μL,5 U/μLTaqDNA聚合酶(TaKaRa Code: R001C) 0.2 μL,灭菌双蒸补足至20 μL。PCR在德国艾本德Mastercycler pro梯度PCR仪上进行,反应条件如下: 94℃下预变性5 min; 94℃下30 s;55~60℃下30 s;72℃下1 min,共35个循环; 72℃下再延伸10 min。反应产物在3.0%琼脂糖凝胶上进行水平电泳分离。
利用开发的PCR引物扩增GS5的目标片段,进一步用于酶切反应。酶切反应体系为10 μL,分别包含PCR产物5 μL,10×缓冲液 1 μL,DNA限制性内切酶(10 U/μL) 0.25 μL,ddH2O 3.75 μL。混匀后置于37℃恒温水浴锅酶切3~4 h,酶切产物在3.0%琼脂糖凝胶上进行电泳,EB染色,经紫外凝胶成像系统成像。
1.6数据分析
本研究中所有数据的分析和处理利用Excel和SPSS软件进行。
表1基于GS5第2和第9外显子DNA序列变异设计的PCR引物
Table 1. PCR primers based on the GS5 DNA sequence variations of exon 2 and exon 9.

标记名称Marker变异位点所在区域aRegionofsequencevariationa基因型Genotype引物序列Primersequence标记类型MarkertypeGS5-1Exon2(817bp)ACC/CTAF:GCAAGACAAGGAGCAGCACTACAPS-DdeⅠR:AGAAGCCGACCCCAACAGGS5-2Exon9(3796bp)A/CF:CAGTTCTCGGTACTGCGTCGAdCAPS-SalⅠR:CACAAACCTCCCAGCAACC
a以GS5的基因组序列JN256058作为参照。
aGenomic DNA sequence(JN256058) of geneGS5 as a reference.
表2GS5不同变异位点的籽粒粒形性状及其t测验
Table 2. Grain-related traits and their t-tests of different alleles in geneGS5.
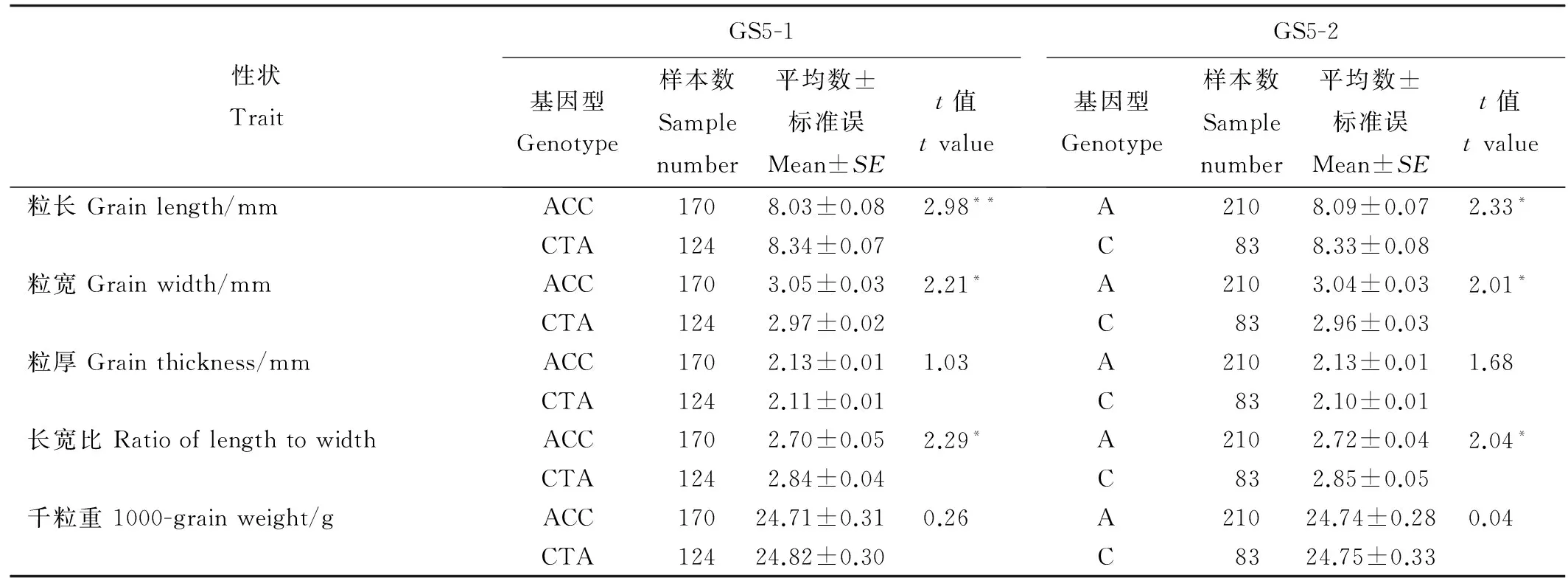
性状TraitGS5-1基因型Genotype样本数Samplenumber平均数±标准误Mean±SEt值tvalueGS5-2基因型Genotype样本数Samplenumber平均数±标准误Mean±SEt值tvalue粒长Grainlength/mmACC1708.03±0.082.98**A2108.09±0.072.33*CTA1248.34±0.07C838.33±0.08粒宽Grainwidth/mmACC1703.05±0.032.21*A2103.04±0.032.01*CTA1242.97±0.02C832.96±0.03粒厚Grainthickness/mmACC1702.13±0.011.03A2102.13±0.011.68CTA1242.11±0.01C832.10±0.01长宽比RatiooflengthtowidthACC1702.70±0.052.29*A2102.72±0.042.04*CTA1242.84±0.04C832.85±0.05千粒重1000-grainweight/gACC17024.71±0.310.26A21024.74±0.280.04CTA12424.82±0.30C8324.75±0.33
*和**分别表示在0.05水平和0.01水平上差异显著。
*and**mean significant difference at the 0.05 and 0.01 levels, respectively.
2 结果与分析
2.1基因序列分析和分子标记设计
DNA序列分析表明GS5共有10个外显子和9个内含子。序列比对发现该基因的基因组DNA有37处序列变异,其中25个变异发生在启动子区,已有研究证实启动子区域的序列变异对该基因的转录水平有着重要的影响[10, 12]。除此之外,9个变异发生在内含子区域,3个变异发生在外显子区域。内含子在基因转录为成熟RNA时会被剪切掉,但是这些外显子区的变异对籽粒性状有何作用还不清楚。以宽粒珍汕97的GS5基因组序列JN256058作为参照,第1外显子28 bp处、第2外显子817 bp处和第9外显子3796 bp处分别有6 bp(GCGGCG)的插入、三碱基(ACC/CTA)变异和单碱基(A/C)变异。这3处变异都引起氨基酸序列的变化,其中前两个变异高度相关。因此,本研究对基因GS5的第2和第9外显子的两个错义突变位点分别开发了CAPS标记GS5-1和dCAPS标记GS5-2(表1)。
对于GS5第2外显子817 bp处的ACC/CTA变异而言,利用标记GS5-1在水稻品种中扩增出长度为225 bp的PCR产物(图1-A的泳道1和2),经过限制性内切酶DdeⅠ酶切后,能够被切成196 bp条带的水稻品种为珍汕97,其基因型为CTA(图1-A的泳道4);PCR产物仍为225 bp的水稻品种为日本晴,其基因型为ACC(图1-A的泳道3)。
对于GS5第9外显子3796 bp处的A/C单碱基变异而言,我们利用标记GS5-2在水稻品种中扩增出长度为188 bp的PCR产物(图1-B的泳道1和2),经过限制性内切酶SalⅠ酶切后,能够被切成169 bp条带的水稻品种为珍汕97,其基因型为C(图1-B的泳道4);PCR产物仍为188 bp的水稻品种为日本晴,其基因型为A(图1-B的泳道3)。
表3GS5不同单倍型籽粒粒形性状的方差分析
Table 3. Analysis of variances (ANOVA) of different haplotypes in gene GS5.
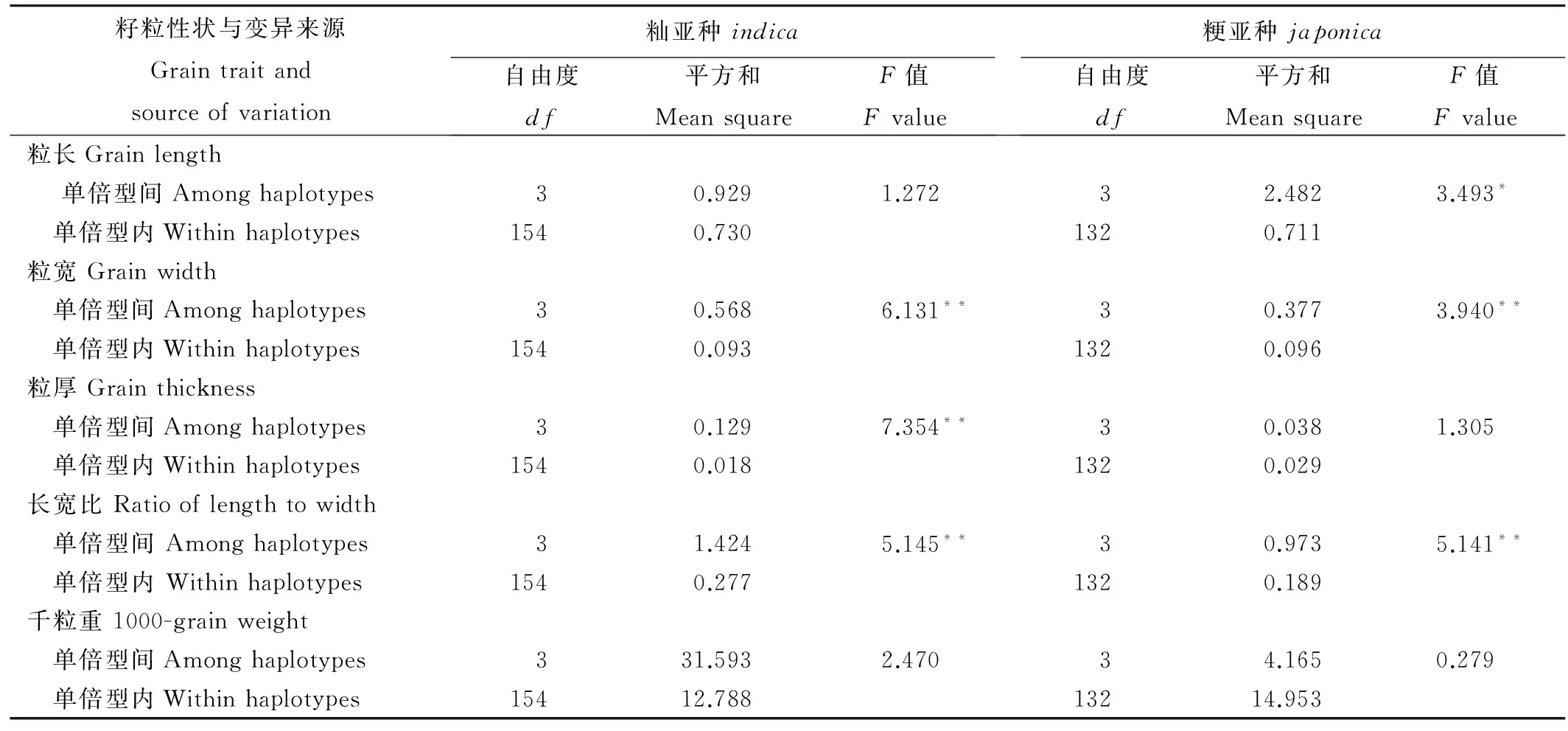
籽粒性状与变异来源Graintraitandsourceofvariation籼亚种indica自由度df平方和MeansquareF值Fvalue粳亚种japonica自由度df平方和MeansquareF值Fvalue粒长Grainlength 单倍型间Amonghaplotypes30.9291.27232.4823.493* 单倍型内Withinhaplotypes1540.7301320.711粒宽Grainwidth 单倍型间Amonghaplotypes30.5686.131**30.3773.940** 单倍型内Withinhaplotypes1540.0931320.096粒厚Grainthickness 单倍型间Amonghaplotypes30.1297.354**30.0381.305 单倍型内Withinhaplotypes1540.0181320.029长宽比Ratiooflengthtowidth 单倍型间Amonghaplotypes31.4245.145**30.9735.141** 单倍型内Withinhaplotypes1540.2771320.189千粒重1000-grainweight 单倍型间Amonghaplotypes331.5932.47034.1650.279 单倍型内Withinhaplotypes15412.78813214.953
*和**分别表示在0.05水平和0.01水平上差异显著。
*and**mean significant difference at the 0.05 and 0.01 levels, respectively.
表4GS5不同单倍型对水稻粒形性状的差异显著性分析
Table 4. Analysis of the difference of grain-related traits based on different haplotypes in geneGS5.
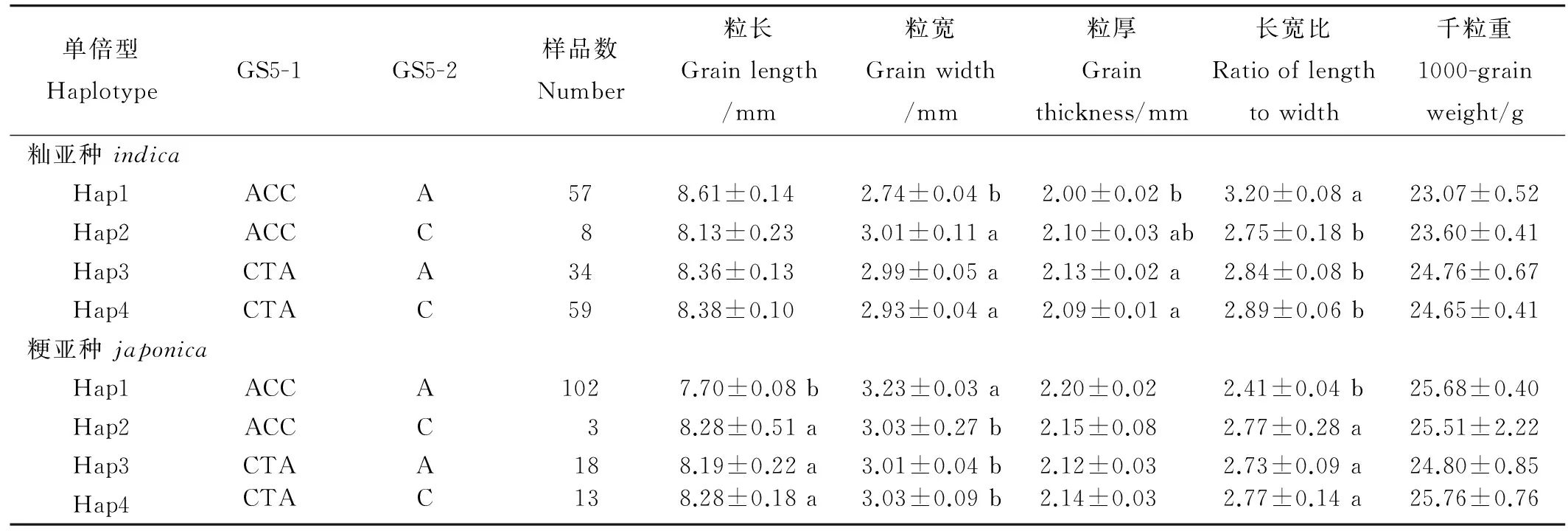
单倍型HaplotypeGS5-1GS5-2样品数Number粒长Grainlength/mm粒宽Grainwidth/mm粒厚Grainthickness/mm长宽比Ratiooflengthtowidth千粒重1000-grainweight/g籼亚种indicaHap1ACCA578.61±0.14 2.74±0.04b2.00±0.02b3.20±0.08a23.07±0.52Hap2ACCC88.13±0.233.01±0.11a2.10±0.03ab2.75±0.18b23.60±0.41Hap3CTAA348.36±0.132.99±0.05a2.13±0.02a2.84±0.08b24.76±0.67Hap4CTAC598.38±0.102.93±0.04a2.09±0.01a2.89±0.06b24.65±0.41粳亚种japonicaHap1ACCA1027.70±0.08b3.23±0.03a2.20±0.02 2.41±0.04b25.68±0.40Hap2ACCC38.28±0.51a3.03±0.27b2.15±0.082.77±0.28a25.51±2.22Hap3CTAA188.19±0.22a3.01±0.04b2.12±0.032.73±0.09a24.80±0.85Hap4CTAC138.28±0.18a3.03±0.09b2.14±0.032.77±0.14a25.76±0.76
表中籽粒相关性状的数据为平均数±标准误。数据后跟相同小写字母表示差异未达显著水平(最小显著差数法)。
All data about grain-related traits were given as mean±SE. Values followed by common lowercase letters are not significantry different by least significant difference(LSD) test.
2.2GS5不同变异位点对水稻粒形性状的影响
为了解析GS5第2和第9外显子的两个变异位点对水稻籽粒相关性状的影响,我们利用标记GS5-1和GS5-2分别对水稻微核心种质的基因型进行了测定,并对每个位点的不同变异类型进行了t测验。从表2中可以看出,GS5的第2和第9外显子的两个变异位点对水稻籽粒的粒长、粒宽和长宽比的影响达到了显著或极显著的水平;但这两个变异位点对水稻千粒重的影响没有达到显著水平,这表明GS5的第2和第9外显子的两个变异位点对水稻籽粒的粒形性状均有重要影响。
2.3基因GS5的单倍型类型及其效应分析
为了进一步明确GS5这两个变异位点的不同组合(单倍型)对水稻籽粒相关性状的效应,我们依据这两个变异位点在水稻微核心种质中的不同组合将GS5分成了4个单倍型(表4)。鉴于籼粳亚种间的籽粒性状差异明显,我们进一步利用GS5的4个单倍型对水稻微核心种质按籼粳亚种分别进行了方差分析(表3)和多重比较(表4)。
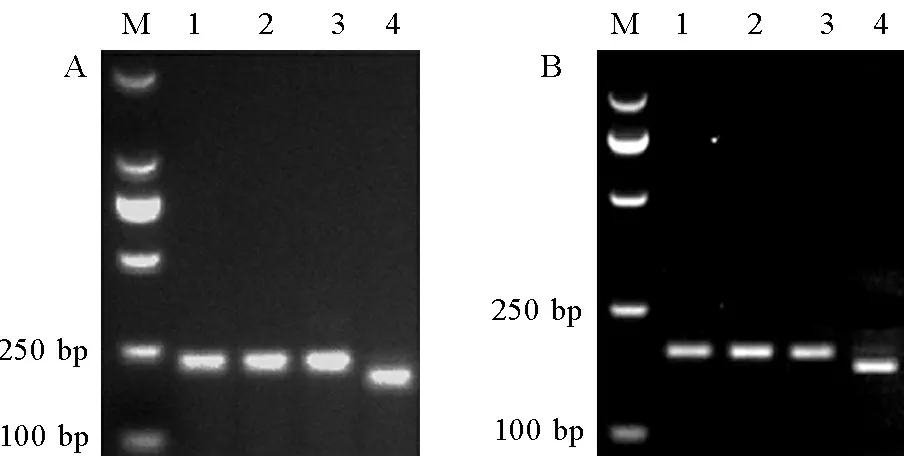
A-引物GS5-1的扩增产物和DdeⅠ酶切电泳。B-引物GS5-2的扩增产物和SalⅠ酶切电泳。M, DL2000 DNA 标记(TaKaRa); 泳道1和3为水稻品种日本晴;泳道2和4为珍汕97。
A, PCR amplification products and their correspondingDdeⅠ-digested ones of primer GS5-1; B, PCR amplification products and their correspondingSalⅠ-digested ones of primer GS5-2. M, DL2000 DNA Marker(TaKaRa). Lanes 1 and 3, Nipponbare; Lanes 2 and 4, Zhenshan 97.
图1水稻基因GS5特异引物GS5-1(A)和GS5-2(B)的PCR扩增和酶切鉴定
Fig. 1. PCR identification and enzyme-digested characterization of specific primers GS5-1(A) and GS5-2(B) for gene GS5 in rice.
在水稻籼亚种中,从表3中可以看出,GS5的不同单倍型在粒宽、粒厚和籽粒长宽比这3个粒形性状都存在极显著的差异。表4的多重比较进一步表明GS5的不同单倍型对上述3个粒形性状也有着不同程度的影响,其中,以单倍型Hap1的粒宽最小,粒厚最小,长宽比最大。
在水稻粳亚种中,从表3中可以看出,GS5的不同单倍型在粒厚和籽粒长宽比这2个粒形性状上都存在极显著的差异,在粒长性状上也存在显著的差异。表4的多重比较进一步表明GS5的不同单倍型对上述3个粒形性状也有着不同程度的影响,其中,以单倍型Hap1的粒长最小、粒宽最大,长宽比最小。这些结果表明水稻籼粳亚种间调控粒形性状的遗传基础有所差异。
2.4近年来江苏育成品种的GS5单倍型分析
为了更好地将上述研究结果应用到江苏省的水稻育种实践中,我们对2007-2013年江苏省审定的65份粳稻品种GS5的两个目标变异位点进行了基因型测定,结果发现近年来江苏省审定的粳稻品种中,只有1个水稻品种(镇稻13)利用GS5的Hap2单倍型,而其余64个水稻品种为同一单倍型(Hap1)。这表明江苏省近年来育成水稻品种利用粒形基因GS5的等位变异较少。
3 讨论
在过去的十年间,随着水稻基因组的快速发展,许多粒形相关的QTL被定位和克隆。与粒宽有关的基因为GW8[3]、GW7[4]、qSW5/GW5[8, 9]、GS5[10]、GW2[15]、GS6[16];与粒长有关的基因为GS3[6]、qGL3/qGL3.1[7, 17, 18];与籽粒充实有关的基因为GS5[10]、GIF1[19]。这些基因通过调节水稻籽粒的大小和形状(即粒形),提高千粒重,进而提高了水稻的产量水平。除GS5和GW8为正调控因子外,其余基因对水稻粒形都起负调控作用。Li等[10]研究发现,将窄粒品种H94的GS5的cDNA片段接到35S启动子或来源于宽粒品种珍汕97基因GS5的启动子下,构建的转基因水稻表现为粒宽增加和粒重提高,这表明启动子转录效率的高低是影响GS5调控粒宽和粒重的主要因素。本研究中利用水稻微核心种质,我们也发现GS5的第2和第9外显子两个错义突变对水稻粒长、粒宽和长宽比性状上存在显著或极显著的差异。在GS5的单倍型分析时,籼亚种的不同单倍型在粒宽、粒厚和长宽比性状上存在极显著的差异;粳亚种的不同单倍型在粒宽和长宽比性状上存在极显著的差异,在粒长性状上存在显著的差异;不论籼亚种和粳亚种,不同单倍型对粒重的影响没有达到显著水平,这可能是因为水稻的千粒重受多个基因位点调控,且与粒形性状有着不同的调控机制,导致在遗传背景复杂的水稻微核心种质中,难以准确检测GS5对水稻千粒重的效应。
虽然许多与水稻产量相关的重要功能粒形基因已被克隆,但是当前水稻育种工作中还很少涉及到这些基因,其原因主要是这些基因缺乏成本低廉且简便实用的基因功能标记,这些基因有多少等位变异类型及其效应如何等等。利用近等基因系和转基因的方法,Li等[10]证实了GS5的启动子变异是该基因对水稻粒形起作用的主要原因。Xu等[12]进一步通过截短启动子的方法证实启动子区的-1109 bp和-1032 bp的两处单碱基变异对GS5的表达水平有重要的影响。本研究发现GS5的第2和第9外显子的两个错义突变对水稻粒形性状也有着明显的效应,为此我们分别开发了基于这些序列变异的PCR标记,为其应用到水稻育种实践提供了便利的选择方法,但是其遗传机理还值得深入研究。
谢辞:中国农业大学李自超教授和张洪亮博士提供了水稻微核心种质;江苏省农业科学研究院王军博士提供了2007-2013年江苏省审定的粳稻品种,在此一并表示感谢。
[1]Qiu X, Pang Y, Yuan Z, et al. Genome-wide association study of grain appearance and milling quality in a worldwide collection ofindicarice germplasm.PLoSOne, 2015, 10(12): e0145577.
[2]徐正进, 陈温福, 马殿荣, 等. 稻谷粒形与稻米主要品质性状的关系. 作物学报, 2004, 30(9): 894-900.
Xu Z J, Chen W F, Ma D R, et al. Correlations between rice grain shapes and main qualitative characteristics.ActaAgronSin, 2004, 30(9): 894-900.
[3]Wang S, Wu K, Yuan Q, et al. Control of grain size, shape and quality byOsSPL16 in rice.NatGenet, 2012, 44(8): 950-954.
[4]Wang S, Li S, Liu Q, et al. TheOsSPL16-GW7 regulatory module determines grain shape and simultaneously improves rice yield and grain quality.NatGenet, 2015, 47(8): 949-954.
[5]Zuo J, Li J. Molecular genetic dissection of quantitative trait loci regulating rice grain size.AnnuRevGenet, 2014, 48: 99-118.
[6]Fan C, Xing Y, Mao H, et al.GS3, a major QTL for grain length and weight and minor QTL for grain width and thickness in rice, encodes a putative transmembrane protein.TheorApplGenet, 2006, 112(6): 1164-1171.
[7]Zhang X, Wang J, Huang J, et al. Rare allele ofOsPPKL1 associated with grain length causes extra-large grain and a significant yield increase in rice.ProcNatlAcadSciUSA, 2012, 109(52): 21534-21539.
[8]Shomura A, Izawa T, Ebana K, et al. Deletion in a gene associated with grain size increased yields during rice domestication.NatGenet, 2008, 40(8): 1023-1028.
[9]Weng J, Gu S, Wan X, et al. Isolation and initial characterization ofGW5, a major QTL associated with rice grain width and weight.CellRes, 2008, 18(12): 1199-1209.
[10]Li Y, Fan C, Xing Y, et al. Natural variation inGS5 plays an important role in regulating grain size and yield in rice.NatGenet, 2011, 43(12): 1266-1269.
[11]Ishimaru K, Hirotsu N, Madoka Y, et al. Loss of function of the IAA-glucose hydrolase geneTGW6 enhances rice grain weight and increases yield.NatGenet, 2013, 45(6): 707-711.
[12]Xu C, Liu Y, Li Y, et al. Differential expression ofGS5 regulates grain size in rice.JExpBot, 2015, 66(9): 2611-2623.
[13]Zhang H, Zhang D, Wang M, et al. A core collection and mini core collection ofOryzasativaL. in China.TheorApplGenet, 2011, 122(1): 49-61.
[14]王军, 杨杰, 徐祥, 等. 水稻千粒重基因TGW6功能标记的开发与利用. 中国水稻科学, 2014, 28(5): 473-478.
Wang J, Yang J, Xu X, et al. Development and application of a functional marker for grain weight geneTGW6 in rice.ChinJRiceSci, 2014, 28(5): 473-478.
[15]Song X, Huang W, Shi M, et al. A QTL for rice grain width and weight encodes a previously unknown RING-type E3 ubiquitin ligase.NatGenet, 2007, 39(5): 623-630.
[16]Sun L, Li X, Fu Y, et al.GS6, a member of theGRASgene family, negatively regulates grain size in rice.JIntegrPlantBiol, 2013, 55(10): 938-949.
[17]Qi P, Lin Y S, Song X J, et al. The novel quantitative trait locusGL3.1 controls rice grain size and yield by regulating Cyclin-T1;3.CellRes, 2012, 22(12): 1666-1680.
[18]Hu Z, He H, Zhang S, et al. A Kelch motif-containing serine/threonine protein phosphatase determines the large grain QTL trait in rice.JIntegrPlantBiol, 2012, 54(12): 979-990.
[19]Wang E, Wang J, Zhu X, et al. Control of rice grain-filling and yield by a gene with a potential signature of domestication.NatGenet, 2008, 40(11): 1370-1374.
Development of Functional Markers and Identification of Haplotypes for Rice Grain Width Gene GS5
YI Chuan-deng*, WANG De-rong, JIANG Wei, LI Wei, CHENG Xiao-jun, WANG Ying, ZHOU Yong,LIANG Guo-hua, GU Ming-hong
(Jiangsu Key Laboratory of Crop Genetics and Physiology/Co-Innovation Center for Modern Production Technology of Grain Crops/Key Laboratory of Plant Functional Genomics of the Ministry of Education, Yangzhou University, Yangzhou 225009, China;*Corresponding author, E-mail: cdyi@yzu.edu.cn)
As a major component of rice grain shape, the grain width is an important trait which is correlated with the rice yield and quality. Based on the alignment of geneGS5 genomic DNA sequence, two functional markers were developed based on two missense polymorphisms (ACC/CTA in the exon2, A/C in the exon9, respectively). Subsequently, the markers were used to identify the genotypes of geneGS5 in the 294 accessions of a rice mini-core collection and 65japonicavarieties released in Jiangsu Province from 2007 to 2013. We found that the allelic variations at the two target loci had significant or extremely significant differences in the grain shape traits(grain length, grain width and ratio of length to width). Based on the two variation sites of geneGS5, four haplotypes (combinations) were found in the rice mini-core collection, and had extremely significant effect on grain width, grain thickness and ratio of length to width in theindicagroup, and on grain width and ratio of length to width in thejaponicagroup, respectively. While injaponicavarieties released by Jiangsu, only two haplotypes, Hap1 (represented by 64 varieties) and Hap2 (represented by one variety) were found. The results will lay a foundation for the application of the useful allelic variations or haplotypes of geneGS5 to the rice yield and quality breeding program.
rice; grain shape; geneGS5; functional markers; haplotype
2016-03-07; 修改稿收到日期: 2016-04-12。
国家自然科学基金资助项目(31571624, 31071382); 国家重点基础研究发展计划资助项目(2010CB125904, 2013CBA01405); 江苏省高校自然科学研究重大项目(15KJA210004); 江苏省重点研发计划资助项目(BE2015341); 江苏高校优势学科建设工程资助项目。
Q755; S511.032
A
1001-7216(2016)05-0487-06
裔传灯, 王德荣, 蒋伟,等. 水稻粒宽基因GS5的功能标记开发和单倍型鉴定. 中国水稻科学, 2016, 30(5): 487-492.
