pH对嗜盐混合菌发酵挥发性有机酸混合物合成PHA的影响
2016-10-25崔有为张宏宇
崔有为,张宏宇
pH对嗜盐混合菌发酵挥发性有机酸混合物合成PHA的影响
崔有为,张宏宇
(北京工业大学环境与能源工程学院,北京 100124)
嗜盐混合菌发酵生产聚羟基脂肪酸酯(polyhydroxyalkanoate,PHA)具有免灭菌程序、产量高、易提取等优势而被广泛关注。集中考察了pH对嗜盐混合菌(MMCs)发酵混合挥发性有机酸(VFA)生产PHA的影响。研究结果表明,在6.5~8.2范围内pH对PHA合成没有明显影响,过高或者过低的pH都会降低PHA合成速率和VFA的吸收速率。发酵体系的pH影响了嗜盐MMC的PHA产量,但是在酸性和碱性条件下却存在不同的影响机制。碱性环境增大了VFA的解离程度,导致MMC对底物的吸收耗费大量的能量,造成VFA吸收速率的下降。这一作用在pH升高至9.2以上时表现显著。酸性环境下,分子态VFA进入细胞后改变了胞内的pH,降低了相关酶和蛋白质的活性,从而影响了底物的利用。当pH5.2时微生物代谢及底物利用能耗量降低,导致PHA胞内降解利用率降低,刺激了PHA合成量的提高。PHA组分受pH影响不大,初始pH5.2~10.2时羟基脂肪酸戊酯(hydroxyvalerate,HV)所占比例维持在34.9%~38.3%范围内。本研究对于进一步利用嗜盐MMC发酵含有混合VFA的废弃物生产PHA具有重要的指导意义。
聚羟基脂肪酸酯;pH;挥发性脂肪酸;嗜盐混合菌
引 言
PHA具有良好的物理特性、生物相容性和生物可降解性,被认为是替代以石油为原材料化工合成塑料的重要物质,对缓解石油等化石燃料短缺、解决白色污染问题具有重要意义[1-3]。目前,以混合微生物(mixed microbial cultures,MMCs)替代纯菌(pure cultures,PCs)生产PHA可以减少灭菌程序,可以使用废弃底物为原料,被认为是降低PHA生产成本的有效方式[4-5]。目前以MMC合成PHA普遍使用两步法:第1步筛选富集具有高PHA积累能力的菌群;第2步在限氮条件下进行PHA发酵生产。在两步法工艺中,底物和工艺参数等都会对PHA的发酵生产造成影响。Beccari等[6]比较了不同碳源对发酵生产PHA能力影响,发现乙酸等VFA类底物最适合PHA的合成;在工艺运行层面,Moralejo-Garate等[7]发现DO对PHA合成量存在影响;Johnson等[8]发现温度影响PHA的合成量;Wang等[9]发现底物中的营养成分,如C/N、C/P等条件也是影响PHA发酵合成量的重要参数。
在前期的研究中本文作者采集入海口底泥利用好氧动态给料(aerobic dynamic feeding,ADF)技术成功实现了嗜盐MMCs的筛选和富集,并已证明其具有PHA合成能力[10-11]。在此基础上,本研究将集中讨论影响嗜盐MMCs发酵生产PHA能力的运行因素。本文集中探讨pH的可能影响。pH对微生物的可能影响主要体现在以下几个方面:一是使细胞膜电荷发生变化,导致微生物细胞吸收营养物质能力改变;二是使生物大分子(蛋白质、核酸等)所带电荷发生变化,从而影响其生物活性;三是使营养物质的可吸收性发生改变。因此,pH直接影响着微生物的生命活动、代谢方式和代谢产物[12]。发酵底物的pH可能对嗜盐MMC合成PHA产生较大的影响。
MMC合成PHA的优势体现在其可以利用废水作为底物,相比较使用单一纯底物生产PHA大大降低了生产成本[6-8]。由于VFA是PHA合成最有效的底物[6-7],因此一些含有VFA的废水成为MMC生产PHA的最重要目标。很多废水,例如垃圾渗滤液、污泥厌氧消化液等含有大量的混合VFA。这为利用这些废水生产PHA奠定了基础。基于此,本研究以嗜盐MMCs为研究对象,探索pH对嗜盐MMC利用混合VFA发酵PHA的影响,从而探索嗜盐MMC利用混合VFA废水合成PHA的可行性。
1 实验材料和方法
1.1 嗜盐PHA积累混合菌的选择和富集
实验中所用的嗜盐污泥采自河北省秦皇岛市某河道入海口底泥。该地为人类活动较为频繁地区。将采集的河底淤泥经过反复淘洗得到嗜盐活性污泥[13-14],接种该污泥到SBR反应器中进行PHA积累菌群的筛选。菌群选择反应器为双层玻璃夹心反应器,有效体积为2 L。反应器配有曝气充氧设备和搅拌装置。通过外接恒温水浴装置保证在反应器整个过程中温度控制在(30±0.1)℃。反应器运行采用ADF模式,按照Johnson等[15]提出的筛选方法进行PHA菌群的选择。具体筛选参数为:每天2个周期,每个周期12 h,包括进水5 min,好氧曝气11.5 h,沉淀20 min,排水5 min。污泥龄(sludge retention time,SRT)控制在10 d。按照该方式连续运行200多个周期,在后50个周期内每个周期PHA积累最大量及其他参数稳定,并且已验证该菌群具有良好的PHA积累能力[10],完成了对MMCs的富集。
1.2 pH对嗜盐MMCs发酵生产PHA影响实验
采用富集的嗜盐MMCs进行发酵生产PHA,考察发酵中pH对该菌群发酵生产PHA能力的影响。批次实验中所用碳源为6种挥发性脂肪酸(VFA)的混合物。6种VFA的相对比例按照北京市某填埋场中渗滤液的VFA含量进行配制。依据前期的研究,该嗜盐MMC实验中MLVSS保持在(1800±100)mg·L-1。实际进水VFA含量如表1所示。最初pH的调节通过投加1 mol·L-1的HCl和1 mol·L-1的NaOH实现,实验过程中不进行pH的调节。批次实验的连续发酵时间均为24 h。每组实验都设置一组平行实验,两次实验的平均值作为最终结果。两步法生产PHA的第2步要求严格限制氨氮的投加,从而抑制微生物的生长实现PHA在细胞内的最大积累。在发酵实验中的发酵底物只含有VFA、营养元素和微量元素,不含氨氮。营养元素和微量元素浓度如下:26 mg·L-1KH2PO4,3.0 mg·L-1FeSO4·7H2O,1.2 mg·L-1MnSO4·H2O,1.5 mg·L-1ZnSO4·7H2O,7.6 mg·L-1KCl,8.0 mg·L-1CaCl2·2H2O,45 mg·L-1MgSO4。由于在发酵反应中氮素被限制而微生物无法增殖,因此在整个发酵过程中,微生物浓度和初始接种在发酵反应中的生物量一致[16]。

表1 批次实验VFA含量
1.3 分析方法
氨氮、MLSS(mixed liquor suspended solids)和MLVSS(mixed liquor suspended solids)采用标准方法进行测定[17]。VFA含量的测定采用气相色谱分析法(Agilent 7890A气相色谱仪)[17]。PHA含量在样本经过前处理后采用内标法进行气相色谱分析。样品前处理具体操作过程如下:从反应器中取40 ml泥水混合物,4000 r·min-1离心后弃去上清液,加入1 ml次氯酸钠消毒液以使微生物失活,水洗两遍后冷冻干燥。称取冻干后的污泥样品约25 mg于具塞消解管中,依次加入2 ml氯仿、2 ml苯甲酸钠溶液,于105℃消解20 h,冷却后加入1 ml去离子水,摇匀、离心,取下层有机相于盛有0.5 g左右无水硫酸钠的2 ml塑料离心管中,摇匀。8000 r·min-1转速下离心5 min,随后取有机相进行气相色谱分析。
1.4 表观参数的计算
细胞内PHA浓度
初始细胞内的PHA含量
最大细胞内的PHA含量
碳源的PHA转化率
最大底物比吸收速率
与西班牙语类似,贯穿全文的卡拉米洛披肩亦是受到外来文化的影响:“它是由印度妇女包裹孩子的布和西班牙披肩上打结的穗结合而成,中国宫廷的绸刺绣出口到马尼拉,通过西班牙帆船进而到阿卡普尔科。殖民时期,由于禁止买西班牙人穿的那种衣服,墨西哥人开始用当地产的织布机织布,一种长长的窄窄的、潜移默化地收到外国影响的围巾。(96)
最大PHA比合成速率
式中,P为PHA质量,mg;CDW为细胞干重(cell dry weight),mg;0为初始细胞内PHA质量分数,以占细胞干重的百分含量计,%;max为细胞内PHA最大质量分数,以占细胞干重的百分含量计,%;HB为PHA中羟基脂肪酸丁酯(hydroxybutyrate,HB)单体含量,以质量分数计,%;HB为HB单体分子量,mg·(mmol C)-1,以1.38 mg COD·(mg HB)-1计;HV为PHA中HV单体含量,以质量分数计,%;HV为HV单体分子量,mg·(mmol C)-1,以1.63 mg COD·(mg HV)-1计;PHA0为初始细胞内的PHA含量,mmol C·L-1;PHAmax为细胞内的PHA含量最大值,mmol C·L-1;0为初始底物浓度,mmol C·L-1;f为PHA含量最大时底物浓度,mmol C·L-1;a为反应器中生物量,mmol C·L-1。
2 实验结果与讨论
2.1 pH对PHA合成过程中VFA利用的影响
为了探究pH在PHA发酵生产过程中对VFA利用的影响,设置了6个pH下开展实验。图1(a)~(f)分别为pH4.2、5.2、6.5、8.2、9.2、10.2的初始pH下批次实验中VFA的消耗情况。在驯化pH环境下(pH6.5)系统表现出快速的VFA利用速率。含量较低的正丁酸、正戊酸均在2 h内被完全利用,底物中的主要VFA物质乙酸和丙酸也在2 h内被快速利用并在4 h内耗尽,而与正丁酸、正戊酸含量相当的异丁酸、异戊酸在2 h内消耗量很小,在2 h后即其他VFA类底物基本耗尽时才开始快速利用,并在6 h时完全耗尽。不同种类VFA被微生物系统利用难易程度并不相同[18]。本文中研究支持这一结论,发现乙酸、丙酸、正丁酸、正戊酸的利用优先于异丁酸和异戊酸。当初始pH增至8.2时,6种VFA消耗情况与pH6.5条件下基本一致,说明初始pH在6.5~8.2的范围内对微生物进行底物利用没有明显的影响。当初始pH提高到9.2时,浓度较低的正丁酸、正戊酸在2 h内耗尽,异丁酸、异戊酸在6 h时耗尽,这和pH为6.5和8.2时一致。然而,含量最高的两种VFA类底物乙酸和丙酸消耗明显缓慢,同时消耗用时推迟至6 h。当pH进一步提高至10.2时,该趋势仍然存在,并且最难以利用的异丁酸、异戊酸消耗时间推迟至8 h。而当初始pH降至5.2时,在0~2 h内底物利用明显受到抑制,VFA被利用的量很少。2 h后系统开始较为快速地利用底物,乙酸、丙酸、正丁酸、正戊酸在6 h时耗尽,异丁酸在8 h耗尽,异戊酸在10 h耗尽。当pH进一步降低至4.2时,水环境中VFA底物在24 h内没有明显变化,底物吸收速率十分微小,这表明pH达到4.2时超出了系统承受能力,微生物无法正常利用VFA。因此,pH在6.5~8.2范围内对VFA底物的利用影响不大,提高或降低pH都会在一定程度上影响VFA的利用,并在pH降至4.2时底物利用被完全抑制。

图1 不同初始pH下合成PHA批次实验中6种VFA消耗情况
进一步从动力学角度对VFA总的消耗情况及底物中含量最高的乙酸、丙酸的消耗情况进行分析(表3)。当pH6.5时乙酸、丙酸和总VFA最大比吸收速率(分别为acetic acid、propionic acid、s)分别为0.45、0.16、0.73mmol C·(mmol C·h)-1,并且当pH提高至8.2时变化不大。而当pH提高至9.2时乙酸、丙酸和总VFA最大比吸收速率分别下降至0.27、0.12、0.53mmol C·(mmol C·h)-1。pH10.2情况下与pH9.2时基本相同。可以看出,当pH升高至9.2以上时丙酸的利用受到小幅度影响,而乙酸的利用受到严重的影响,同时乙酸利用速率的下降作为主要因素导致了VFA总量的利用速率下降。而当pH降低至5.2时,乙酸、丙酸和总VFA最大比吸收速率分别下降至0.29、0.12、0.48 mmol C·(mmol C·h)-1,与pH9.2时情况基本相同。当pH进一步降低至4.2时,几乎没有底物消耗。通过以上分析可知,嗜盐MMCs的最优pH范围是6.5~8.2。
2.2 pH对合成PHA组分的影响
文化调解并不意味着译员需要对所有具有文化特性的因素进行解释。实际上,只要有可能,口译员都应该促使双方进行直接交流。如果译员的调解策略恰当,这是完全可以做到的。请看下面的例子。
如图2所示为不同pH下嗜盐MMCs的PHA合成最大量。pH6.5时,系统在4 h时干细胞内PHA最大积累量达到29.8%,此时HV所占PHA的比例(质量比)为38.3%。当初始pH为8.2时与pH6.5条件下PHA最大合成量、HV比例及PHA积累到达最大值所需时间基本一致。当初始pH提高至9.2时,PHA最大合成量下降至28.2%。同时HV比例也下降至36.2%,所需时间也推迟至6 h。该下降趋势在pH提高至10.2时继续延续,PHA最大合成量、HV比例分别下降至24.9%、34.9%。当pH降低至5.2时,尽管达到PHA合成量最大值所需时间延长至6 h,但PHA合成最大量升高至34.2%,HV所占比例为36.7%。当pH进一步降低至4.2时,PHA合成基本维持为初始含量。

图2 不同初始pH下PHA合成最大量
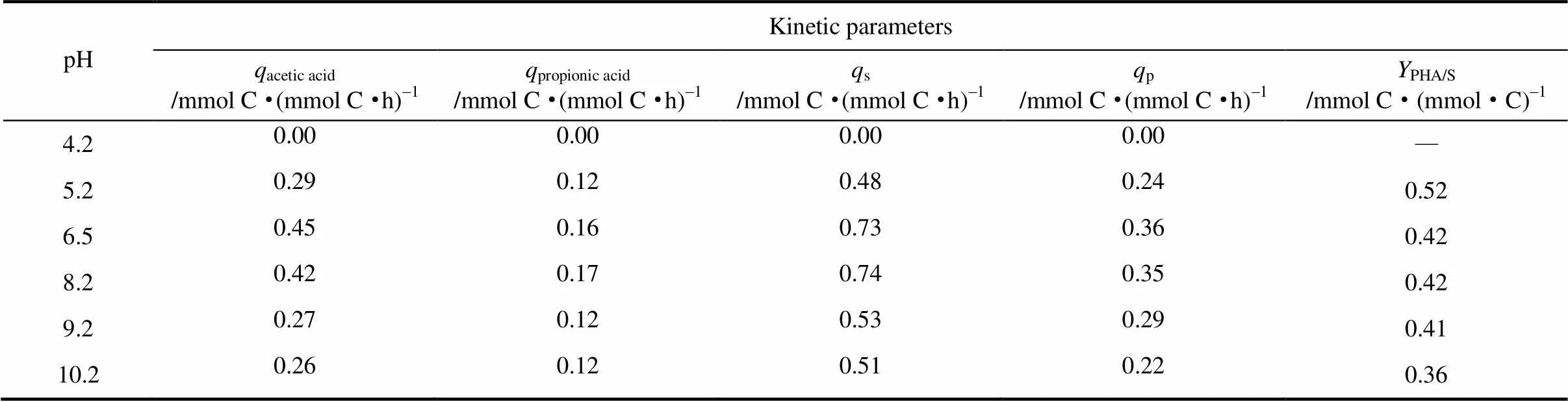
表2 不同pH下PHA合成实验中表观动力学参数
2.3 pH对PHA合成影响的机理
表3 以pH6.5为基点比较不同pH下VFA消耗与PHA合成情况
Table 3 Comparison of VFA consumption and PHA production between different pH conditions and pH6.5

表3 以pH6.5为基点比较不同pH下VFA消耗与PHA合成情况
pH 4.200 5.20.6580.667 6.511 8.21.0140.972 9.20.7260.806 10.20.6990.611
Note: , are the fastest specific substrate uptake rate and the fastest specific PHA storage rate in condition of pH6.5, respectively.
在不同初始pH下进水中各种VFA的离子状态浓度如表4所示,在pH4.2~9.2范围内离子状态的VFA量随着pH的增加而增加,则对应的未解离的VFA量随着pH的增加而减少。所以,在碱性条件下VFA大多呈离子状态带负电荷。而在微生物细胞外层同样带负电荷。根据同电相斥原理,离子状态的VFA不能通过渗透作用进入细胞内,只能通过主动运输等作用进入细胞内。Filipe[20]研究表明,未离解的VFA自由扩散进入微生物细胞不需要微生物呼吸供能。在较高的pH下离解的VFA进入细胞过程会明显增加耗量。Kashket[21]建立的基本生物能学等式中,当细胞膜两侧的电势差增加时底物进入细胞耗能也随之增加。当胞外pHout过高时会使PMF有减小的趋势。而微生物细胞在吸收VFA的过程中力图维持PMF不变,所以微生物细胞势将增大细胞膜两侧电势差,从而导致吸收VFA过程需要的能量随pH升高而增加。能耗的差异可能使pH升高不利于VFA底物的吸收利用。这可能是导致碱性条件下微生物利用底物受到抑制的主要原因。在酸性条件下VFA以未解离状态存在,可以通过不耗能的方式渗透进入细胞。
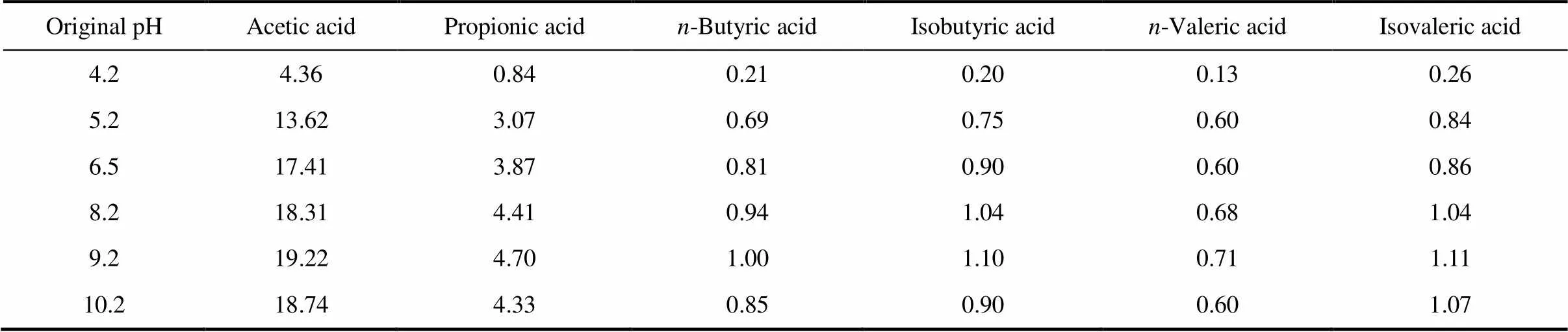
表4 进水中不同初始pH下离子状态VFA浓度
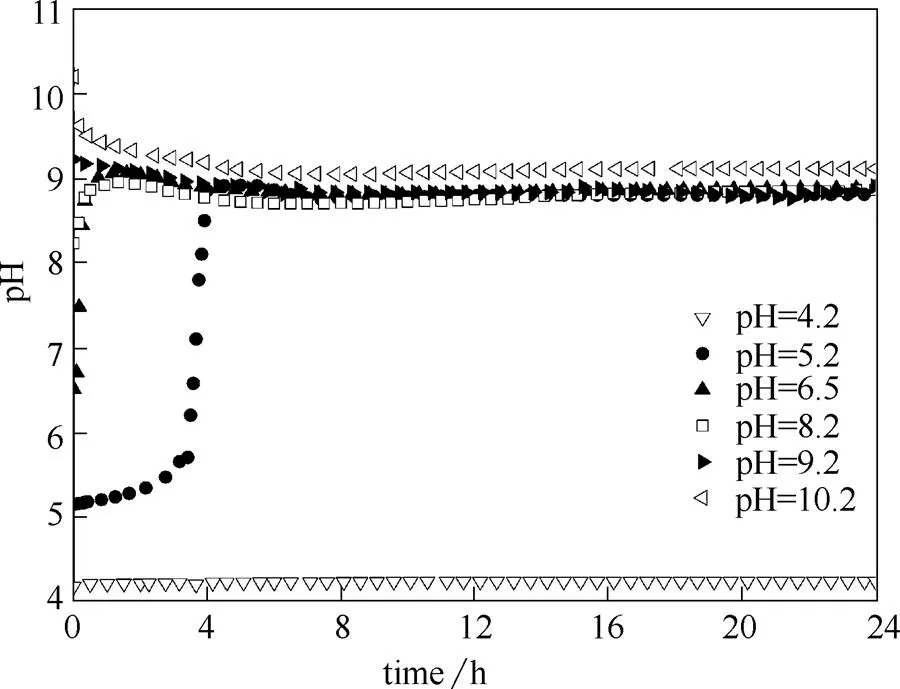
图3 不同初始pH下PHA合成过程中系统pH的变化情况
3 结 论
本研究以富集的嗜盐MMCs作为对象,集中研究了发酵体系的pH对发酵生产PHA的影响。嗜盐MMCs的PHA合成在初始pH 6.5~8.2范围内没有明显变化;当pH升高至9.2以上时底物利用速率会受到抑制,并由此导致PHA的合成量降低;酸性环境下,当pH5.2时微生物活性受到抑制,底物利用速率降低,但也降低了代谢及底物利用能耗量,导致PHA胞内降解利用下降,进而导致了PHA合成量升高。当PHA降低至4.2时微生物失去代谢能力不能进行PHA合成。PHA组分受pH影响不大,初始pH5.2~10.2时HV所占比例在34.9%~38.3%范围内。目前关于嗜盐MMCs的PHA合成研究很少,本研究从机理上对初始pH对嗜盐MMCs的影响进行了分析,对于嗜盐MMCs的进一步研究及工程化应用具有理论上的意义和指导作用。
References
[1] BRAUNEGG G, LEFEBVRE G, GENSER K F. Polyhydroxyalkanoates,biopolyesters from renewable resources: physiological and engineering aspects [J]. Journal of Biotechnology, 1998, 65 (2/3): 127-161.
[2] ZHU C, CHIU S, NAKAS J P,. Bioplastics from waste glycerol derived from biodiesel industry [J]. Journal of Applied Polymer Science, 2013, 130 (1): 1-13.
[3] NUMATA K, ABE H, IWATA T. Biodegradability of poly(hydroxyalkanoate) materials [J]. Materials, 2009, 2 (3): 1104-1126.
[4] CAMPANARI S, SILVA F A, BERTIN L,. Effect of the organic loading rate on the production of polyhydroxyalkanoates in a multi-stage process aimed at the valorization of olive oil mill wastewater [J]. International Journal of Biological Macromolecules, 2014, 71: 34-41.
[5] SAKAI K, MIYAKE S, IWAMA K,. Polyhydroxyalkanoate (PHA) accumulation potential and PHA-accumulating microbial communities in various activated sludge processes of municipal wastewater treatment plants [J]. Journal of Applied Microbiology, 2015, 118 (1): 255-266.
[6] BECCARI M, DIONISI D, GIULIANI A,. Effect of different carbon sources on aerobic storage by activated sludge [J]. Water Science and Technology, 2002, 45 (6): 157-168.
[7] MORALEJO-GARATE H, KLEEREBEZEM R, MOSQUERA- CORRAL A,. Impact of oxygen limitation on glycerol-based biopolymer production by bacterial enrichments [J]. Water Research, 2013, 47 (3): 1209-1217.
[8] JOHNSON K, VAN GEEST J, KLEEREBEZEM R,. Short- and long-term temperature effects on aerobic polyhydroxybutyrate producing mixed cultures [J]. Water Research, 2010, 44 (6): 1689-1700.
[9] WANG Y, GENG J, REN Z,. Effect of COD/N and COD/P ratios on the PHA transformation and dynamics of microbial community structure in a denitrifying phosphorus removal process [J]. Journal of Chemical Technology and Biotechnology, 2013, 88 (7): 1228-1236.
[10] 崔有为, 张宏宇, 冀思远, 等. 容积负荷变化模式对嗜盐混合菌发酵乙酸合成PHB的影响 [J]. 化工学报, 2015, 66 (10): 4177-4184. CUI Y W, ZHANG H Y, JI S Y,. Influence of organic loading rate change modes on PHB production by halophilic sludge fermenting acetate acid [J]. CIESC Journal, 2015, 66 (10): 4177-4184.
[11] 崔有为, 冀思远, 卢鹏飞, 等. F/F对嗜盐污泥以乙酸钠为底物生产PHB能力的影响 [J]. 化工学报, 2015, 66 (4): 1491-1497. CUI Y W, JI S Y, LU P F,. Influence of F/F on PHB production by halophilic activated sludge fed by sodium acetate [J]. CIESC Jorunal, 2015, 66 (4): 1491-1497.
[12] 周群英, 王士芬. 环境工程微生物学[M]. 3版. 北京: 高等教育出版社, 2008: 455. ZHOU Q Y, WANG S F. Microbiology of Environmental Engineering[M]. 3rd ed. Beijing: Higher Education Press, 2008: 455.
[13] CUI Y W, DING J R, JI S Y,. Start-up of halophilic nitrogen removalnitrite from hypersaline wastewater by estuarine sediments in sequencing batch reactor [J]. International Journal of Environmental Science and Technology, 2014, 11 (2): 281-292.
[14] 崔有为, 丁洁然, 卢鹏飞, 等. 嗜盐污泥反硝化亚硝酸盐的性能及其影响因素 [J]. 化工学报, 2012, 63 (8): 2584-2591. CUI Y W, DING J R, LU P F,. Performance and influencing factors of halophilic activated sludge in denitrifying of nitrite [J]. CIESC Journal, 2012, 63 (8): 2584-2591.
[15] JOHNSON K, JIANG Y, KLEEREBEZEM R,. Enrichment of a mixed bacterial culture with a high polyhydroxyalkanoate storage capacity [J]. Biomacromolecules, 2009, 10 (4): 670-676.
[16] JOHNSON K, KLEEREBEZEM R, VAN LOOSDRECHT M C. Influence of ammonium on the accumulation of polyhydroxybutyrate (PHB) in aerobic open mixed cultures [J]. Journal of Biotechnology, 2010, 147 (2): 73-79.
[17] American Public Health Association, American Water Works Association, Water Environment Federation. Standard methods for the examination of water and wastewater[S].USA: American Public Health Association, 1995.
[18] VILLANO M, BECCARI M, DIONISI D,. Effect of pH on the production of bacterial polyhydroxyalkanoates by mixed cultures enriched under periodic feeding [J]. Process Biochemistry, 2010, 45 (5): 714-723.
[19] 张运海. 利用混合菌群合成聚羟基烷酸酯工艺条件优化 [D]. 哈尔滨: 哈尔滨工业大学, 2010.ZHANG Y H. Process optimiza for polyhydroxyalkanoates production using mixed bacterial cultures [D]. Harbin: Harbin Institute of Technology, 2010.
[20] FILIPE C D M. Development of a revised metabolic model for the growth of phosphorus-accumulating organisms [J]. Water Environment Research, 1998, 70 (1): 67-79.
[21] KASHKET E R. Proton motive force in growingandunder aerobic and anaerobic conditions [J]. Journal Baecteriol., 1981, 146 (1): 377-389.
Influence of pH on PHA production by halophilic sludge fermenting mixed VFAs substrate
CUI Youwei, ZHANG Hongyu
(College of Environmental and Energy Engineering, Beijing University of Technology, Beijing 100124, China)
Polyhydroxyalkanoates (PHA) production by halophilic mixed microbial cultures (MMCs) draw a lot of attention because of great advantages, such as free sterilization, easily extraction and high production. In this study, halophilic MMC was used to investigate the effect of pH on PHA production in the mixed VFAs fermentation process. The results indicated that there was no significant influence on PHA production in the pH range of 6.5—8.2. PHA production rate and substrate utilization rate would be inhibited in lower or higher pH conditions. PHA yield was influenced by pH in the systems, but different influencing mechanism existed in acidic condition and alkaline condition. Alkaline environment led to higher dissociation degree of VFAs. Then more energy needed as substrates being absorbed, which further led to the decrease of VFAs absorption rate. This affect was obvious when pH raised to 9.2. Molecular-state VFAs changed intracellular pH in the acidic condition. Then, the lower activity of related enzymes and protein resulted in slower substrate utilization. Energy consumption of substrate utilization and microbial metabolism reduced when pH5.2, resulting in the decrease of intracellular PHA degradation and the increase of PHA yield. The pH value had little influence on PHA component. And HV accounted for 34.9%—38.3% of PHA weight when the initial pH between 5.2 and 10.2. This study would be a guide for PHA production using mixed VFAs as carbon source by halophilic MMCs.
polyhydroxyalkanoate; pH; volatile fatty acid; halophilic mixed microbial cultures
2016-01-19.
CUI Youwei, cyw@bjut.edu.cn
10.11949/j.issn.0438-1157.20160085
X 703
A
0438—1157(2016)10—4431—08
国家自然科学基金项目(51478011,51178004);北京市自然科学基金项目(8132013);北京市属高等学校高层次人才引进与培养计划项目。
2016-01-19收到初稿,2016-07-28收到修改稿。
联系人及第一作者:崔有为(1977—),男,博士,教授。
supported by the National Natural Science Foundation of China (51478011, 51178004), theNatural Science Foundation of Beijing (8132013) and the Importation and Development of High-Caliber Talents Project of Beijing Municipal Institutions.
