转化生长因子β1对自体移植肋软骨增殖及代谢的作用△
2016-10-25丁永清陈琦
丁永清 陈琦
·基础研究·
转化生长因子β1对自体移植肋软骨增殖及代谢的作用△
丁永清陈琦
目的评估体内环境下转化生长因子β1 (TGF-β1 )对自体移植肋软骨增殖及代谢的作用。方法健康新西兰白兔18只(1月龄,体重1 kg),随机分为空白对照组、凝胶对照组、5 ng/mL TGF-β1凝胶组、10 ng/mL TGF-β1凝胶组、手术对照组、5 ng/mL TGF-β1溶液组、10 ng/mL TGF-β1溶液组,每组各3只。截取兔右侧第7、8、9根带软骨膜肋软骨共4段,按不同组别处理后移植于背部皮下。移植术后8周,取出移植或空白对照的肋软骨,行大体观察及软骨切片苏木素-伊红(HE)染色、甲苯胺蓝染色,在光学显微镜下观察软骨显微结构变化情况,并检测软骨内糖胺多糖(GAG)含量。结果在本实验条件下,10 ng/mL TGF-β1凝胶组软骨细胞的增殖最活跃,GAG含量与空白对照组之间差异无统计学意义(P>0.05),但显著高于其他组,差异有统计学意义(P<0.05)。结论在体内环境下,TGF-β1能有效抑制幼年兔移植后软骨基质的降解,促进细胞增殖及外周基质的分泌,能明显抑制幼年兔移植后软骨细胞的凋亡、坏死,抑制软骨退行性变。10 ng/mL浓度较5 ng/mL浓度作用明显。TGF-β1与凝胶复合,可提高其疗效,可能与其缓慢释放、作用持久相关。(中国眼耳鼻喉科杂志,2016,16:239-242, 247)
肋软骨;自体移植;转化生长因子β1;糖胺多糖
自体肋软骨移植行耳廓再造术是耳廓缺损修复的主要方式,移植后肋软骨支架有远期吸收、挛缩可能。转化生长因子β1 (transforming growth factor β1,TGF-β1 )是调节软骨细胞增殖及代谢的重要生长因子之一。大量离体实验证实它能刺激软骨细胞的分裂增殖,增强蛋白多糖(proteoglycan,PG)及Ⅱ型胶原的合成;但TGF-β1对体内自体移植的肋软骨起何种作用,鲜有文献报道。本研究运用新西兰白兔,在体内环境下,局部应用不同浓度的TGF-β1于自体移植肋软骨旁,改善移植软骨周围局部条件,采用光学显微镜观察、生物化学定量测试等技术,探讨TGF-β1对自体移植肋软骨增殖及代谢的作用。
1 材料与方法
1.1材料普通级健康新西兰白兔18只,1月龄,体重1 kg左右,雌雄不限,购自上海市奉贤区泰日镇银根养兔室[许可证号:SCXK(沪)2010-0029]。TGF-β1(PeproTech公司,美国);人纤维蛋白原购自上海莱士公司;凝血酶购自浙江杭康药业有限公司;组织糖胺多糖(glycosaminoglycan,GAG)检测试剂盒购自GENMED公司。正置生物显微镜(DMR型,LEICA公司,德国);透射电镜是PHILIPS CM-120;冷冻离心机(Heraeus pico 17,Thermo公司);酶标仪(Synergy H1,BioTek公司)。
1.2方法将18只新西兰白兔随机分为空白对照组(A)、凝胶对照组(B)、5 ng/mL TGF-β1凝胶组(C)、10 ng/mL TGF-β1凝胶组(D)、手术对照组(E)、5 ng/mL TGF-β1溶液组(F)、10 ng/mL TGF-β1溶液组(G),其中B~G组每组各3只,A组为B组的非实验侧。
手术对照组将自体肋软骨取出,直接移植于背部皮下。凝胶对照组为取出后的软骨以不含TGF-β1的凝胶包被后移植于背部皮下。TGF-β1凝胶组将自体肋软骨取出后,与不同浓度(5、10 ng/mL)TGF-β1凝胶混合为软骨-生长因子复合物后移植于背部皮下;TGF-β1溶液组是先将移植的肋软骨浸泡于不同浓度(5、10 ng/mL)TGF-β1溶液中,再注射于背部移植处。纤维蛋白原(20 mg/mL)、凝血酶(20 U/mL)各0.25 mL等体积混合,制备成纤维蛋白凝胶,现用现配。
动物麻醉(25 mg甲苯噻嗪+2 mL氯胺酮,l mL/kg体重肌内注射)成功后,常规剃毛、消毒、铺无菌单。截取右侧第7、8、9带软骨膜肋软骨共4段,每段长约1 cm。按不同组别处理后移植于背部皮下,每只兔移植4段肋软骨。
移植术后8周,动物行空气针注射处死。取出移植的肋软骨及左侧空白对照组正常生理情况下生长的肋软骨,进行检测。大体观察包括:移植软骨与周围组织的粘连程度、色泽、透明度、弹性及硬度。石蜡切片用苏木素-伊红(hematoxylin and eosin, HE)、甲苯胺蓝染色,显微镜下观察。Leiea Qwin Standard软件拍照,观察细胞排列及细胞损坏程度。根据说明书行软骨GAG测定(阿尔新蓝法)。1.3统计学处理所有数据以均数±标准差表示。采用SPSS 19.0统计软件进行分析。满足正态分布、方差齐性采用方差检验;不满足的用秩和检验。检验水平α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1移植软骨大体观察术后8周,全部移植软骨与周围组织粘连较牢固,不易分离。仅E组有1例移植肋软骨出现短缩、吸收,其余移植软骨均未见明显的吸收、短缩。移植肋软骨呈乳白色、半透明、弹性好,与空白对照组软骨相似。
2.2光学显微镜下HE、甲苯胺蓝染色观察A组HE切片未见坏死灶, 软骨细胞生长活跃(图1、2)。C组软骨细胞增生,软骨中心部成熟细胞较少,出现基质分离现象(图5、6),D组标本未见坏死灶,软骨细胞增生活跃, 层次增加明显, 大量幼稚细胞增生,细胞间距缩小,甲苯胺蓝染色示胞外基质蓝色异染,软骨边缘染色较C组深,均匀(图7、8)。F组HE 切片可见软骨中心区灶性坏死,中心区软骨细胞发生退行性变、空泡变、细胞排列不齐,出现基质分离现象,边缘部软骨细胞及基质正常,甲苯胺蓝染色示软骨中心区染色较浅(图11、12)。G组幼稚细胞相对较少,成熟软骨细胞增加,细胞排列整齐(图13、14)。B组(图3、4)及E组(图9、10)大部分软骨中心区出现软骨细胞减少,部分软骨出现边缘性坏死。软骨细胞变性、数量减少、排列不规则,基质分离明显。甲苯胺蓝染色示胞外基质蓝色异染,染色欠均匀。
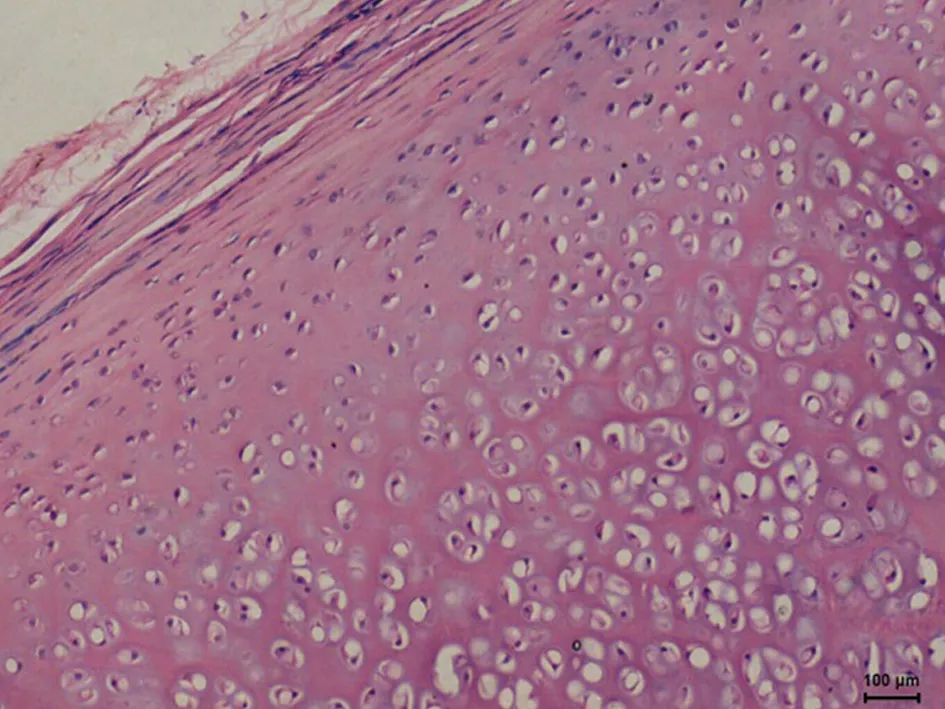
图1. A组HE染色(100×)

图2. A组甲苯胺蓝染色(100×)

图3. B组HE染色(100×)

图4. B组甲苯胺蓝染色(100×)
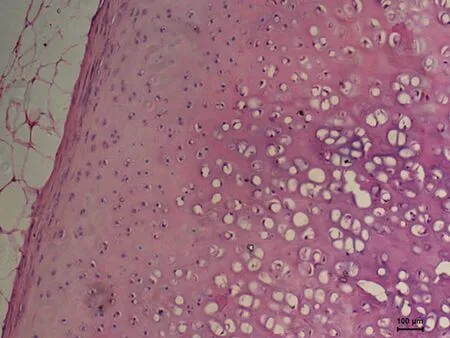
图5. C组HE染色(100×)
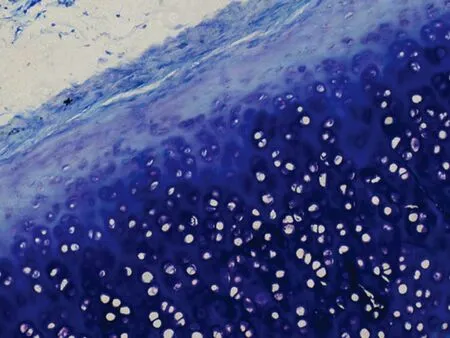
图6. C组甲苯胺蓝染色(100×)

图7. D组HE染色(100×)

图8. D组甲苯胺蓝染色(100×)
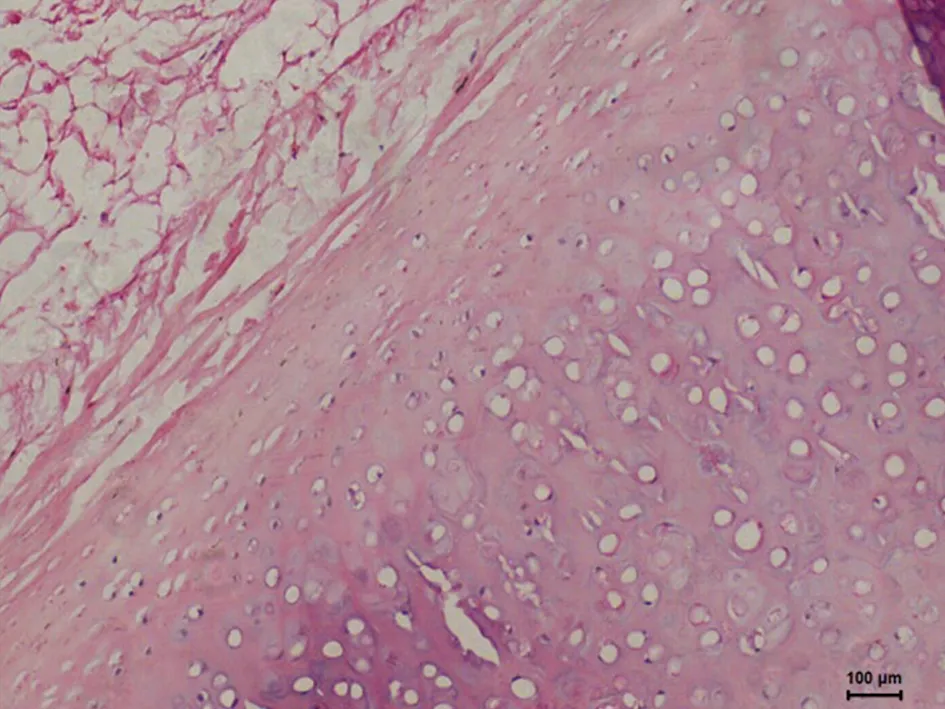
图9. E组HE染色(100×)
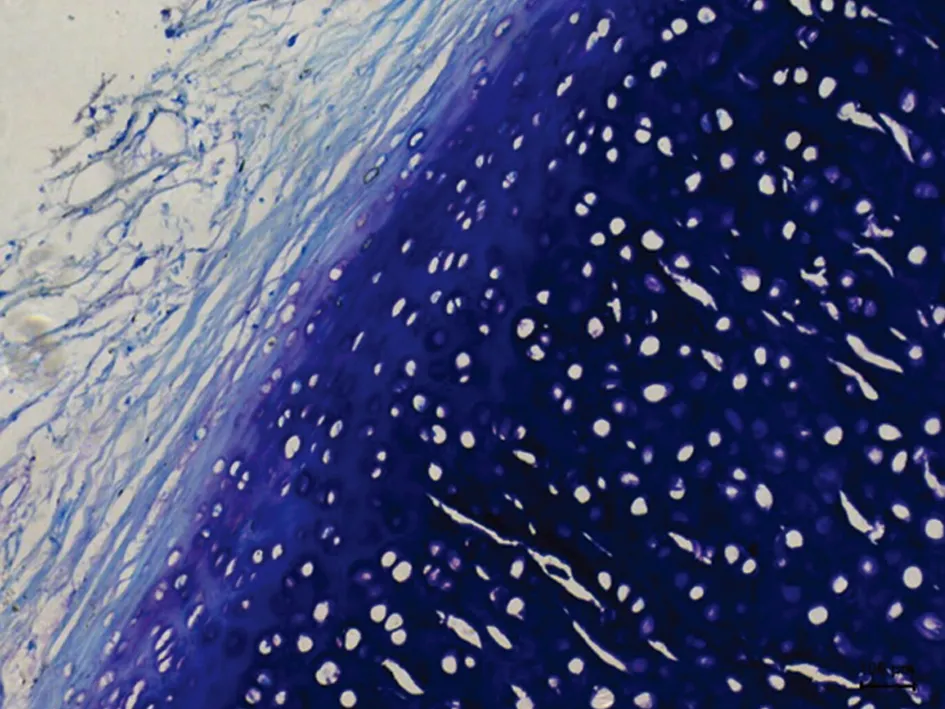
图10. E组甲苯胺蓝染色(100×)

图11. F组HE染色(100×)

图12. F组甲苯胺蓝染色(100×)

图13. G组HE染色(100×)

图14. G组甲苯胺蓝染色(100×)
2.3软骨GAG测定A组与D组软骨GAG含量差异无统计学意义,10 ng/mL的TGF-β1凝胶可抑制GAG降解,维持软骨正常功能。A组与除D组外的其他各组比较,GAG含量均降低,且差异有统计学意义。D组、C组及B组比较,GAG含量:D组>C组>B组。TGF-β1可抑制软骨GAG降解,且10 ng/mL作用更明显。G组、F组分别与E组比较,GAG含量差异有统计学意义;但G组和F组比较,差异无统计学意义,说明TGF-β1可抑制软骨GAG降解的作用,但溶液形式给药,浓度效果不明显。D组与G组比较,说明凝胶给药方式的TGF-β1作用效果更好。以上详见表1、2。
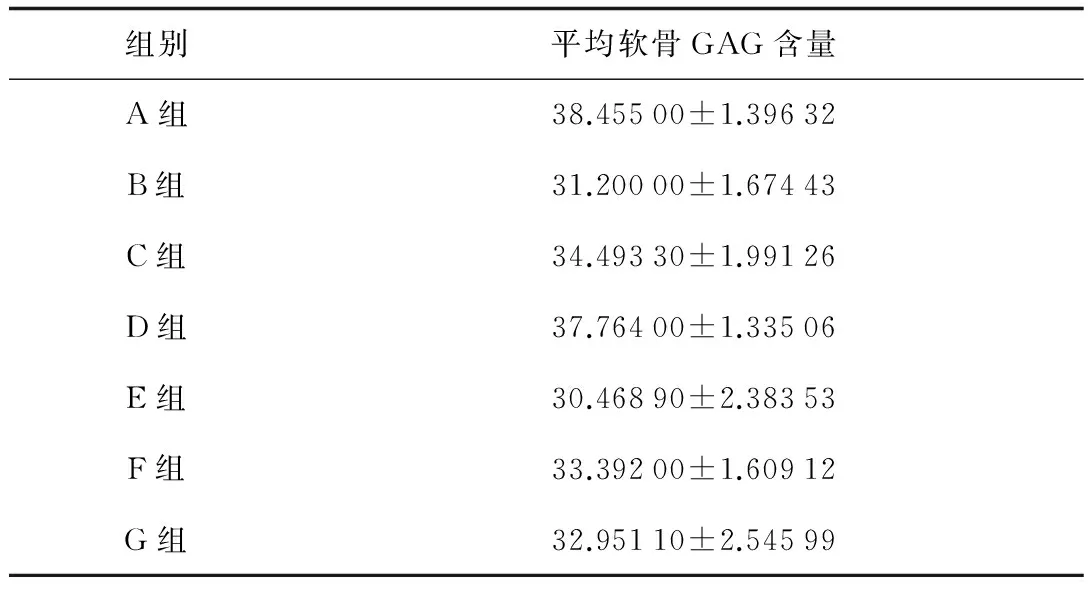
表1 各组的软骨GAG含量(μg/mg)
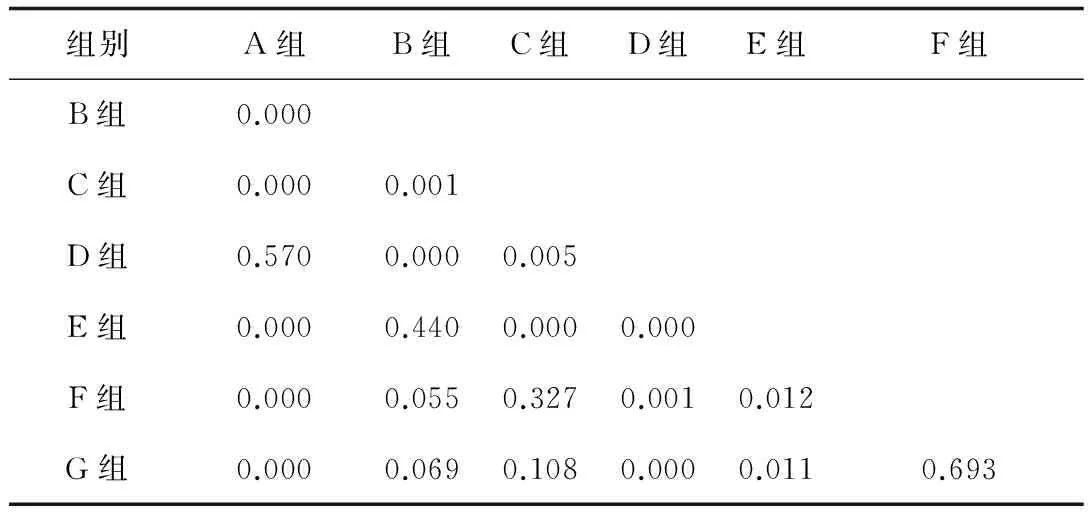
表2 各组间多重比较的P值
3 讨论
无耳及小耳畸形是一类严重影响听力和外观的先天畸形,目前报道我国发病率约为5.18/10 000[1-2]。及时行耳廓再造及听力重建,对于矫治患者心理疾患,改善日常生活质量具有非常重要的意义。
耳廓因其组织结构特殊且解剖形态复杂,再造手术是一项富有挑战性的工作[3]。耳廓再造术中支架材料的选择是决定术式的关键因素[4-6]。自体肋软骨因其组织相容性好、无排异反应、易存活、易雕刻成形等优点,是目前耳廓再造术最常用的支架材料[7-9];但是移植后的肋软骨支架存在不明原因的吸收与变形,导致再造耳廓扭曲、挛缩,影响手术效果[4]。这一直是自体肋软骨移植行耳廓再造术待解决的问题之一。
软骨组织主要由软骨细胞及细胞外基质组成。细胞外基质主要包含3种主要成分:PG、胶原(Ⅱ型胶原为主)和水。其中PG占软骨细胞外基质有机成分的90%,由核心蛋白和GAG以共价键结合而成[10]。在正常情况下,PG的合成与分解保持动态平衡,维持软骨结构与功能完整[11-12]。软骨自身不含血管及淋巴管, 但由于软骨基质内富含水分(约占软骨基质的75%),营养物质易于渗透,其营养主要靠周围组织液渗透而非血液供应。因此移植后软骨周围局部生存条件,尤其是周围营养条件对其存活、生长有很大影响。有研究[13]表明,自体移植后软骨基质中PG及胶原蛋白会发生降解及流失,是由于外部营养条件的限制导致软骨细胞移植后不能成活,基质合成能力较弱,从而导致软骨基质中GAG含量减少。TGF-β1 是一种多功能细胞因子,在软骨的修复重建过程中发挥重要作用。TGF-β1可能通过2种途径促进软骨缺损的修复:①发挥软骨诱导作用, 促进干细胞分化为软骨;②促进软骨特异性基质的合成, 如Ⅱ型胶原、PG等[10]。有文献[14]报道,在临床动物实验中,关节腔内注射TGF-β1,可调节关节软骨的新陈代谢,修复软骨损失,还可改变软骨的超微结构;体外实验证明,TGF-β1可促进软骨细胞的增殖及细胞外基质的合成。
本研究根据光学显微镜下HE、甲苯胺蓝染色结果发现,不同给药途径(TGF-β1凝胶、TGF-β1溶液)TGF-β1均可促进软骨细胞增殖,保持细胞活性,维持合成细胞外基质的能力,这与文献报道一致;同时发现,TGF-β1凝胶组使软骨细胞层次增加更明显, 增殖大量幼稚细胞,合成基质能力更强。不同浓度(5、10 ng/mL)相比较,10 ng/mL TGF-β1凝胶组使软骨细胞层次增加最明显, 增殖大量幼稚细胞,合成基质能力最强。
本研究根据软骨GAG定量分析,反映软骨中PG水平,评估移植后肋软骨退变的情况。D组与A组软骨GAG含量差异无统计学意义,且均高于其他组,差异显著,表明移植后的肋软骨GAG含量降低;而D组抑制GAG降解作用显著,维持GAG含量与正常生理情况下类似。B组与E组相比,差异无统计学意义,说明凝胶自身对移植后软骨无抑制或促进基质合成作用。D组、C组与B组比较,差异有统计学意义,均值D组>C组>B组,TGF-β1可抑制软骨基质降解,且10 ng/mL作用更明显。G组、F组分别与E组比较,差异有统计学意义;但G组和F组比较,差异无统计学意义,说明TGF-β1可抑制软骨基质降解,但溶液形式给药,浓度效果差异不明显。而D组与G组比较,差异有统计学意义,说明凝胶给药的作用效果更佳。
纤维蛋白凝胶主要由天然的细胞外基质成分构成,抗原性小,免疫排斥反应少,对细胞形态、生长、增殖及分化均没有抑制作用[15-16],近年来作为支架材料被广泛应用到组织工程学的研究中[17-18]。 有学者[16]发现,采用纤维蛋白原和凝血酶制备凝胶,加入生物活性肽或生长因子,可明显促进组织再生和伤口愈合。这与本研究结果一致。本研究制备的凝胶是由纤维蛋白原(20 mg/mL)、凝血酶(20 U/mL)各0.25 mL等体积混合而形成的立体网状结构生物材料,使TGF-β1吸附并与之复合。通过纤维蛋白凝胶逐渐降解,其中吸附的TGF-β1逐渐被释放出来,持续作用于移植肋软骨,改变周围局部微环境,从而更持久地发挥作用。而TGF-β1溶液效果差,原因可能是其半衰期短,在移植软骨周围存在时间较短,很快降解成为无活性的单体。作用时间较短,因此不足以渗透到软骨内部持续发挥作用,未能引起软骨细胞增殖或抑制基质的降解。
有文献[19]提出,纤维蛋白凝胶可保持长期不发生降解,故若包被软骨的凝胶过多、过厚,不能及时降解,影响移植肋软骨从周围组织中获取营养,可能阻碍移植软骨生长,导致软骨退行性变。本研究中凝胶对照组与手术对照组在光学显微镜下观察、GAG定量分析,均没有明显差别,说明纤维蛋白凝胶自身对移植后软骨无抑制或促进基质合成作用,且能及时降解,促使移植后肋软骨与周围组织获得联系。
总之,在体内环境下,TGF-β1能有效抑制幼年兔移植后软骨基质的降解,明显抑制幼年兔移植后软骨细胞的凋亡、坏死,促进细胞外周基质的分泌,抑制软骨退行性变。10 ng/mL较5 ng/mL浓度的效果更明显。TGF-β1与凝胶复合,可增加其疗效,可能与其缓慢释放、作用持久相关。
[1]Luquetti DV, Heike CL, Hing AV, et al. Microtia: epidemiology and genetics[J]. Am J Med Genet A, 2012,158(1):124-139.
[2]陈佳鹏, 张蕾, 陈功, 等. 中国1993—1998年出生缺陷监测能力分析[J]. 中华流行病学杂志,2006, 27(5): 392-395.
[3]Staffenberg DA. Microtia repair[J]. J Craniofac Surg, 2003, 14(4): 481-486.
[4]赵守琴,王丹妮. 先天性外中耳畸形耳廓再造及听力重建手术的远期疗效 [J].临床耳鼻咽喉头颈外科杂志, 2013,27(19):1045-1047.
[5]Siegert R, Magritz R.Reconstruction of the external ear[J]. Laryngorhinootologie, 2007,86(Suppl 1):S121-S140.
[6]宋春琼,焦烽,庄洪兴,等. 多孔高密度聚乙烯应用于扩张法耳廓再造术的临床研究[J].中国修复重建外科杂志, 2007,21(1):40-43.
[7]Brunelli A, Bottini DJ, Cervelli V, et al. Reconstruction of partially amputated external ear with costal cartilage graft: case report[J]. Acta Otorhinolaryngol Ital, 2004,24(3):150-156.
[8]Staudenmaier R, Aigner J, Kastenbauer E. Microtia: technique for external ear reconstruction with autologous rib cartilage[J]. Handchir Mikrochir Plast Chir, 2001,33(3):162-170.
[9]Siegert R, Weerda H, Magritz R. Basic techniques in autogenous microtia repair[J]. Facial Plast Surg, 2009,25(3):149-157.
[10]Frenkel SR, Saadeh PB, Mehrara BJ, et al. Transforming growth factor beta superfamily members: role in cartilage modeling[J]. Plast Reconstr Surg, 2000,105(3):980-990.
[11]Kamisan N, Naveen SV, Ahmad RE, et al. Chondrocyte density, proteoglycan content and gene expressions from native cartilage are species specific and not dependent on cartilage thickness: a comparative analysis between rat, rabbit and goat[J]. BMC Vet Res, 2013,9(1):62.
[12]Herz B, Albrecht A, Englbrecht M, et al. Osteitis and synovitis, but not bone erosion, is associated with proteoglycan loss and microstructure damage in the cartilage of patients with rheumatoid arthritis[J]. Ann Rheum Dis, 2014,73(6):1101-1106.
[13]陆晓娜, 王欢, 王盛, 等. 提高自体软骨移植物活性的研究进展简[J]. 组织工程与重建外科杂志, 2013,9(6):349.
[14]Grimaud E, Heymann D, Rédini F. Recent advances in TGF-beta effects on chondrocyte metabolism. Potential therapeutic roles of TGF-beta in cartilage disorders[J]. Cytokine Growth Factor Rev,2002,13(3):241-257.
[15]McDuffee LA, Esparza GB, Nino-Fong R, et al. Evaluation of an in vivo heterotopic model of osteogenic differentiation of equine bone marrow and muscle mesenchymal stem cells in fibrin glue scaffold[J]. Cell Tissue Res, 2014,355(2):327-335.
[16]Wu X, Ren J, Yao G, et al. Biocompatibility, biodegradation, and neovascularization of human single-unit platelet-rich fibrin glue: an in vivo analysis[J]. Chin Med J (Engl), 2014,127(3):408-411.
[17]Le Nihouannen D, Guehennec LL, Rouillon T, et al. Micro-architecture of calcium phosphate granules and fibrin glue composites for bone tissue engineering[J]. Biomaterials, 2006,27(13):2716-2722.
[18]Nagamine K, Okamoto K, Kaji H, et al. Bonding of synthetic hydrogels with fibrin as the glue to engineer hydrogel-based biodevices[J]. J Biosci Bioeng, 2014,118(1):94-97.
[19]Hench LL,Polak JM.Third-generation biomedical materials[J].Science,2002,295(5557):1014-1017.
(本文编辑杨美琴)
Effect of transforming growth factor β1 on the proliferation and metabolism of autografted costal cartilage
DING Yong-qing, CHEN Qi.
Department of Otorhinolaryngology,Eye Ear Nose and Throat Hospital of Fudan University, Shanghai 200031, China Corresponding author: CHEN Qi, Email: chenqiear@hotmail.com
ObjectiveTo evaluate the effect of transforming growth factor β1 (TGF-β1) on the proliferation and metabolism of costal cartilage autograftinvivo.MethodsEighteen healthy New Zealand white rabbits(1 month in age and 1 kg in weight) were randomly divided into 6 groups: fibrin glue(FG) control group, 5 ng/mL TGF-β1+FG group, 10 ng/mL TGF-β1+ FG group, surgical control group, 5 ng/mL TGF-β1+normal saline (NS) group, 10 ng/mL TGF-β1+NS group, with 3 rabbits in each group. All the rabbits were anesthetized and sterilized. Two pieces of the right eighth costal cartilage were taken and 2 pieces from the right seventh and ninth costal cartilage. The cartilage tissue was 1 cm in length and combined with the perichondrium. The four pieces of cartilage treated with the above different methods were implanted into the subcutaneous chamber of the rabbit back respectively. After 8 weeks, the autografted and the physiological costal cartilage were removed. The multiplication, degeneration and the cells viability of cartilage cells was observed with hematoxylin and eosin staining and toluidine blue staining. The microstructure of chondrocyte were observed under the optical microscope and glycosaminoglycan (GAG) content were measured.ResultsThe chondrocyte proliferate was most active in the 10 ng/mL TGF-β1 +FG group and the content of GAG was similar to the blank control group (the left costal cartilage of the rabbits) (P>0.05), but significantly higher than other groups (P<0.05).ConclusionsTGF-β1 promotes the proliferation of chondrocytes and maintains their synthesis of specific matrix. TGF-β1 could obviously inhibit the apoptosis and necrosis of chondrocytes. The effect of 10 ng/mL TGF-β1 is superior to the effect of 5 ng/mL TGF-β1. As the carrier of TGF-β1, FG has a certain slow-released effect on TGF-β1 and could delay the degradation of TGF-β1.(Chin J Ophthalmol and Otorhinolaryngol, 2016,16:239-242, 247)
Costal cartilage; Autograft; Transforming growth factor β1; Glycosaminoglycan
上海市卫生局局级科研项目(2010269)
复旦大学附属眼耳鼻喉科医院耳鼻喉科上海200031
陈琦(chenqiear@hotmail.com)
现在河北北方学院附属第一医院耳鼻喉科张家口075000
10.14166/j.issn.1671-2420.2016.04.003
2015-06-08)
