应用流式细胞分选技术高效纯化大鼠视网膜神经节细胞及其鉴定△
2016-10-25杨伯齐高凤娟吴继红
杨伯齐 高凤娟 吴继红
·基础研究·
应用流式细胞分选技术高效纯化大鼠视网膜神经节细胞及其鉴定△
杨伯齐高凤娟吴继红
目的探索一种高效、稳定的纯化视网膜神经节细胞(RGC)方法。方法结合免疫抗体吸附方法,利用流式细胞仪分离新生大鼠RGC,并采用流式细胞及荧光定量聚合酶链反应(PCR)技术检测分选RGC的纯度。结果新生SD大鼠视网膜混合细胞为(4.37±0.22)×106个/视网膜,通过流式细胞仪分离出Thy1.1阳性的RGC为 (5.70±0.21)×103个/视网膜;荧光定量PCR及流式细胞分析结果均显示此方法分离的RGC细胞纯度高,可达90.11%,且纯度高低可控。结论通过流式细胞分选技术可获得较高纯度的RGC。该方法分选速度快、稳定,为深入开展RGC的体外研究,提供了一种理想的、基于流式细胞仪的细胞快速分离纯化方法。(中国眼耳鼻喉科杂志,2016,16:234-238)
视网膜神经节细胞;细胞纯化;流式细胞分选;细胞鉴定
视网膜神经节细胞(retinal ganglion cell,RGC)是视网膜内唯一连接脑部并将视网膜信息传递到大脑的神经元[1]。许多疾病可造成RGC的损伤和死亡而导致永久性失明,如青光眼、糖尿病视网膜病变、脱髓鞘性疾病、肿瘤、视神经病变、缺血和外伤等[2- 4]。尽管目前大量研究致力于RGC损伤及凋亡的机制,但对于引起RGC进行性凋亡的发生机制仍不十分清楚[5-6]。为此,国内外研究者以RGC为靶细胞,进行了大量的动物实验和体外研究[7-8],研究该细胞的生物学特性及其损伤机制,寻找阻止或延缓RGC凋亡的途径及方法等。
体外实验是深入研究RGC损伤和保护的重要且不可或缺手段,可以排除在体环境下其他细胞、因子等因素对RGC的影响,更加准确地研究RGC的信号通路、基因表达、电生理特性等,因此建立高效、稳定的RGC分离纯化方法显得极为重要。RGC位于视网膜内层,占视网膜总细胞数量的不到1%,这也使其分离、纯化更加困难[1, 9]。目前分离、纯化细胞的方法有多种,常用的有免疫抗体吸附法、免疫磁珠细胞分选、流式细胞分选等[4, 10-11]。
过去许多研究应用免疫抗体吸附法或免疫磁珠细胞分选方法分离RGC,但因视网膜中胶质细胞和RGC结合非常紧密,免疫抗体吸附法操作时间较长、过程也较复杂,纯化效率相对低,且纯度有一定波动,存在不稳定的缺点[12];而免疫磁珠细胞分选方法成本昂贵、对操作者技术要求较高[13],不易在短时间内掌握。流式细胞技术是一项新型的生物分析技术,不仅可以对细胞、微生物等进行检测分析,而且还可以根据颗粒特性进行分选,具有检测速度快、测量指标多、采集数据量大等特点,已在血液细胞及肿瘤细胞分类中得到很好的应用[14-16]。但针对RGC的流式纯化方法国内外鲜见报道。若能建立稳定、高效流式分选RGC的方法,必将有助于该领域研究的深入开展。为此我们反复实践摸索,建立了一种较为完善的流式细胞仪分选RGC的方法。该分选方法操作较简单且快速稳定,可以在短时间内获得纯度高、数量多的RGC,为RGC的体外研究提供了一种理想的基于流式细胞仪的细胞快速分离、纯化方法。现报道如下。
1 材料与方法
1.1视网膜细胞悬液的制备出生1~3 d的SD大鼠,雌雄不限,于体积分数为75%的乙醇中浸泡处死。无菌状态下摘除眼球,将眼球置于Earles平衡盐溶液(Earles balanced salt solution,EBSS)中。在立体显微镜(解剖显微镜)下依次去除角膜、晶状体和玻璃体,钝性分离视网膜神经上皮层,并撕去视网膜血管层,在磷酸盐缓冲液(phosphate buffer saline,PBS)中漂洗2次。将视网膜组织置于已配制好的木瓜蛋白酶消化液(5 mg/mL 木瓜蛋白酶, 0.24 mg/mL L-半胱氨酸, 10 U/mL DNase Ⅰ)中,37 ℃消化25~30 min后,加入0.1%卵类黏蛋白溶液(西格玛奥德里奇)终止消化,200 g 离心10 min,弃上清液。加入7 mL含0.05%牛血清白蛋白(bovine serum albumin,BSA)的最低基础培养液(minimum essential medium,MEM)培养基中重悬细胞。
1.2巨噬细胞的去除将视网膜细胞悬液经孔径为40 μm的过滤器过滤,倒入预先用抗大鼠巨噬细胞抗体包被的培养皿中,37 ℃,45~60 min后,收集细胞悬液,4 ℃,300 g离心10 min后,弃上清液,PBS洗涤3次。
1.3流式抗体标记细胞计数后用流式缓冲液重悬( 1×107细胞用500 μL缓冲液重悬)。流式缓冲液: PBS,pH =7. 2,加入0. 5% BSA及2 mol 乙二胺四乙酸(EDTA)。加入10 μL Thy1-PE 抗体,同时另一组加入同型IgG-PE抗体作为阴性对照。避光冰上标记15 min,PBS洗涤2次。将细胞重新用100 μL流式缓冲液悬起,细胞过滤器过滤后进行流式细胞分选。
1.4流式细胞仪分选本实验使用的流式细胞仪为贝克曼MoFlo XDP。流式细胞分选仪调试参数后,限定分选条件,进行分选。首先在FSC/SSC散点图中设门圈活细胞群, 排除凋亡细胞和碎片。然后在SSC/ FL2散点图中设置分选门控,分选出Thy1.1+细胞。因为RGC表达Thy1.1的量不同,我们设置了2个分选门,R10 代表低表达Thy1.1组,R21代表高表达Thy1.1组(图1,R10+R21代表混合组)。 分选后的细胞置于完全培养基中。
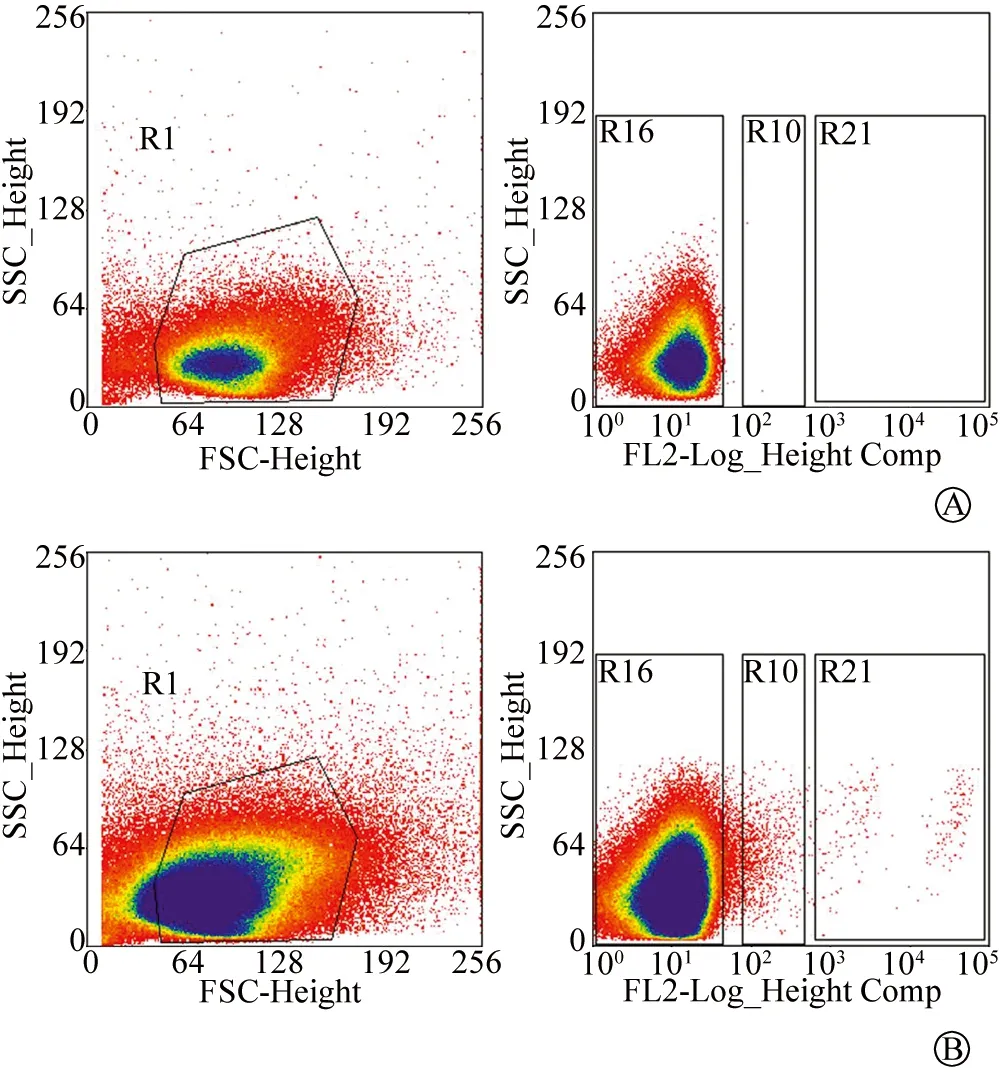
图1. 流式细胞分选参数设置 A为阴性对照组,B为Thy1.1+组。 R10为低表达组,R21为高表达组。X轴:FSC,前向角散射,FL2通道荧光强度;Y轴:SSC,侧向角散射
1.5纯化RGC的流式鉴定收集纯化后的RGC,加入75%冷乙醇固定细胞,室温,20 min;加入PBS离心洗涤2次;依次加入0.4%Triton X-100透膜、3%BSA封闭非特性位点。离心,加入兔抗大鼠一抗Brn3a(1∶50,Abcam),4 ℃,60 min;洗涤2次后,加入抗兔FITC-IgG,避光孵育60 min;阴性对照以PBS代替一抗,其余处理步骤同上。将细胞悬液经流式分析:激发光波长为488 nm,FITC通道。
1.6荧光定量聚合酶链反应分析纯化后的RGC离心,收集,按照RNA提取试剂盒(Qiagen,德国)及cDNA合成试剂盒(Takara,日本)说明操作。在NCBI Gene 库中查找大鼠β-actin(内参基因)、胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP,胶质细胞标志蛋白)、突触融合蛋白1(syntaxin1,无长突细胞标志蛋白)、Thy1.1及Brn3a(RGC标志蛋白)的基因序列,采用Primer 5.0 软件设计引物并且由生工生物工程有限公司(上海)合成。按照实时荧光定量聚合酶链反应(polymerase chain reaction, PCR) 试剂盒(Takara,日本)说明操作。定量PCR 荧光染料采用SYBR green(Roche,Germany),在ABI 7500(美国应用生物系统公司,加利福尼亚州,美国)完成热循环反应。所有样本每次实验设3个复孔,靶基因的表达量以2- ΔΔCt方法计算。合成的目的基因及内参基因PCR引物见表1。

表1 合成的目的基因及内参基因PCR引物
1.7统计学处理实验重复6次,每次应用30~40只SD大鼠,所有数据以均数±标准差表示。采用SPSS 16.0统计软件对实验数据进行分析。组间计量资料数据比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1视网膜混合细胞获得率平均可分离(4.37±0.22)×106个/视网膜(表2)。视网膜混合细胞悬液经抗巨噬细胞抗体包被的培养皿中孵育(图2A、2B)后,部分含有抗巨噬细胞抗体的细胞被吸附(图2C、2D),剩余视网膜混合细胞悬液约含(3.13±0.45)×106个/视网膜(表2)。

表2 分离、纯化RGC过程中细胞数量的定量分析
2.2流式细胞分选结果流式细胞分选仪以PE-Thy1.1作为表面标志阳性(图1B),同型PE-IgG作为阴性对照(图1A),分选目的细胞群为Thy1.1+即为RGC。由于RGC表面Thy1.1的表达量不同,将阳性群分为R10、R21两个区域,分别代表Thy1.1低表达群及Thy1.1高表达群。R10+R21区域平均分离RGC个数为(5.70±0.21)×103个/视网膜,其中R21区域平均分离RGC个数为(2.90±0.13)×103个/视网膜(表2)。
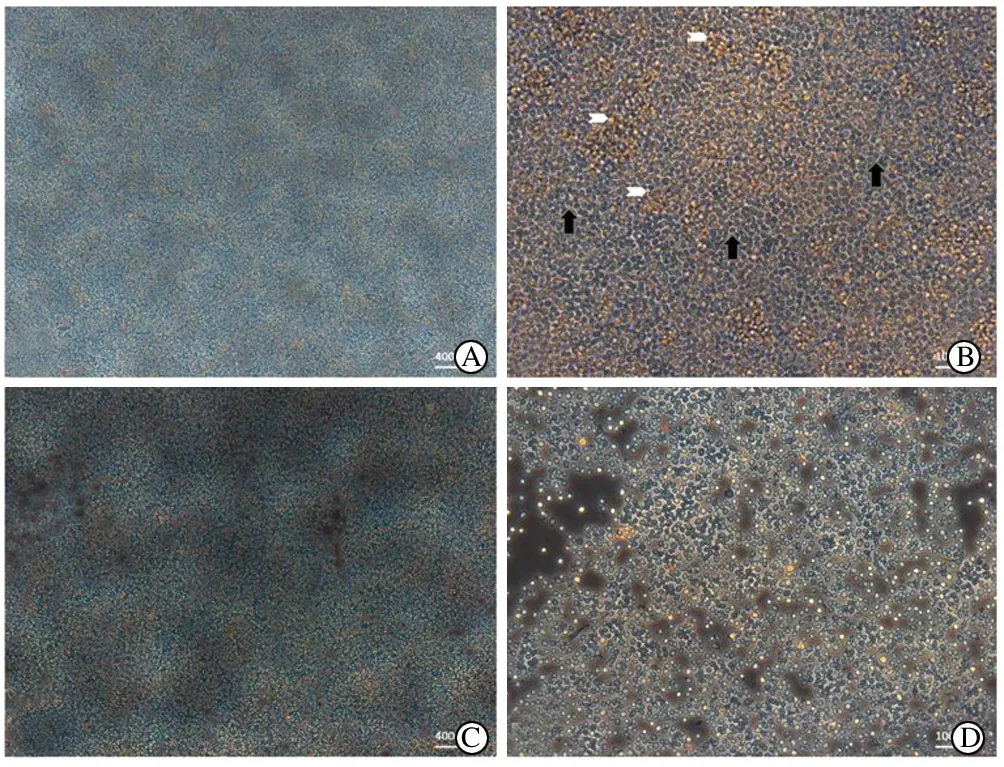
图2. 视网膜混合细胞悬液于抗巨噬细胞抗体包被的培养皿中孵育 A、B分别为50倍和200倍物镜下视网膜细胞悬液孵育图片,白色箭头为未吸附的悬浮细胞,黑色箭头为吸附细胞;C、D分别为孵育结束后,去除上层视网膜悬液,剩余被吸附细胞的50倍和200倍的物镜下图片
2.3RGC纯度鉴定因为在细胞分选过程中Thy1.1的结合位点已被占用,为了鉴定分离出来的RGC纯度,我们选用另外一个RGC的标志蛋白Brn3a。 经流式细胞仪回鉴定后,结果显示RGC的纯度约为90.11%(图3)。此外,我们还采用荧光定量PCR分别检测了RGC的标志蛋白Thy1.1及Brn3a,胶质细胞标志蛋白GFAP, 无长突细胞标志蛋白syntaxin1mRNA的表达量(表3)。如图4显示,高表达组Thy1.1含量显著高于低表达组及混合组(P<0.01);3组细胞Brn3a的表达同Thy1.1(P<0.05);3组细胞中均含有syntaxin1mRNA的表达,而GFAP只在低表达组中有表达,高表达组中未检测到GFAP mRNA的表达。
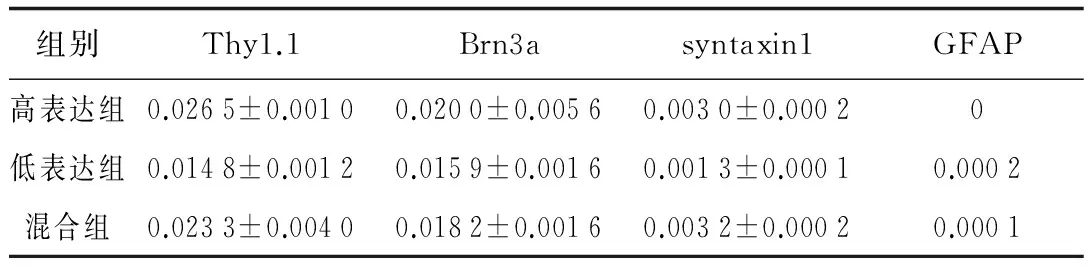
表3 流式分选的3组RGC mRNA的表达
3 讨论
将RGC从视网膜中分离、纯化,以便深入研究单一细胞群体的生理和病理过程及其分子机制,是进行眼内多种疾病发病机制探索的基础。因此寻求一种简便易行、高效稳定且高纯度的RGC分离、纯化方法,对深入探讨RGC 损伤后的细胞学和分子生物学机制具有十分重要的意义。
目前常用的分选RGC方法为免疫抗体吸附法,但此法耗时较长,过程复杂,且分离的RGC中混杂一定比例的视网膜细胞,可对实验结果产生一定的干扰[11]。越来越多的研究采用免疫磁珠抗体法分选RGC,此法分选的RGC纯度明显高于前者,但是细胞活性比前者低,且对仪器设备有要求,实验成本明显增加。基于流式细胞仪的推广,近年来越来越多的研究选用流式细胞分选。此方法的原理是,使用偶联荧光染料的特异性单克隆抗体标记细胞,制备细胞悬液,细胞悬液经过流动的喷嘴时,使鞘液流成为上万个微滴,微滴以微滴细流的形式通过激光束,此时细胞的荧光和散射光信号被测量,给鞘液流一个充电脉冲信号使待分选的液滴带上电荷。流式细胞分选仪的检测分析系统通过分选设门特性迅速判定其是否为分选目的细胞。当带电荷细胞的鞘液滴流经带有强大电场的偏转板时,不同细胞就根据自身所带的电荷性质产生偏转而落入各自的容器中,从而实现了细胞的分选[17-18]。现代高端型流式细胞分选仪每秒可以选数万个细胞,仪器可选配3~9根激光管,最多可检测18个荧光参数,从而满足日益多元化、深入的前沿科学研究需要[19]。
本实验采用的是贝克曼流式细胞仪,与传统的流式细胞仪相比较,具有分选效率高、精确度更高、自动化程度高的特点。由于视网膜巨噬细胞也表达Thy1.1抗体[9],为了增加分选的纯度,我们结合免疫抗体吸附方法,先将巨噬细胞去除,再利用流式细胞分选技术分离高纯度的RGC。此方法分选RGC所用时间明显短于免疫抗体吸附及磁珠法,且RGC的纯度极高,结果稳定性极好,并且可以通过调整仪器参与控制分选RGC的纯度,对于易受其他杂细胞影响或干扰极大的实验,选择此法分选RGC更佳。然而,在实际使用过程中,分选细胞的生物学活性、回收率、纯度等分选指标经常会受到许多干扰因素的影响,最终会导致无法获取理想的实验结果。经过反复的摸索探究,我们总结出以下几点经验:①视网膜细胞悬液要充分分离为单细胞悬液;②确保流式液流的连续性和稳定性;③仪器使用前校淮;④细胞先富集、再分选;⑤控制分选速度;⑥设门清晰,否则严重影响细胞纯度。本研究是采用大鼠视网膜细胞进行分离、纯化,是否对人或其他动物,如小鼠、兔等同样可以分选出高纯度的RGC,有待进一步探究。
总之,流式细胞分选技术作为一种高效、迅速、稳定分选RGC的方法,可以纯化出较高纯度的RGC,排除其他细胞对研究结果的干扰及影响,为RGC的研究奠定了基础。
[1]Dräger UC, Olsen JF. Ganglion cell distribution in the retina of the mouse[J]. Invest Ophthalmol Vis Sci, 1981,20(3):285-293.
[2]Farkas RH, Grosskreutz CL. Apoptosis, neuroprotection, and retinal ganglion cell death: an overview[J]. Int Ophthalmol Clin, 2001, 41(1):111-130.
[3]Wu JH, Zhang SH, Nickerson JM, et al. Cumulative mtDNA damage and mutations contribute to the progressive loss of RGCs in a rat model of glaucoma[J]. Neurobiol Dis, 2015, 74:167-179.
[4]Chang ZY, Lu DW, Yeh MK, et al. A novel high-content flow cytometric method for assessing the viability and damage of rat retinal ganglion cells[J]. PloS One, 2012, 7(3):e33983.
[5]Lin B, Peng EB. Retinal ganglion cells are resistant to photoreceptor loss in retinal degeneration[J]. PloS One, 2013, 8(6):e68084.
[6]Williams PA, Thirgood RA, Oliphant H, et al. Retinal ganglion cell dendritic degeneration in a mouse model of Alzheimer disease[J]. Neurobiol Aging, 2013, 34(7):1799-1806.
[7]Vecino E, Heller JP, Veiga-Crespo P, et al. Influence of extracellular matrix components on the expression of integrins and regeneration of adult retinal ganglion cells[J]. PloS One, 2015, 10(5):e0125250.
[8]Kwon OJ, Lee ES, Jeon CJ. Density and types of calretinin-containing retinal ganglion cells in rabbit[J]. Neuroscience, 2014, 278(15):343-353.
[9]Barres BA, Silverstein BE, Corey DP, et al. Immunological, morphological, and electrophysiological variation among retinal ganglion cells purified by panning[J]. Neuron, 1988, 1(9):791-803.
[10]Winzeler A, Wang JT. Purification and culture of retinal ganglion cells[J]. Cold Spring Harb Protoc, 2013(7): 614-617.
[11]Hong S, Iizuka Y, Kim CY, et al. Isolation of primary mouse retinal ganglion cells using immunopanning-magnetic separation[J]. Mol Vis, 2012, 18:2922-2930.
[12]Winzeler A, Wang JT. Purification and culture of retinal ganglion cells from rodents[J]. Cold Spring Harb Protocc, 2013(7): 643-652.
[13]Zhang XM, Li Liu DT, Chiang SW, et al. Immunopanning purification and long-term culture of human retinal ganglion cells[J]. Mol Vis, 2010, 16(307/309):2867-2872.
[14]黄莹莹. 流式细胞分选术的应用进展[J].科技视界, 2013(3):173,153.
[15]陈媛, 巩伟丽, 湛小燕,等. 应用流式细胞分选技术分离人外周血原代单核细胞[J]. 科学技术与工程, 2012, 12(24):5985-5988.
[16]Wylot B, Konarzewska K, Bugajski L, et al. Isolation of vascular endothelial cells from intact and injured murine brain cortex-technical issues and pitfalls in FACS analysis of the nervous tissue[J]. Cytometry A, 2015, 87(10):908-920.
[17]郑海萍, 李艳辉. 流式细胞仪的原理及应用[J]. 邯郸医学高等专科学校学报, 2003,16(3):286.
[18]马洪星, 张春斌, 汪晶冰, 等. 流式细胞术的原理及临床应用[J]. 中国优生与遗传杂志, 2003,11(4):145-146.
[19]石亚萍, 种银保, 王晴. 高端流式细胞分选仪的选型评价[J]. 医疗卫生装备, 2010, 31 (10):122-123,125.
(本文编辑诸静英)
Purification of rat retinal ganglion cells by using flow cytometry sorting technology and its identification
YANGBo-qi,GAOFeng-juan,WUJi-hong.
DepartmentofOphthalmology,EyeEarNoseandThroatHospitalofFudanUniversity,Shanghai200031,ChinaCorresponding author: WU Ji-hong, Email: jihongwu@fudan.edu.cn
ObjectiveTo establish an efficient and stable method for retinal ganglion cells (RGCs) purification. MethodsRat RGCs were separated by using flow cytometric (FC) technology combined with immunopanning. Then flow cytometry and fluorescence quantitative polymerase chain reaction (PCR) were performed to analyze the purity of RGCs. Results(4.37±0.22)×106cells per retina and (5.70±0.21)×103Thy 1.1-positive RGCs per retina were separated by using flow cytomety. The results of fluorescence quantitative PCR and flow cytometry showed that the purity of RGCs isolated by this method was as high as 90.11%, and the purity of the isolated cells was controllable. ConclusionsThe study provides a rapid method for sorting rat RGCs based on the flow cytometric technology. The sorting method is stable and efficient, and can be used for further research.(Chin J Ophthalmol and Otorhinolaryngol,2016,16:234-238)
Retinal ganglion cells; Cell purification; Flow cytometric cell sorting; Cell identification
国家自然科学基金(81470624)
复旦大学附属眼耳鼻喉科医院实验中心上海市视觉损害与重建重点实验室卫生部近视眼重点实验室 上海200031
吴继红(Email:jihongwu@fudan.edu.cn)
10.14166/j.issn.1671-2420.2016.04.002
2016-05-04)
杨伯齐和高凤娟为共同第一作者
