患者术前BMI与胃癌临床病理参数、手术并发症及预后的关系
2016-10-24王力宋国栋李盟沈洪
王力,宋国栋,李盟,沈洪
(天津医科大学第二医院,天津300211)
患者术前BMI与胃癌临床病理参数、手术并发症及预后的关系
王力,宋国栋,李盟,沈洪
(天津医科大学第二医院,天津300211)
目的探讨BMI与胃癌临床病理参数、手术并发症及预后的关系。方法 行根治手术治疗的胃癌患者466例,根据术前BMI将患者分为体重过低组(BMI<18.5)64例、正常体重组(BMI 18.5~24.0)256例、超重组(BMI≥24.0)126例。收集三组患者年龄、性别、术前血红蛋白水平、术前白蛋白水平、术后病理分化程度、肿瘤最大径、肿瘤浸润深度、淋巴结清扫数目、淋巴结转移情况、TNM分期、手术并发症、围手术期死亡及预后情况等资料,并进行分析。结果 三组淋巴结转移分期(N分期)及转移淋巴结数目相比,P均<0.05。胃癌患者术前BMI与术前血清白蛋白水平呈正相关关系(r=0.120,P=0.019),与手术清扫淋巴结数目呈负相关关系(r=-0.168,P=0.001),与转移淋巴结数目呈正相关关系(r=0.163,P=0.001)。466例患者中80例(17.9%)出现术后并发症,体重过低组、正常体重组、超重组发生术后并发症的例数分别为10、40、30例,三组相比,P均>0.05。8例患者围手术期死亡,其中体重过低组1例、正常体重组4例、超重组3例,三组相比,P均>0.05。体重过低组、正常体重组、超重组5年生存率分别为30.6%、43.7%、26.1%,三组相比,P均<0.05。单因素分析结果显示,BMI与患者生存相关;多因素分析结果显示,BMI并非胃癌的独立预后因素。结论 术前BMI与胃癌患者血清白蛋白水平、手术清扫淋巴结数目及转移淋巴结数目有关。胃癌患者术前BMI与手术并发症无明显关系,但与胃癌患者预后有一定关系,BMI过高或过低者预后较BMI正常者差。
胃肿瘤;胃癌;体质量指数;手术并发症
胃癌是最常见的恶性肿瘤之一[1],恶性度高,病死率高。营养状态与肿瘤患者的治疗效果和预后密切相关,营养不良是胃癌患者围手术期手术并发症与死亡的高危因素。目前肥胖患者在胃癌患者中的比例日趋增多[2,3],肥胖增加了手术难度与手术并发症发生率[4]。有研究[5]表明BMI与胃癌预后呈U型关系,过高和过低的BMI都降低患者的生存率。也有学者认为BMI与胃癌预后并无关系[6]。为此,本研究对BMI与胃癌临床病理参数、手术并发症及预后的关系进行了探讨,现报告如下。
1 资料与方法
1.1研究对象共纳入胃癌患者466例,男307例、女139例,年龄23~81岁、中位年龄60岁,术前平均BMI为22.1。根据术前BMI将患者分为体重过低组(BMI<18.5)64例、正常体重组(BMI 18.5~24.0)256例、超重组(BMI≥24.0)126例。
1.2资料收集与分析收集三组患者年龄、性别、术前血红蛋白水平、术前白蛋白水平、术后病理分化程度、肿瘤最大径、肿瘤浸润深度、淋巴结清扫数目、淋巴结转移情况、TNM分期、手术并发症、围手术期死亡及预后情况等资料,并进行分析。依据患者病理分期[10]进行术后化疗,化疗方案以铂类和氟尿嘧啶类为基础。术后随访以电话随访和门诊随访为主。随访时间最长96个月,中位随访时间32个月,随访截止于2015年10月。生存时间以手术日期到死亡日期或随访最后日期计算。
1.3统计学方法采用SPSS20.0统计软件。计数资料采用χ2检验;计量资料采用单因素方差分析;相关性分析采用Pearson相关分析法;生存率计算采用Kaplan-Meier法,组间生存率采用Log-rank检验,以Cox回归模型进行多因素生存分析。P<0.05为差异有统计学意义。
2 结果
2.1三组临床病理参数比较体重过低组男45例、女19例,年龄<65岁33例、≥65岁31例;正常体重组男177例、女79例,年龄<65岁161例、≥65岁95例;超重组男85例、女41例,年龄<65岁76例、≥65岁50例。体重过低组有手术并发症10例、围手术期死亡1例,正常体重组分别为40、4例,超重组分别为30、3例。三组血清白蛋白及清扫淋巴结数目差异无统计学意义,三组淋巴结转移分期(N分期)及转移淋巴结数目相比,P均<0.05。胃癌患者术前BMI与术前血清白蛋白水平呈正相关关系(r=0.120,P=0.019),与手术清扫淋巴结数目呈负相关关系(r=-0.168,P=0.001),与转移淋巴结数目呈正相关关系(r=0.163,P=0.001)。详见表1~3。
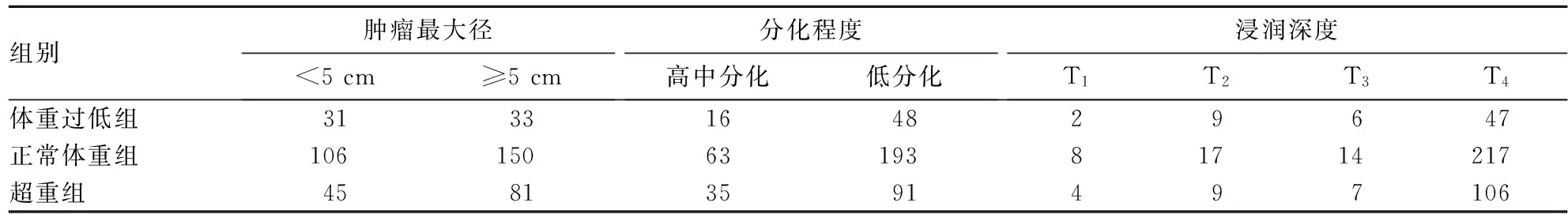
表1 三组肿瘤最大径、病理类型、浸润深度情况比较(例)
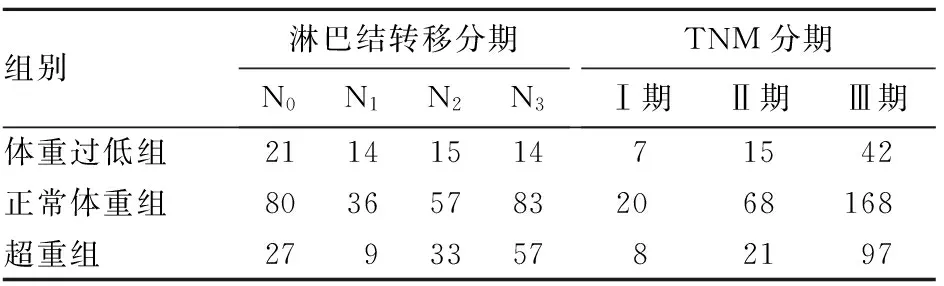
表2 三组淋巴结转移分期、TNM分期情况比较(例)
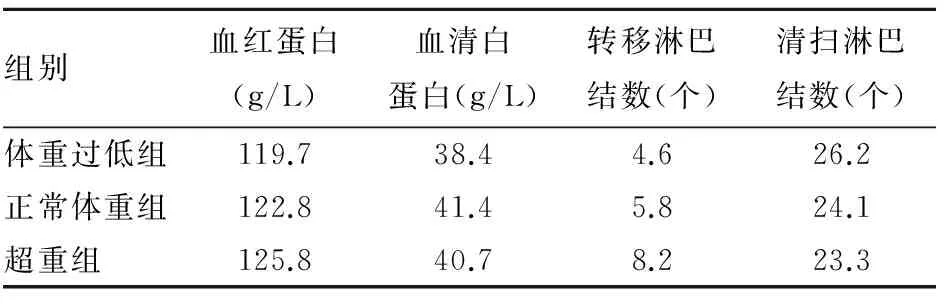
表3 三组血红蛋白、血清白蛋白、转移淋巴结数、清扫淋巴结数比较
2.2三组手术并发症与围手术期死亡情况比较466例患者中80例(17.9%)患者出现术后并发症,其中肺感染及呼吸衰竭24例、出血8例、吻合口瘘8例、腹腔感染4例、切口感染18例、吻合口梗阻6例、肠梗阻6例、淋巴瘘4例、其他2例。体重过低组、正常体重组、超重组发生术后并发症的例数分别为10、40、30例,三组相比,P均>0.05。8例患者出现围手术期死亡,其中体重过低组1例、正常体重组4例、超重组3例,三组相比,P均>0.05。
2.3三组预后比较及预后影响因素分析体重过低组、正常体重组、超重组5年生存率分别为30.6%、43.7%、26.1%,三组相比,P均<0.05。单因素分析结果显示,年龄(χ2=9.024,P=0.003)、BMI(χ2=8.901,P=0.012)、肿瘤最大径(χ2=23.177,P=0.000)、浸润深度(χ2=25.580,P=0.000)、N分期(χ2=117.183,P=0.000)及TNM分期(χ2=65.503,P=0.000)与患者生存相关。多因素分析结果显示,肿瘤最大径(HR=1.475,P=0.004)、N分期(HR=1.717,P=0.000)与TNM分期(HR=1.599,P=0.001)是胃癌的独立预后因素。
3 讨论
我们分析了BMI与临床病理参数之间的关系,发现胃癌患者中术前BMI与术前血红蛋白并无明显关联性,与术前血清白蛋白指标虽然呈正相关关系,但三组之间并无统计学差异。这从侧面提示BMI并不能全面反映胃癌患者的营养状况。三组患者淋巴结清扫总数差异无统计学意义,但淋巴结清扫总数有随BMI上升而减少的趋势(两者呈负相关关系),这可能是由于BMI较大者脂肪组织丰富,导致淋巴结检出比较困难,与国外学者的研究结果相近[7]。我们发现,三组在淋巴结转移数目及N分期差异有统计学意义,淋巴结转移数目随BMI增高而增加,BMI较大者更容易发生淋巴结转移、N分期也更晚。然而,有学者[8]得出相反的观点,认为低BMI者更易发生淋巴结转移,而这种现象的原因是分期越晚的胃癌患者越容易出现体重下降 。上述研究结果差异产生的原因有待于进一步研究。
有研究[9]显示肥胖患者术后腹腔内脓肿形成的几率是普通患者的2~5倍,可能与肥胖患者术后腹腔压力较高导致的吻合口瘘有关。胃癌患者术后卧床时间较长,而肥胖患者体内胆固醇水平较高,胆汁常处于过饱和状态,在胃癌术后经常出现胆囊结石及急性胆囊炎[10]。肥胖患者常合并高血压及糖尿病,这可能也是术后并发症发生率偏高的另一个原因。韩国学者[8]的研究表明体重过低的胃癌患者术后肺呼吸系统并发症发生率增高。本研究结果显示,三组患者术后并发症及围手术期死亡率差异无统计学意义,认为这可能与术者手术经验丰富及围手术期护理良好等其他因素有关[7,11,12]。
胃癌患者术前BMI与预后是否有关,目前仍无定论。我们的数据表明胃癌患者术前BMI与预后有关,本研究三组患者中预后最好的是正常体重组,其次为超低体重组,最差为超重组。体重过低的患者预后差可能与其营养状况不佳、免疫能力下降导致的抗肿瘤能力下降相关;而超重肥胖患者预后差可能与手术难度增加、手术切除范围受限、根治程度不够有关。我们进行多因素生存分析显示肿瘤最大径、N分期及TNM分期是胃癌患者的独立预后因素,而术前BMI并非胃癌患者的独立预后因素,这与国内相关研究结果相似[13]。
综上所述,本研究表明术前BMI与胃癌患者血清白蛋白水平、手术清扫淋巴结数目及转移淋巴结数目有关,与胃癌患者手术并发症无明显关系,但BMI与胃癌患者预后有一定关系。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] 武阳丰.肥胖:必须引起国人重视的流行病[J].中华流行病学杂志,2002,23(1):3-4.
[3] Jabaiti SK. Risk factors for wound complications following abdominoplasty[J]. Am J Appl Sci, 2009,6(5):897-901.
[4] Bickenbach K, Strong VE. Comparisons of gastric cancer treatments: east vs west[J]. Gastric Cancer, 2012,12(2):55-62.
[5] Lianos GD, Bali CD, Glantzounis GK, et al. BMI and lymph node ratio may predict clinical outcomes of gastric cancer[J]. Future Oncology, 2014,10(2):249-255.
[6] Lin YS, Huang KH, Lan YT, et al. Impact of body mass index on postoperative outcome of advanced gastric cancer after curative surgery[J]. J Gastrointest Surg, 2013,17(8):1382-1391.
[7] Voglino C, Di MG, Ferrara F, et al. Clinical and oncological value of preoperative BMI in gastric cancer patients: a single center experience[J]. Gastroent Res Prac, 2015,2015:810134. doi: 10.1155/2015/810134.
[8] Kim JM, Park JH, Jeong SH, et al. Relationship between low body mass index and morbidity after gastrectomy for gastric cancer[J]. Ann Surg Treat Res, 2016,90(4):207-212.
[9] Bickenbach KA, Denton B, Gonen M, et al. Impact of obesity on perioperative complications and long-term survival of patients with gastric cancer[J].Ann Surg Oncol, 2013,20(3):780-787.
[10] Hayashi T, Yoshikawa T, Aoyama T, et al. Impact of infectious complications on gastric cancer recurrence[J]. Gastric Cancer, 2014,14(17):1-7.
[11] Wong J, Rahman S, Saeed N, et al. Effect of body mass indexin patients undergoing resection for gastric cancer: a single center US experience[J]. J Gastrointest Surg, 2014,18(3):505-511.
[12] Kim JH, Chin HM, Hwang SS, et al. Impact of intra-abdominal fat on surgical outcome and overall survival ofpatients with gastric cancer[J]. Int J Surg, 2014,12(4):346-352.
[13] 崔景利,邓靖宇,刘宏根,等.Borrmann Ⅳ型胃癌的临床病理特点及预后分析[J].中华普通外科杂志,2014,29(2):89-92.
天津市卫生和计划生育委员会科技基金项目(2015KZ096)。
沈洪(E-mail: tjshenhong@126.com)
10.3969/j.issn.1002-266X.2016.31.024
R735.2
B
1002-266X(2016)31-0075-03
2016-05-27)
