喉鳞状细胞癌组织中MMP-11、COL11A1 mRNA的表达变化及其意义
2016-10-24陈平钟琦李祖飞陈学军张洋黄志刚
陈平,钟琦,李祖飞,陈学军,张洋,黄志刚
(首都医科大学附属北京同仁医院,北京100730)
喉鳞状细胞癌组织中MMP-11、COL11A1 mRNA的表达变化及其意义
陈平,钟琦,李祖飞,陈学军,张洋,黄志刚
(首都医科大学附属北京同仁医院,北京100730)
目的观察喉鳞状细胞癌(LSCC)组织中基质金属蛋白酶11(MMP-11)及COL11A1基因的表达变化,并探讨其意义。方法 行手术治疗的LSCC患者45例,术中留取LSCC组织及癌旁正常组织,采用real-time PCR检测MMP-11 mRNA及COL11A1 mRNA,分析MMP-11、COL11A1 mRNA与LSCC临床病理参数及患者预后的关系。结果 LSCC组织、癌旁正常组织中MMP-11 mRNA表达上调分别为39、13例,COL11A1 mRNA表达上调分别为45、41例。LSCC组织、癌旁正常组织中MMP-11 mRNA相对表达量分别为2.226±0.143、0.892±0.036,COL11A1 mRNA相对表达量分别为2.842±0.218、1.493±0.063,两种组织相比,P均<0.05。LSCC组织中MMP-11 mRNA与COL11A1 mRNA表达呈正相关关系(r=0.648,P<0.05)。不同年龄、TNM分期患者肿瘤组织中MMP-11 mRNA表达上调情况相比,P均<0.05。不同临床分期、分化程度、淋巴结转移情况的LSCC患者肿瘤组织中COL11A1 mRNA表达上调情况相比,P均<0.05。MMP-11 mRNA表达上调组5年生存率为55.5%,MMP-11 mRNA表达下调组为83.3%,两组相比,P<0.05。COL11A1 mRNA表达上调组5年生存率为53.7%,COL11A1 mRNA表达下调组为80.0%,两组相比,P<0.05。结论 LSCC组织中MMP-11、COL11A1 mRNA表达均上调,二者可能协同参与了LSCC的发生与发展。
喉癌;鳞状细胞;基质金属蛋白酶11基因;COL11A1基因
喉鳞状细胞癌(LSCC)是头颈部常见的恶性肿瘤,标化死亡率约为1.1/10万。局部浸润和远处转移是LSCC患者生存率低的主要原因[1]。许多基因的异常表达与肿瘤的浸润转移有关[2]。肿瘤细胞在侵袭、转移过程中要突破细胞外基质(ECM)这一天然屏障,而基质金属蛋白酶(MMPs)是降解ECM最主要的酶[3]。MMP-11是基质金属蛋白酶家族成员之一,现已发现其在早期乳腺癌[4]、结肠癌[5]、肺癌[6]等多种恶性肿瘤组织中表达。MMP-11能抑制肿瘤细胞凋亡,其作用机制可能与转录因子SP1能够结合到MMP-11近端启动子区域内的GC盒从而上调MMP-11基因的表达有关[7]。最新研究发现,转录因子SP1能够正调节COL11A1基因的近端启动子活动[8]。COL11A1基因编码胶原Ⅺ的α1链,COL11A1基因突变可导致Ⅱ型Stickler综合征[9]、骨关节炎[10]等疾病。胶原Ⅺ通过活化局部粘着斑激酶(FAK)导致E-钙黏蛋白(E-cadherin)黏连复合物解聚,抑制细胞之间黏附,影响组织的完整性从而有利于肿瘤细胞的转移和扩散[11]。但是关于MMP-11及COL11A1与LSCC发生发展的关系目前少有报道。为此,本研究观察了LSCC组织中MMP-11、COL11A1 mRNA的表达变化,探讨两者表达与LSCC临床病理参数的关系,分析二者在LSCC发生发展中的作用,现报告如下。
1 资料与方法
1.1临床资料2009年10月~2013年9月于北京同仁医院耳鼻咽喉头颈外科住院手术的LSCC患者45例。经组织病理检查确诊为鳞状细胞癌,未接受放化疗,无其他肿瘤病史,参与研究前均签署知情同意书。患者均为男性,年龄41~72岁,早期(TNM分期Ⅰ~Ⅱ期)19例、晚期(Ⅲ~Ⅳ期)26例,高分化12例、中分化28例、低分化5例,声门上型24例、声门型19例、声门下型2例,有淋巴结转移18例、无淋巴结转移27例。取患者手术切除的LSCC组织及癌旁正常组织(距离肿瘤组织>1 cm),一部分立即置于液氮中速冻,保存于-80 ℃冰箱中待测。
1.2LSCC组织中MMP-11、COL11A1 mRNA检测用TRIzol通用型RNA快速提取试剂盒提取组织标本中的总RNA,使用M-MLV-转录酶进行反转录,2×Ex TaqMix试剂盒进行扩增。以GAPDH mRNA作为内参,上游引物序列为5′- CACCCTTTCTTGACAAAACCT-3′,下游引物序列为5′-AGTGGGGTGGCTTTTAGGA-3′;MMP-11 mRNA上游引物序列为5′-TGAGTGCCCGCAACCG-3′,下游引物序列为5′-GGCGTCACATCGCTCCATA-3′;COL11A1 mRNA上游引物序列为5′-GGAGCAAAAGGGGATGGG-3′,下游引物序列为5′-TTGGAGGACAAGATTGGTAAAGG-3′。PCR反应条件:95 ℃预变性5 min,95 ℃ 30 s,60 ℃ 30 s,反应40个循环。以2-ΔΔCt表示目的基因相对表达量,>1为表达上调,<1为表达下调。

2 结果
2.1LSCC组织中MMP-11、COL11A1 mRNA表达变化LSCC组织、癌旁正常组织中MMP-11 mRNA表达上调分别为39、13例,COL11A1 mRNA表达上调分别为45、41例。LSCC组织、癌旁正常组织中MMP-11 mRNA相对表达量分别为2.226±0.143、0.892±0.036,COL11A1 mRNA相对表达量分别为2.842±0.218、1.493±0.063,两种组织相比,P均<0.05。LSCC组织中MMP-11 mRNA与COL11A1 mRNA表达呈正相关关系(r=0.648,P<0.05)。
2.2MMP-11、COL11A1 mRNA表达与LSCC临床病理参数的关系不同年龄、TNM分期患者肿瘤组织中MMP-11 mRNA表达上调情况相比,P均<0.05。不同临床分期、分化程度、淋巴结转移情况的LSCC患者肿瘤组织中COL11A1 mRNA表达上调情况相比,P均<0.05。
2.3MMP-11、COL11A1 mRNA表达与LSCC患者预后的关系随访截至2016年3月,45例患者均无失访,死亡16例。至随访结束时,MMP-11 mRNA表达上调组有15例死亡、生存时间为(33.6±2.3)个月,而MMP-11 mRNA表达下调组仅有1例死亡、生存时间为(60.6±3.7)个月。COL11A1表达上调组有15例死亡、生存时间为(33.5±2.4)个月,而COL11A1表达下调组仅有1例死亡、生存时间为(58.1±3.7)个月。MMP-11 mRNA表达上调组5年生存率为55.5%,MMP-11 mRNA表达下调组为83.3%,两组相比,P<0.05。COL11A1 mRNA表达上调组5年生存率为53.7%,COL11A1 mRNA表达下调组为80.0%,两组相比,P<0.05。
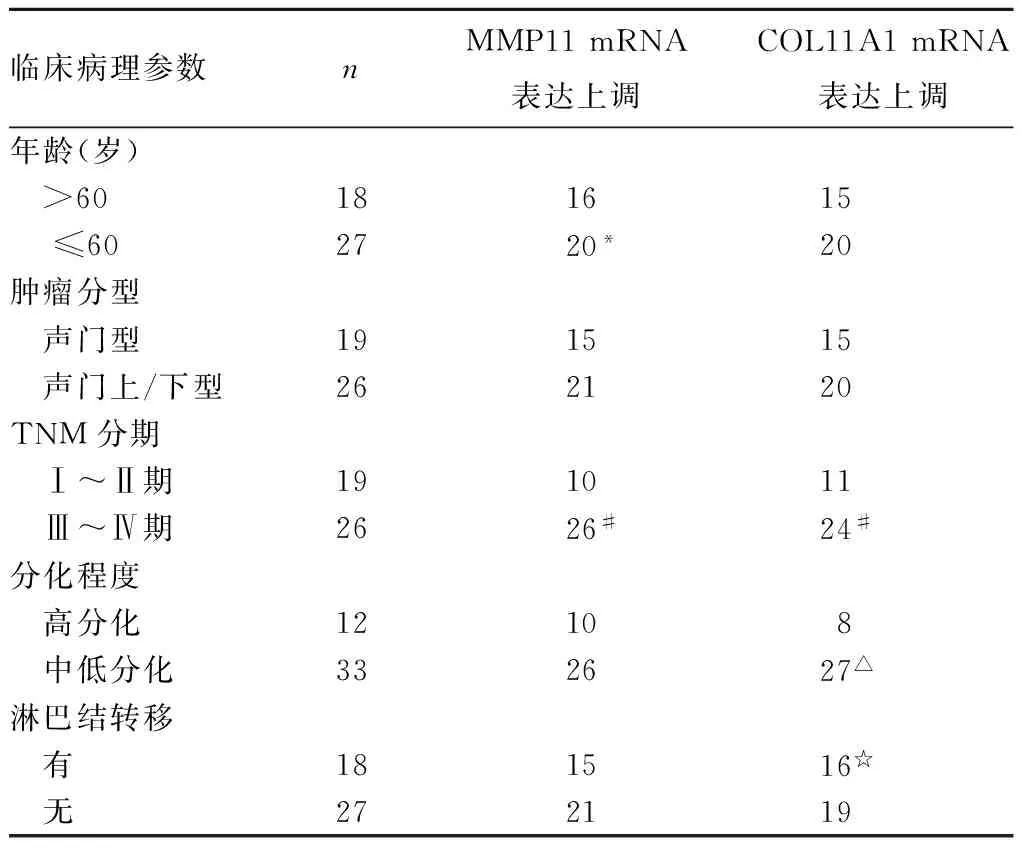
表1 MMP-11、COL11A1 mRNA表达与LSCC临床病理参素的关系(例)
注:与年龄>60岁者相比,*P<0.05;与Ⅰ~Ⅱ期者相比,#P<0.05;与高分化者相比,△P<0.05;与有淋巴结转移者相比,☆P<0.05。
3 讨论
在呼吸道肿瘤中,LSCC的发病率仅次于肺癌,并且容易发生局部浸润和转移[1]。恶性肿瘤的浸润、转移可分为几个步骤:细胞黏附性改变、基底膜及细胞外基质降解、新生血管形成及肿瘤细胞运动。
MMP-11是肿瘤细胞主动配体,在肿瘤侵袭、进展中发挥重要作用[12,13]。相关研究发现MMP-11在肺癌、乳腺癌和结肠癌等恶性肿瘤中表达上调[4~6]。在头颈肿瘤中也发现MMP-11过表达,但对于MMP-11与头颈肿瘤临床病理参数的关系尚无定论[14]。本研究结果显示,MMP-11 mRNA在LSCC组织中呈过表达状态,此外,随患者年龄、肿瘤分期增加,MMP-11表达逐渐增高,说明MMP-11的异常表达可能与LSCC的发展有关。
胶原Ⅺ是较小的纤维状胶原,最常见于软骨中,是一个由定位于不同的染色体上α1、α2、α3链组成的异源三聚体,胶原Ⅺ合成为原胶原并且蛋白水解产生成熟的三聚体[8]。COL11A1基因位于染色体1p21区域,编码Ⅺ型胶原α1亚基,而Ⅺ型胶原遍布体内各种器官和组织,是细胞外基质中的框架结构[15]。COL11A1基因编码的胶原Ⅺ的α1链基因突变与许多肌肉骨骼疾病有关,如Stickler综合征[9]、骨关节炎[10]等。COL11A1基因在头颈肿瘤组织中也有过表达的相关报道,但作用机制仍有待研究[16]。因此,有学者[17]推测COL11A1基因过表达在肿瘤的形成和进展中都起重要作用。本研究结果显示,COL11A1 mRNA在LSCC组织中呈现过表达状态,并与LSCC临床分期、分化程度和淋巴结转移有关,提示COL11A1 mRNA基因过表达可能是肿瘤早期侵袭的标志[18]。
本研究还发现,MMP-11 mRNA与COL11A1 mRNA在LSCC组织中的表达呈正相关关系,推测MMP-11、COL11A1的作用机制与共同受Sp1的调控有关。生存分析结果显示,MMP-11 mRNA表达上调组、COL11A1 mRNA表达上调组患者的生存率均低于表达下调组,提示MMP-11与COL11A1基因高表达可能与LSCC的不良预后有关。Sp1在上皮细胞G1期中的转录因子,可调控细胞的增殖和分化过程[10]。MMP-11上游-25 bp和-68 bp处存在GC-盒(GCBox),而转录因子Sp1通过GCbox正调控肿瘤组织中MMP-11的表达[10];同时,虽然COL11A1基因上游缺少GCBox,但Sp1可与九核蛋白结合区域相结合从而增强COL11A1基因的转录[8]。
结合上述研究结果,我们认为,MMP-11 mRNA、COL11A1 mRNA在LSCC组织中呈过表达状态,二者可能协同参与了LSCC的发病和进展。然而,本研究纳入病例数较少,且均为男性患者,上述结论仍需进一步验证。
[1] Haddad RI, Shin DM. Recent advances in head and neck cancer[J]. N Engl J Med, 2008,359(11):1143-1154.
[2] Arantes LM, De Carvalho AC, Melendez ME, et al. Methylation as a biomarker for head and neck cancer[J]. Oral Oncol, 2014,50(6):587-592.
[3] Singh D, Srivastava SK, Chaudhuri TK, et al. Multifaceted role of matrix metalloproteinases (MMPs)[J]. Front Mol Biosci, 2014,2:19.
[4] Ren F, Tang R, Zhang X, et al. Overexpression of MMP family members functions as prognostic biomarker for breast cancer patients: a sstematic review and meta-analysis[J]. PLoS One, 2015,10(8):e0135544.
[5] Cini C, Wolthuis A, D′Hoore A. Peritoneal fluid cytokines and matrix-metalloproteinases as early markers of anastomotic leakage in colorectal anastomosis. A literature review and meta-analysis[J]. Colorectal Dis, 2013, 15(9):1070-1077.
[6] Hadler-Olsen E, Winberg JO, Uhlin-Hansen L. Matrix metalloproteinases in cancer: their value as diagnostic and prognostic markers and therapeutic targets[J]. Tumour Biol, 2013,34(4):2041-2051.
[7] Barrasa JI, Olmo N, Santiago-Gómez A, et al. Histone deacetylase inhibitors upregulate MMP11 gene expression through Sp1/Smad complexes in human colon adenocarcinoma cells[J]. Biochim Biophys Acta, 2012,1823(2):570-581.
[8] Watanabe K, Hida M, Sasaki T, et al. Sp1 upregulates the proximal promoter activity of the mouse collagen alpha1(XI) gene(Col11a1) in chondrocytes[J]. In Vitro Cell Dev Biol Anim, 2015,52(2):235-242.
[9] Richards AJ, Fincham GS, Mcninch A, et al. Original article: Alternative splicing modifies the effect of mutations in COL11A1 and results in recessive type 2 Stickler syndrome with profound hearing loss[J]. J Med Genet, 2013,50(11):765-771.
[10] Rodriguez-Fontenla C, Calaza M, Evangelou E, et al. Assessment of Osteoarthritis Candidate Genes in a Meta-Analysis of Nine Genome-Wide Association Studies[J]. Arthrit Rheumatol, 2014,66(4):940-949.
[11] Yoshioka H, Iyama K, Inoguchi K, et al. Developmental pattern of expression of the mouse alpha 1 (XI) collagen gene (Col11a1)[J]. Dev Dyn, 1995,204(1):41-47.
[12] Curran S, Murray GI. Matrix metalloproteinases: molecular aspects of their role in tumour invasion and metastasis[J]. Eur J Cancer, 2000,36(13):1621-1630.
[13] Boulay A, Masson R, Chenard MP, et al. High cancer cell death in syngeneic tumors developed in host mice deficient for the stromelysin-3 matrix metalloproteinase[J]. Cancer Res, 2001,61(5):2189-2193.
[14] Birkedal-Hansen B, Pavelic ZP, Gluckman JL, et al. Oral and Maxillofacial Pathology: MMP and TIMP gene expression in head and neck squamous cell carcinomas and adjacent tissues[J]. Oral Dis, 2000,6(6):376-382.
[15] Yoshioka H, Greenwel P, Inoguchi K. Structural and functional analysis of the promoter of the human alpha 1(XI)collagen gene[J]. J Biol Chem, 1995,270(1):418-424.
[16] Sok JC, Lee JA, Dasari S, et al. Collagen type XI α1 facilitates head and neck squamous cell cancer growth and invasion[J]. British J Cancer, 2013,109(12):3049-3056.
[17] Raglow Z, Thomas SM. Tumor matrix protein collagen XIα1 in cancer[J]. Cancer Lett, 2015,357(2):448-453.
[18] Anastassiou D, Rumjantseva V, Cheng W, et al. Human cancer cells express Slug-based epithelial-mesenchymal transition gene expression signature obtained in vivo[J]. BMC Cancer, 2010,11(11):529.
北京市医管局临床医学发展专项扬帆计划(XMLX201507);北京市教委科技发展计划(KZ201310025025)。
黄志刚(E-mail: enthzg@trhos.com)
10.3969/j.issn.1002-266X.2016.31.023
R76
B
1002-266X(2016)31-0072-03
2016-04-18)
