结肠原发性透明细胞腺癌的病理诊断(附1例报告)
2016-10-24寇玉玲熊小明孙兴旺郭庆喜李霞斌卢子剑
寇玉玲,熊小明,孙兴旺,郭庆喜,李霞斌,卢子剑
(西南医科大学附属医院,四川泸州646000)
结肠原发性透明细胞腺癌的病理诊断(附1例报告)
寇玉玲,熊小明,孙兴旺,郭庆喜,李霞斌,卢子剑
(西南医科大学附属医院,四川泸州646000)
目的分析结肠原发性透明细胞腺癌(CCA)的病理特点,总结结肠原发性CCA的病理诊断要点。方法 患者女性,84岁,临床表现为反复腹痛、腹胀、呕吐、肛门停止排气和排便。PET/CT检查提示升结肠肿瘤。行右半结肠根治性切除术,术中留取肿瘤组织标本,HE染色后进行大体观察,采用免疫组化染色进行免疫表型分析,行特殊染色观察AB、PAS表达情况。结果 肿瘤标本HE染色镜下见肿瘤细胞排列呈腺管状,部分呈锯齿状或相互融合呈筛状,部分瘤巢中央可见坏死。肿瘤细胞呈高柱状或圆形、多边形,胞界清楚,胞质丰富呈透明或空泡状,胞核圆形或卵圆形、核增大、泡状或深染。免疫表型:CK20、CEA、CDX2阳性,CK7、CD10、RCC、TTF-1阴性,Ki-67阳性指数50%、p53阳性指数95%、Nm23阳性指数10%。特殊染色AB、PAS均为阴性。本例未发现K-ras基因突变。病理诊断为结肠原发性CCA。结论结肠原发性CCA在HE染色镜下有特征性表现,肿瘤组织表达CK20、CDX2,不表达CK7,免疫组化染色及特殊染色有助于与经典型结肠癌及CCA结肠转移灶进行鉴别。
结肠肿瘤;透明细胞腺癌;苏木精-伊红染色;免疫组织化学染色
透明细胞腺癌(CCA)常原发于肾脏、卵巢、肺、子宫内膜及其异位组织,原发于结直肠者非常罕见。原发性结肠CCA是一种罕见的结直肠腺癌亚型,第4版WHO消化系统肿瘤分类将结直肠CCA归入传统结直肠癌其他类型的罕见异源性亚型。搜索国内外文献,自第1例原发于结直肠的CCA于1964年被报道以来,迄今仅有18例被报道,且主要发生于左半结肠及直肠。我们发现1例原发于升结肠的CCA,现分析CCA的病理特点,总结该病的病理诊断要点。
1 资料与方法
患者女,84岁,2015年5月12日因“胆结石术后2个月,反复腹痛、腹胀、呕吐、肛门停止排气排便1个月余”入院。查体:全腹软,下腹轻压痛,无反跳痛,叩诊呈鼓音,肝肾区无叩痛。测肿瘤标志物CEA 27.76 ng/mL。腹部X线平片检查示左中下腹局部肠淤张,右中下腹及左中下腹多个短浅液气平影。腹部CT检查示腹腔内小肠肠管扩张,并见少许液气平,考虑肠淤张可能性大。躯干PET/CT检查结果示升结肠上段局部肠壁不均匀增厚伴远端结肠肿胀、积液,糖代谢增高,考虑结肠癌可能性大(图1)。临床诊断:升结肠肿瘤伴梗阻。遂行右半结肠根治性切除术,术中留取肿瘤组织标本。术后患者一般情况好,生命体征平稳,病情好转后出院。术后13个月,随访期间患者一般情况好,无复发。
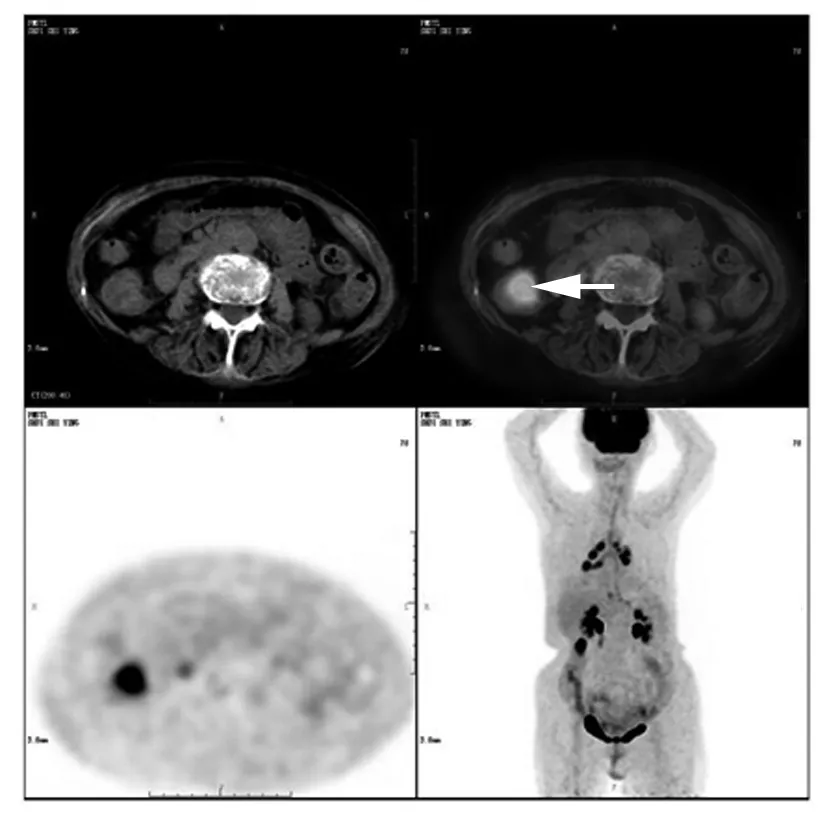
注:箭所指为局部肠壁不均匀增厚区。
图1结肠CCA患者躯干PET/CT检查结果
将所留肿瘤组织标本沿肠管纵轴打开,置于4%甲醛中固定24 h后取材,沿垂直于黏膜皱襞的方向每隔0.5 cm切取肿瘤完整切面,包括肿瘤表面至浸润最深处,分别作标记后置于不同的包埋盒内。常规脱水,石蜡包埋及制片,行HE染色、免疫组化染色(EnVision两步法,一抗包括CK7、CK20、CEA、CDX2、Ki-67、p53、Nm23、CD10、RCC、TTF-1)、特殊染色(AB、PAS)。提取肿瘤标本组织的DNA,经过纯化行real-time PCR检测K-ras基因Gly12Asp、Gly12Ala、Gly12Val、Gly12Ser、Gly12Arg、Gly12Cys、Gly13Asp位点突变。
2 结果
术中留取的肿瘤标本距结肠端切缘4.5 cm处见一个3.5 cm×2.5 cm×1.0 cm的肿块,侵及全层,累及全周,距肿块5.5 cm处可见直径为1.0 cm的息肉样物,其余肠黏膜未见肿块及溃疡。回肠旁清扫淋巴结9枚,直径0.2~1.0 cm;结肠旁清扫淋巴结15枚,直径0.4~0.9 cm。
镜检见肿瘤绝大部分由CCA组成,可见少量经典管状腺癌,部分区域可见两者相互移行。CCA细胞排列呈腺管状,部分呈锯齿状或相互融合呈筛状结构,部分瘤巢中央可见凝固性坏死,小灶区域肿瘤细胞失去黏附、单个或小巢团散在分布。肿瘤细胞呈高柱状或圆形、多边形,其胞界清楚,胞质丰富、呈透明或空泡状,细胞核圆形或卵圆形、核增大、泡状或深染,部分可见较小核仁;柱状细胞的胞核多位于细胞中下部、部分位于上部,可见核上空泡,类似分泌期子宫内膜;单个或小巢团状细胞的胞核偏于一侧,似印戒细胞。肿瘤呈浸润性生长,瘤巢间为纤维间隔,瘤巢周围见少量以淋巴细胞为主的炎症细胞浸润,肿瘤侵及外膜脂肪组织,未见脉管、神经侵犯,未见肠旁淋巴结转移。
肿瘤组织免疫表型:CK20阳性、CDX2阳性、CEA阳性、Ki-67阳性指数50%、p53阳性指数95%、Nm23阳性指数10%、CK7、CD10、RCC、TTF-1阴性。特殊染色:PAS、AB阴性。病理诊断为原发性右半结肠CCA,肿瘤病理分期pT3N0M0。距结肠切缘10.0cm处管状腺瘤。7个K-ras基因热点突变位点均未测得突变。
3 讨论
CCA常原发于肾脏、卵巢、肺、子宫内膜及其异位组织,原发于结直肠者非常罕见,其发病率及病死率均无明确报道。仅Domoto等[1]于1999年在3 486例结直肠腺瘤病例中查见3例(0.086%)管状腺瘤有透明细胞样改变。目前文献报道的原发于结直肠的CCA仅有18例,本例为第19例。我们总结这19例病例得出原发性结直肠CCA发病年龄为26~89岁,常发生于中老年男性,好发于左半结肠,偶发于右半结肠,肿瘤呈息肉状、溃疡型或隆起型,易发生淋巴结、肝、肺转移[2~16]。
多数结直肠CCA临床表现无特异性,如腹痛、腹胀、黑便、停止排气排便、便秘和腹泻交替等。腹部X线片、CT检查、钡餐检查发现肠道占位病变,但无诊断特异性。目前肠镜及病理活检是诊断CCA的主要手段。但结直肠原发性CCA很少在术前得到确诊,多依靠术后病理检查。总结所有病例资料,肿瘤组织HE镜下表现有以下特点:肿瘤大部分由长柱状或多边形的透明细胞组成,胞质丰富,透明或空泡状,细胞核多位于基底部,胞核卵圆形或多角形、泡状,部分可见较明显的核仁;瘤细胞呈腺管状排列或相互融合呈筛状结构,部分瘤巢中央可见坏死;同时可见少量管状腺癌成分。然而,上述镜下特点与经典型结肠腺癌及其他器官的CCA结肠转移病灶在形态上有相似之处,难以鉴别。本例HE镜下见肿瘤绝大部分由CCA组成,见少量经典管状腺癌,部分区域可见两者相互移行;肿瘤细胞排列呈腺管状,部分呈锯齿状或相互融合呈筛状结构,部分瘤巢中央可见凝固性坏死,胞质丰富、透明或空泡状;柱状细胞者胞核多位于中下部、部分位于上部,可见核上空泡,类似分泌期子宫内膜;单个或小巢团状者细胞核偏于一侧,似印戒细胞。据上述特点可初步诊断为CCA,但不能明确其为原发性还是转移性肿瘤,因此还需要与转移性CCA进行鉴别。
结肠印戒细胞癌及经典型腺癌与CCA的免疫表型相同:CK20阳性、CK7阴性。但印戒细胞癌的肿瘤细胞内含有黏液,经典型腺癌肿瘤细胞的胞质无透明样改变,且这两类肿瘤AB、PAS染色均呈阳性。本例肿瘤成分以CCA为主,含少量经典型腺癌成分,CCA成分缺乏黏液,虽出现单个或小巢团状肿瘤细胞且细胞核偏于一侧、似印戒细胞,但AB、PAS均阴性,故借此可与印戒细胞癌及经典型腺癌相鉴别。转移性肾CCA常无真正的腺管结构形成,多呈实性片状排列,并具有丰富的毛细血管间质,免疫组化标记RCC、CD10阳性,CK20阴性[15~17]。本例CK20、CDX2阳性,RCC、CD10阴性,肿瘤细胞呈腺管样排列,故易于鉴别。转移性卵巢及子宫内膜CCACK7阳性,CK20阴性,且据文献[18]报道子宫内膜异位引起的转移性结直肠CCA有以下三点特征:a.肿瘤细胞附近应有异位子宫内膜的组织学证据;b.应确定没有其他原发部位的恶性肿瘤;c.肿瘤的组织学外观应符合子宫内膜异位起源。本例患者HE镜下见柱状细胞核多位于中下部,部分位于上部,可见核上空泡,类似分泌期子宫内膜;但影像学检查未发现生殖系统异常,且CK20、CDX2阳性,CK7阴性,因此可鉴别。转移性肺CCA CK7、TTF-1阳性,CK20阴性,而本例患者CK20、CDX2阳性,CK7、TTF-1阴性,故可鉴别。
通过总结文献及本例案例,我们总结结肠原发性CCA的病理诊断依据如下:①体积小的肿瘤大体观察常为息肉样,表现为癌细胞位于息肉顶端,呈现出息肉和癌并存的情况[3,8,9,19,20]。②多数患者出现肿瘤位于息肉旁或息肉旁出现肿瘤[3,5,8,10,15,20]。③HE染色可见肿瘤由胞界清楚、胞质丰富的透明细胞组成,肿瘤细胞呈长柱状或多边形,胞质丰富、呈透明或空泡状,胞核多位于基底部,胞核卵圆形或多角形、泡状,部分可见较明显的核仁;瘤细胞呈腺管状排列或相互融合呈筛状结构,部分瘤巢中央可见坏死。④肿瘤组织CK20、CDX2阳性,CK7阴性。其中“①”和“②”不是必要条件,但“③”和“④”是诊断的必要条件且“③”为“④”的前提。同时结合患者临床病史、影像资料,即可确诊为结肠原发性CCA。有学者[10]报道,结肠原发性CCA可能因糖原颗粒的积累而引起细胞内空泡形成,故PAS阳性、AB阴性。但本例患者PAS、AB均为阴性,推测原因可能与常规石蜡切片在甲醛溶液固定过程中或脱水、染色过程中使糖原洗脱有关,或与透明细胞的异质性、肿瘤潜能的多样性有关。
已知结肠癌的发生和发展是受多基因、多步骤调控的复杂过程,大多遵循“正常肠上皮-腺瘤-结肠癌-转移”的模式[19],本例患者肿瘤位于腺瘤旁,遵循结直肠癌的发生发展模式。K-ras基因是人体常见的致癌基因,其突变常见于多种恶性肿瘤,在结直肠癌患者中的突变率为20%~50%。K-ras突变主要位于第12和13密码子上。K-ras基因突变可使结直肠癌细胞对EGFR抗体类药物产生耐药。既往报道的18例结直肠CCA患者中有2例测出K-ras基因突变[10,14],本例未查见K-ras基因突变。p53基因是与肿瘤相关性最强的一种抑癌基因,突变型p53高表达者说明预后不良;Ki-67主要反映细胞增殖的活性,Nm23基因是一种转移抑制基因,两者均为恶性肿瘤的预后重要参考指标。我们总结19例结直肠癌CCA患者的资料,发现其中5例Ki-67高表达[9,10,13,20],5例p53阳性[9,10,14,20],本例Nm23低表达,故我们认为该例患者可能预后不良且易发生转移。但本例随访时间仅13个月,仍需进一步观察。
结直肠原发性CCA目前主要采取部分肠切除或内镜下息肉切除术治疗。对肿瘤体积小、呈息肉状且无转移者多行内镜下息肉切除术[3,8,9,20],既往报道4例患者采用该方案治疗,其中2例获得随访者无复发。我们收集其余患者资料,10例获得随访,其中1例行放疗治疗,2例行化疗治疗,均无复发;5例术后未做放化疗者于术后7个月~3年内死亡。本例患者采用外科手术切除,术后病理检查提示肿瘤侵及外膜层,阑尾、网膜未受累及,脉管、神经未侵犯,未发现淋巴结转移,肿瘤病理分期pT3N0M0,术后随访13个月,无复发。
综上所述,结肠原发性CCA可能是结肠腺癌的特殊形态亚型,而非真正意义上的实体亚型。CCA组织表达CK20、CEA、CDX2,而不表达CK7,与经典型腺癌无差别,鉴别主要依靠镜下表现及特殊染色。关于结直肠CCA的临床表现、治疗手段、预后情况还有待更多病例及资料的积累和分析。
[1] Domoto H, Terahata S, Senoh A, et al. Clear cell change in colorectal adenomas: its incidence and histological characteristics[J]. Histopathology, 1999,34(3):250-256.
[2] Hellstrom HR, Fisher ER. Physaliferous variant of carcinoma of colon[J]. Cancer, 1964,17:259-263.
[3] Jewell LD, Barr JR, McCaughey WT, et al. Clear cell epithelial neoplasms of the large intestine[J]. Arch Pathol Lab Med, 1988,112(2):197-199.
[4] Rubio CA. Clear cell adenocarcinoma of the colon[J]. J Clin Pathol, 1995,48(12):1142-1144.
[5] Braumann C, Schwabe M, Ordemann J, et al. The clear cell adenocarcinoma of the colon: case report and review of the literature[J]. Int J Colorectal Dis, 2004,19(3):264-267.
[6] Mallik AA, Katchy KC. Clear cell adenocarcinoma of the rectum[J]. Med Princ Pract, 2005,14(1):58-60.
[7] Hao LS, Zhu X, Zhao LH,et al. Clear cell adenocarcinoma of colorectum: a case report and review of the literature[J]. Acta Gastroenterol Belg, 2007,70(2):235-238.
[8] Ko YT, Baik SH, Kim SH, et al. Clear cell adenocarcinoma of the sigmoid colon[J]. Int J Colorectal Dis, 2007,22(12):1543-1544.
[9] Soga K, Konishi H, Tatsumi N, et al. Clear cell adenocarcinoma of the colon: a case report and review of literature [J]. World J Gastroenterol, 2008,14(7):1137-1140.
[10] Barisella M, Lampis A, Perrone F, et al. Clear cell adenocarcinoma of the colon is a unique morphological variant of intestinal carcinoma: Case report with molecular analysis[J]. World J Gastroenterol, 2008,14(42):6575-6577.
[11] Gasljevic G, Lamovec J. Primary clear cell adenocarcinoma of the rectum:a case report[J]. Int J Colorectal Dis, 2010,25(10):1259-1260.
[12] Furuya Y, Wakahara T, Akimoto H, et al. Clear cell adenocarcinoma with enteroblastic differentiation of the ascending colon[J]. J Clin Oncol, 2011,29(22):e647-649.
[13] Kanstrup Fiehn AM, Andersson S, Grupe Larsen L. Primary clear cell adenocarcinoma of the colon[J]. Ugeskr Laeger, 2012,174(39):2307-2308.
[14] Gurzu S, Jung I, Bara T, et al. Immunohistochemical and molecular features of primary clear cell-adenocarcinoma of the rectum, as predictive factors for individualized therapy[J]. Rom J Morphol Embryol, 2014,55(2 Suppl): 629-633.
[15] 王云帆,赵晓丽,王淑芳,等.原发性结肠透明细胞腺癌1例并文献复习[J].临床与实验病理学杂志,2014,30(2):185-188,192.
[16] Barrera-Maldonado CD, Wiener I, Sim S. Clear Cell Adenocarcinoma of the Colon: A Case Report and Review of the Literature [J]. Case Rep Oncol Med,2014.http://dx.doi.org/10.1155/2014/905478.
[17] Wang W, Li X, Qu G,et al. Primary clear cell adenocarcinoma of the colon presenting as a huge extracolic mass: A case report [J]. Oncol Lett, 2014,8(4):1873-1875.
[18] Okazawa Y, Takahashi R, Mizukoshi K, et al. A case of clear cell adenocarcinoma arising from endometriosis of therectum treated by laparoscopic surgery[J]. Int J Surg Case Rep, 2014,5(12):979-983.
[19] Fearon ER, Vogelstein B. A genetic model for colorectal tumorigenesis[J]. Cell, 1990,61(5):759-767.
[20] 陈岚,肖飞,孙铭均,等.结直肠透明细胞癌的临床病理观察及分子生物学特点[J].诊断病理学杂志,2015,22(4):212-216+232.
Pathological diagnosis of primary clear cell adenocarcinoma of the colon (a report of 1 cases)
KOUYuling,XIONGXiaoming,SUNXingwang,GUOQingxi,LUZijian,LIXiabin
(AffiliatedHospitalofSouthwestMedicalUniversityDepartmentofPathology,Luzhou646000,China)
ObjectiveTo analyze the pathological characteristics and to summarize the pathologic diagnosis of primary clear cell adenocarcinoma (CCA) of the colon. Methods A 84-year-old female patient presented with abdominal pain, abdominal distension, vomiting and ileus. PET/CT examination revealed that the tumor was in the ascending colon. Right hemicolectomy was performed and the tumor sample was collected. Pathological examination, immunohistochemical staining and special staining were performed to observe the expression of AB and PAS in the tumor tissues. ResultsThe microscopic examination showed tumor cells were arranged in the gland, partly with a serrated or mutual, and the central necrosis between the cancer nests was observed. The tumor cells were round or polygonal and columnar cells, and the cells had well defined borders, with abundant clear and vesicular cytoplasm, nuclei were round to oval shape, enlarged and hyperchromatic. Immunophenotyping: the CCA showed positive staining for CK20, CEA, CDX-2, Ki-67 (50%), p53 (95%), Nm23 (10%), but negative for CK7, CD10, RCC and TTF-1. Histochemical staining showed PAS and AB were both negative. The K-ras gene mutation was not found in this case. The primary CCA of the colon was diagnosed. ConclusionPrimary colon CCA showed characteristic manifestation under HE staining, tumor tissue showed positive staining for CK20 and CDX2, but negative for CK7, immunohistochemical staining and special staining help to identify the classic type of colon carcinoma and the colon metastases of CAA.
colon carcinoma;clear cell adenocarcinoma; hematoxylin and eosin staining; immunhistochemistry
寇玉玲(1989-),女,研究生在读,主要研究方向为分子病理。E-mail: 156684198@qq.com
简介:孙兴旺(1965-),男,教授,主要研究方向为分子病理。E-mail: lysunxw@163.com
10.3969/j.issn.1002-266X.2016.31.002
R735.3
A
1002-266X(2016)31-0004-04
2016-04-28)
