IL-10单核苷酸多态性与颅内动脉瘤破裂的关系
2016-10-24邵得明于向东邱虹王玉珏陈广杨国科
邵得明,于向东,邱虹,王玉珏 ,陈广,杨国科
(1迁安市人民医院,河北迁安 064400;2开滦总医院)
IL-10单核苷酸多态性与颅内动脉瘤破裂的关系
邵得明1,于向东2,邱虹2,王玉珏2,陈广2,杨国科1
(1迁安市人民医院,河北迁安 064400;2开滦总医院)
目的分析IL-10基因启动子区-819 C/T和-592 C/A单核苷酸多态性(SNP)与颅内动脉瘤(IAs)破裂的关系。方法 267例IAs患者根据IAs是否破裂分为破裂组与未破裂组,用PCR法检测IL-10基因启动子区两个SNP位点,-819 C/T和-592 C/A的基因型和等位基因频率。结果破裂组IL-10基因启动子区-819 C/T位点CC、CT+TT基因型分别为51、113例,C、T等位基因分别为132、196频次;未破裂组分别为17、86例,56、150频次;两组比较,P均<0.01。破裂组IL-10基因启动子区-592C/A位点的CC基因型、CA+AA基因型分别为66、98例,C、A等位基因频率分别为154、174频次;未破裂组分别为23、80例,76、130频次;两组比较,P均<0.01。-819位点CT+TT基因型及-592位点CA+AA基因型IAs患者更易出现破裂(OR分别为2.283、2343,95%CI分别为1.233~4.229、1.339~40.97)。结论 IL-10 SNP可能与IAs的破裂相关。-819C/T野生型纯合子CT+TT基因型及-592C/A野生型纯合子CA+AA基因型患者IAs破裂的风险更高。
颅内动脉瘤;白细胞介素10;多态性,单核苷酸;聚合酶链反应
颅内动脉瘤(IAs)是严重危害人类健康的脑血管疾病,首次破裂致蛛网膜下腔出血(SAH)后致残率和致死率均可高达1/3[1]。IAs是由多种环境因素和多个基因共同作用而引发的多基因疾病。关于IAs发病及破裂机制的遗传学研究越来越成为热点。IL-10主要由Th2细胞产生,具有抗炎和免疫抑制双重作用。本研究探讨了IL-10 SNP与IAs破裂的关系。现报告如下。
1 资料与方法
1.1临床资料选择2011年3月~2015年2月在唐山市开滦总医院和河北省迁安市人民医院神经外科住院治疗的IAs患者267例,均通过全脑数字减影血管造影或手术确诊,排除合并动静脉畸形、Moyamoya病、创伤性及真菌性动脉瘤,患者均为唐山地区汉族人,无卒中病史;无动脉瘤家族史及SAH家族史;彼此无亲缘关系。按IAs是否破裂分为破裂组和未破裂组,其中破裂组164例,男78例、女86例,年龄20~79(53.5±11.4)岁,吸烟者31例、糖尿病24例、高血压97例;未破裂组103例,男50例、女53例,年龄24~82(52.4±11.8)岁。吸烟者22例、糖尿病18例、高血压65例。瘤体部位分别位于眼动脉、基底动脉、后交通动脉、前交通动脉、颈内动脉、大脑前动脉、大脑中动脉、大脑后动脉等。破裂引起的SAH经头颅CT或腰椎穿刺证实,破裂组均为初发SAH。两组基线资料有可比性。
1.2IL-10 SNP的检测采用PCR法。扩增目的片段:采集研究对象静脉血2 mL,收集于乙二胺四乙酸二钠盐抗凝管中,-20 ℃冰箱中冻存待检。采用传统酚-氯仿抽提乙醇沉淀法提取白细胞中DNA并作为PCR模板。-819C/T扩增:上游引物序列:5′-GGCACTGGTGTACCCTTGTA-3′;下游引物序列:5′-CATGACCCCTACCGTCTCTATTTT-3′。反应条件:①预变性95 ℃,5 min;②变性94 ℃,40 s;③退火63 ℃,30 s;④延伸72 ℃,1 min;②~④共进行40个循环;⑤延伸72 ℃,5 min。-592C/A扩增:上游引物序列:5′-GGTAAAGGAGCCTGGAACACATC-3′;下游引物序列:5′-GCCCTTCCATTTTACTTTCCAGAGA-3′。反应条件:①预变性95 ℃,5 min;②变性94 ℃,40 s;③退火61.8 ℃,30 s;④延伸72 ℃,1 min;②~④共进行40个循环;⑤延伸72 ℃,5 min。PCR产物检测:采用琼脂糖凝胶电泳检测特异性扩增的目的条带,样本纯化后由国家人类基因组北方研究中心上机测序,按ABI 3730XL标准操作程序进行。
1.3统计学方法采用SPSS19.0统计软件。计数资料比较采用χ2检验。计算不同基因型IAs患者发生破裂的OR值及其95%CI。P<0.05表示差异有统计学意义。
2 结果
2.1IL-10 SNP标本均成功扩增出目的片段,-819C/T位点经PCR扩增得到402 bp片段,电泳结果显示扩增出的条带单一,特异性良好。产物经测序发现,3种基因型:野生纯合子CC基因型、杂合子CT基因型、突变纯合子TT基因型。-592C/A扩增得到412 bp的片段,电泳结果显示扩增出的条带单一,特异性良好。PCR产物经测序发现3种基因型:野生纯合子CC基因型、杂合子CA基因型、突变纯合子AA基因型。
2.2IL-10启动子区-819C/T和-592C/A位点不同多态性分布的IAs患者发生破裂的风险见表1、2。以-819C/T野生型纯合子CC基因型为对照,分析各基因型IAs患者发生破裂的风险,结果发现CT+TT基因型增加了IAs发生破裂的风险性(OR=2.283,95%CI1.233~4.229);以-592C/A野生型纯合子CC基因型为对照,发现CA+AA基因型IAs患者发生破裂的风险更高(OR=2.343,95%CI1.339~4.097);破裂组与未破裂组相比,-819位点T等位基因(OR=1.804,95%CI1.236~2.633)、-592位点A等位基因频率更高(OR=1.514,95%CI1.060~2.162)。
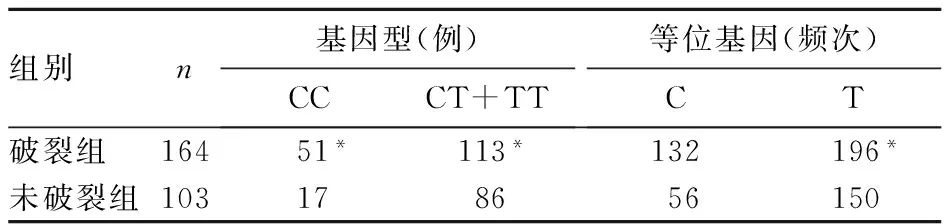
表1 两组IL-10 -819C/T位点多态性分布
注:与未破裂组比较,*P<0.01。

表2 两组IL-10-592C/A位点多态性分布
注:与未破裂组比较,*P<0.01。
3 讨论
IL-10是体内最重要的抑炎性细胞因子,可由Th2细胞、CD4+和CD8+T细胞、B细胞、巨噬细胞及树突状细胞等分泌,其中以Th2细胞、CD8+T细胞及巨噬细胞为主[2]。IL-10既能抑制Th1细胞合成分泌IFN-γ等促炎性细胞因子、下调细胞免疫反应,又可以通过下调主要组织相容性复合体Ⅱ类抗原与CD54、CD80和CD68等协同刺激分子的表达,减弱其抗原呈递能力,在免疫反应的调节中发挥关键作用。IL-10的产生由遗传决定,特别是基因启动子区对IL-10产生起重要作用。国外有研究表明,IL-10基因启动子区域-819C/T、-592C/A位点的SNP与IL-10基因的转录活性及血清中IL-10的水平有关[3]。李贞娟等[4]研究结果亦显示,IL-10 启动子区SNP影响IL-10 表达。人IL-10基因定位于1号染色体的q31-32,其基因组包括5个外显子和4个内含子,并具有NF-κB和AP-1的结合位点。IL-10基因转录起始部位上游处有3个SNP位点,即-1 082G/A、-819C/T、-592C/A。其中有些SNP 可能与疾病有关,寻找特定的SNP是发现相关疾病易感基因的非常重要途径[5]。IL-10 SNP与疾病的易感性、严重程度等有相关关系[6,7]。Lee等[8]曾报道IL-10 SNP与韩国人群胃癌的发病关系。
IAs发病和破裂的具体机制尚不明确。近年研究发现,IAs组织中存在白细胞和巨噬细胞浸润,同时存在大量免疫和炎症相关基因的异常表达,表明免疫和炎症反应在IAs发生和发展过程中起重要作用[9]。有国外学者观察到IL-6和TNF-α等炎性细胞因子在IAs中的致病作用[10,11]。Sun等[12]曾报道IL-6 -572G/C SNP与中国汉族人IAs的相关关系。本研究结果显示,IL-10 -819 C/T位点CC基因型与CT+TT基因型比较,后者增加了IAs发生破裂的风险性;-592C/A位点CA+AA基因型较CC基因型患者IAs破裂的风险更高;破裂组与未破裂组相比,-819位点T等位基因、-592位点A等位基因频率更高。提示IL-10 SNP可能与IAs的进展及破裂相关。其可能机制为IL-10-819T等位基因及-592A等位基因会直接影响转录因子EtsY与该序列DNA结合,使之不能结合EtsY从而抑制转录,因此IL-10的水平明显下降。IL-10的减少则不能发挥其抑制MMP[13]和TNF-α、IL-1β、IL-6等促炎性细胞因子生成、减轻炎症反应的作用,TNF-α、IL-6可促进成纤维细胞等对MMP的释放[14],炎症细胞因子TNF-α、IL-1β、IL-6等相互促进,启动和加重了血管壁的炎症反应,它们的过度分泌和表达可破坏血管壁内皮以及平滑肌的结构与功能,通过介导炎症反应的多种炎细胞分泌的蛋白酶类直接导致胶原蛋白和弹性蛋白降解及血管重构,从而导致管壁变薄、脆性增加、抗张力性能减弱,在血流动力学改变等协同作用下,进一步诱导动脉瘤的发生发展,直至破裂而发生SAH。反之,-819位点C等位基因和-592位点C等位基因携带者IL-10基因表达增加,血浆水平相对较高,抗炎效应显著,血管壁保护作用较强,从而降低了IAs患者的破裂风险。
本研究存在一定的选择偏倚,且未能检测患者体内IL-10浓度,但在设计与质量控制中调整了年龄、性别和高危人群种类等混杂因素,减少了这些因素对结果的影响。本结果为IL-10的生物学作用研究提供了一个新的思路,有助于我们对IAs破裂机制进行深入研究以及对未破裂IAs患者进行早期基因干预,但尚需在不同族群、大样本、前瞻性研究中得到验证。
[1] Lin N, Ho A, Charoenvimolphan N, et al. Analysis of morphological parameters to differentiate rapture status in anteriorcommunicating artery aneurysms[J]. PLoS One, 2013,8(11):e79635.
[2] Kamanaka M, Kim ST, Wan YY, et al. Expression of interleukin -10 in ineestinal lymphocytes dected by an interleukin-10 reporter knoekin tiger mouse [J]. Immunity, 2007,25(6):941-952.
[3] Falconer K, Gonzalez VD, Reichard O, et al. Spontaneous HCV clearance in HCV/HIV-1 coinfection associated with normalized CD4 counts, low level of chronic immune activation and high levelof T cell function[J]. J Clin Virol, 2008,41(2):160-163.
[4] 李贞娟,张彩凤,韩宇,等.IL-10 SNP与溃疡性结肠炎的相关性研究[J].山东医药,2012,52(13):49-51.
[5] Shen Y, Zhou HM, Zheng YF, et al. Current challengesand concepts of the thermomechanical treatment of nickeltitanium instruments[J]. J Endod, 2013,39(2):163-172.
[6] Ates O, Musellim B, Ougen G, et al. Interleukin-10 and tumor necrosis factor-alpha gene polymorphism in tuberculosis[J]. Clin Immunol, 2008,28(3):232-236.
[7] Nemec P, Goldbergova MP, Gatterova J, et al. Association of polymorphisms in interleukin-10 gene promoter with auto- antibody production in patients with rheumatoid arthritis[J]. Ann N Y Acad Sci, 2009,1173:501-508.
[8] Lee KM, Lee JS, Jung HS, et al. Late reactivation of sonic hedgehog by Helicobacter pylori results in population of gastric epithelial cells that are resistant to apoptosis: implication for gastric carcinogenesis[J]. Cancer Lett, 2010,287(1):44-53.
[9] Hanafy KA, Grobelny B, Fernandez L. Brain interstitial fluid TNF-alpha after subarachnoid hemorrhage[J]. J Neurol Sci, 2010,291(1-2):69-73.
[10] Koo YH, Kim TG, Kim OJ, et al. Multiple fusiform cerebral aneurysms and highly elevated serum interleukin-6 in cardiac myxoma[J]. J Korean Neurosurg Soc, 2009,45(6):394-396.
[11] Starke RM, Raper DM, Ding D, et al. Tumor necrosis factor-α modulates cerebral aneurysm formation and rupture[J]. Transl Stroke Res, 2014,5(2):269-277.
[12] Sun H, Zhang D, Zhao J. The interleukin-6 gene-572G>C promoter polymorphism is related to intracranial aneurysms in Chinese Han nationality[J]. Neurosci Lett, 2008,440(1):1-3.
[13] Aoki T, Kataoka H, Moriwaki T, et al. Role of TIMP-1 and TIMP-2 in the progression of cerebral aneurysms[J]. Stroke, 2007,38(2):2337-2345.
[14] Yao JS, Zhai W, Young WL, et al.Interleukin-6 triggers humancerebral endothelial cells proliferation and migration: the role for KDR and MMP-9[J].Biochem Biophys Res Commun, 2006,342(4):1396-1404.
10.3969/j.issn.1002-266X.2016.29.019
R732.2
B
1002-266X(2016)29-0056-03
2015-10-08)
