改良分次酶消化法分离培养兔肌腱干细胞及诱导分化鉴定*
2016-10-22张立岩孙新田丹徐睿雷昊艾津辉王华王海涛陈继营柴伟
张立岩,孙新,田丹,徐睿,雷昊,艾津辉,王华,王海涛,陈继营,柴伟
(1.北华大学附属医院骨外1科,吉林吉林132001;2.北华大学生命科学研究中心,吉林吉林132001;3.解放军总医院,北京100853)
论著
改良分次酶消化法分离培养兔肌腱干细胞及诱导分化鉴定*
张立岩1,孙新2,田丹2,徐睿1,雷昊1,艾津辉1,王华1,王海涛1,陈继营3,柴伟3
(1.北华大学附属医院骨外1科,吉林吉林132001;2.北华大学生命科学研究中心,吉林吉林132001;3.解放军总医院,北京100853)
目的采用改良分次酶消化法体外分离培养家兔肌腱干细胞,观察其生物学特性,并进行诱导分化及鉴定。方法无菌条件下取出家兔髌腱组织,分别运用改良的分次酶消化法和酶消化后低密度稀释接种法进行分离、培养、传代,用倒置相差显微镜观察细胞形态特征并绘制两种方法的生长曲线,通过流式细胞鉴定仪检测肌腱干细胞表面抗原标志物的表达,取P3-P4代肌腱干细胞向成骨细胞、成软骨细胞诱导分化并鉴定。结果改良的分次酶消化法较酶消化后低密度稀释接种法细胞增殖速度加快,形态均一,杂质细胞少。分离出的肌腱干细胞表面抗原标志CD90、CD44呈阳性,而CD34、CD14呈阴性,证实之前分离的细胞为肌腱干细胞。鉴定出肌腱干细胞具有向成骨细胞和成软骨细胞分化能力。结论采用改良的分次酶消化法分离培养兔肌腱干细胞简单易行,肌腱干细胞生长及传代速度可观,活性良好,纯度较高。另外,肌腱干细胞的成功分离培养,也为肌腱相关疾病的研究开辟了一条新途径。
改良酶消化法;肌腱干细胞;分化鉴定
肌腱干细胞(tendon stem cells,TDSCs)是具有自我复制和多向分化潜能的干细胞[1]。目前,关于肌腱病的发病机制多集中在肌腱干细胞方面的研究。RUI等[2]研究发现,慢性腱病的发生、发展可能是肌腱干细胞发生错误分化所致。LONGO等[3]证实,肌腱损伤后愈合速度十分缓慢并易形成疤痕组织,降低肌腱的韧性,经过损伤修复后的肌腱往往更容易再次受到损伤。该病变的原因可能与肌腱干细胞的异常分化有关。
采用酶消化后低密度稀释接种法是目前分离、培养肌腱干细胞最为常用的方法。但传统酶消化法培养过程中容易出现细胞损伤及生长周期缓慢等局限性,且培养出的干细胞有体外活力差、纯度不高等问题[4]。目前也没有某种特异性的方法用来鉴定培养出来的肌腱干细胞。因此,本次研究对常规方法进行改进,采用改良的分次酶消化法培养家兔肌腱干细胞,可以达到干细胞活性良好、增殖速度快、纯度较高的目的,并对其进行分化能力鉴定。通过本实验确立高效、稳定的家兔肌腱干细胞分离培养体系和鉴定方案,旨在为进一步研究肌腱相关疾病的发病机制和防治药物奠定基础。
1 材料与方法
1.1材料
1.1.1实验动物3月龄家兔10只,体重2.0~3.0kg,由北华大学动物实验中心提供,饲养在北华大学动物实验室。动物标本收集,符合单位相关伦理学规定。
1.1.2主要实验仪器与设备70μm细胞过滤器(美国Biologix公司),不锈钢细胞筛网(上海易佰聚经贸有限公司),二氧化碳CO2恒温孵箱(美国Thermo公司),倒置相差显微镜(日本Olympus公司),低速离心机(上海安亭科学仪器厂Anke),超净工作台(上海力申科学仪器有限公司),流式细胞仪(美国Becton Dickinson公司),细胞培养皿、培养瓶、离心管(美国Coring公司)。
1.1.3主要试剂DMEM培养液(美国Gibco公司);胎牛血清FBS(美国Gibco公司),Ⅱ型胶原蛋白酶(美国Sigma公司),0.20%DTA、0.25%胰蛋白酶(美国Gibco公司),青霉素链霉素混合液P/S(美国Gibco公司),CD90、CD44、CD14、CD34一抗(美国Becton Dickinson公司),维生素C、地塞米松、β-磷酸甘油钠、骨化三醇、维甲酸(美国Sigma公司),TGF-β(美国R&D Systems公司),碱性磷酸酶染液(南京建成科技有限公司),阿尔新蓝染液(美国Sigma公司)。
1.2方法
1.2.1家兔髌腱组织的分离适应性喂养1周后,随机取3月龄家兔1只,用25%乌拉坦按4ml/kg经耳缘静脉麻醉。于髌骨和胫骨结节之间切前正中切口,长约3.0cm,用眼科剪在髌腱中段剪取2.0cm× 1.0cm髌腱组织,放入盛有10ml PBS的Ep管中,将Ep管立刻转移至超净工作台内进行处理。
1.2.2肌腱干细胞的分离、培养、传代酶消化后低密度稀释接种法:参照秦胜男等[5]实验方法,剔除腱鞘及腱周组织,将肌腱均匀剪碎成1 mm3的碎块,每100 mg组织加入3 mg/mlⅠ型胶原酶37℃消化2 h,70μm细胞过滤器过滤形成单细胞悬液。将单细胞悬液以1 000 r/min离心5 min,弃去上清液,用PBS洗2遍,将细胞沉淀用10%FBS的DMEM培养液重悬。以200个/cm2细胞密度接种至10cm培养皿中,置于37℃、5%二氧化碳CO2饱和湿度培养箱中培养。
改良分次酶消化法:在酶消化法分离培养肌腱干细胞的基础上,本实验采用改良分次酶消化法。用PBS冲洗肌腱组织3次,剔除腱鞘及腱周部分组织,将组织转移至另一装有PBS的培养皿中。用眼科剪将肌腱均匀剪碎成1 mm3大小,转移至Ep管中,每100 mg组织加入0.20%EDTA和0.25%胰蛋白酶、3 mg/mlⅡ型胶原酶进行分次消化,放入37℃、5%二氧化碳CO2饱和湿度培养箱中分别消化30 min、90 min,每15min震荡1次Ep管。将消化液经过100目不锈钢细胞筛网过滤除去未消化完全的组织碎屑,连续用70μm细胞过滤器过滤除去杂质细胞,以1000r/min离心5min,弃去上清液,收集细胞。用不含血清的DMEM培养液离心漂洗2次,弃去上清液,加入10%FBS的DMEM培养液重悬细胞制成细胞悬液,以1×103/cm2的密度接种于10cm培养皿中,置于37℃、5%二氧化碳CO2饱和湿度培养箱中培养。
原代细胞接种后24、48及72 h各换液1次,以后每3d换液1次,当细胞均匀铺满瓶底80%~90%面积时按1∶2或1∶3的比例传代,换液及传代后放入倒置相差显微镜下仔细观察细胞形态特征以及生长情况。原代细胞为P0代,细胞扩增后,取P3-P4代用于相关实验。
1.2.3肌腱干细胞生长曲线的绘制取生长状态良好的原代肌腱干细胞,吸除培养基,用PBS冲洗3遍后,加入适量的0.20%EDTA和0.25%胰蛋白酶,消化2~3min,镜下观察贴壁细胞逐渐脱落,变成圆形,个别细胞开始漂浮时,加入FBS终止消化,反复吹打,以1 500 r/min离心5 min,弃去上清液,收集细胞。加入10%FBS的DMEM培养液重悬细胞,以1×103/L的密度接种于24孔培养板中,1 ml/孔,置于37℃、5%二氧化碳CO2饱和湿度培养箱中培养。每日取3孔,0.20%EDTA和0.25%胰蛋白酶消化,用细胞计数板计数细胞数,求出平均值,以时间为横坐标、细胞数的平均值为纵坐标,绘制细胞生长曲线。
1.2.4肌腱干细胞的鉴定取生长状态良好的P3-P4代细胞,按上述方法收集细胞,10ml PBS重悬细胞,进行细胞计数,应保证分装后每个Ep管的细胞数不少于1×106个。4 ml PBS重悬细胞,将细胞悬液分装到8个2ml Ep管中,每管500μl,按1~8进行编号,1号管为空白对照组,2~6号管依次为CD44、CD44+90、CD90、CD31、CD14,7、8管为二抗阴性对照组。用PBS洗2次,30μl重悬后按编号加入相应一抗混匀,3个对照组不做处理,30μl重悬后按编号加入相应二抗混匀,避光室温下反应30min,PBS洗1次后经筛网过滤到相应编号的流式细胞管中,使用流式细胞仪进行细胞表面标志物的检测,并用Win MDI Version 2.9软件进行检测和分析细胞产生阳性信号的数值。
1.2.5肌腱干细胞诱导分化①成骨诱导分化:取P3-P4代肌腱干细胞进行成骨诱导,按上述方法将肌腱干细胞按以5×104个/孔的密度种植在6孔培养板中,置于37℃、5%二氧化碳CO2饱和湿度培养箱中孵育。培养24h后更换成骨诱导培养基(含10% FBS、10 nmol/L地塞米松、10 nmol/L骨化三醇、50μg/ml维生素C、10 mmol/L β-甘油磷酸钠的DMEM基础培养基),以后每3d更换成骨诱导培养基,诱导21d。诱导完成后,碱性磷酸酶染色,将细胞爬片用试剂1固定2~5 min,自然晾干,用蒸馏水润洗30 s,滴加基质液数滴,37℃避光孵育15 min,甩去多余的染液,立即滴加试剂4染液染色5 min,水洗30s,甩去多余的水,再滴加试剂5染液染色30 s,水洗30 s,甩去多余的水,滴加试剂6复染30 s,水洗30s,晾干后中性树胶封固。在倒置显微镜下观察钙盐沉积情况并采集图像。②成软骨诱导分化:取P3-P4代肌腱干细胞同上处理,用成软骨诱导培养基(含10%FBS、1μmol/L地塞米松、104μmol/l维甲酸、50μg/ml维生素C、10 ng/ml TGF-β的DMEM基础培养基)每3 d换液1次,诱导21 d。诱导完成后,用阿尔新蓝在酸性pH组织学染色,检测成软骨细胞特异性表达的Ⅱ型胶原。每孔加2 ml 4%多聚甲醛固定30 min,吸除固定液,每孔加入2 ml阿尔新蓝液,染色20min,加入3%醋酸洗液,清洗2min,再使用PBS冲洗3次,每次2 min,将细胞梯度乙醇脱水,蒸馏水冲洗3次,每次2min,干燥后中性树胶封固,在倒置显微镜下观察成软骨情况并采集图像。
2 结果
2.1肌腱干细胞细胞形态的观察
细胞经过7d的培养后,可以观察到肌腱干细胞聚集生长,细胞集落形成大小与细胞的接种密度有关,原代细胞较传代细胞大,细胞多呈多边形;P1代多呈扁平状;P3代多呈成纤维状细胞(见图1)。
2.2肌腱干细胞的生长曲线
从细胞计数来看,两组细胞潜伏期为2~4d,对数增殖期为6~9d,至第12天进入平台期。改良分次酶消化法原代细胞的增殖能力均优于酶消化后低密度稀释接种法,且获得的细胞数量更多(见图2)。
2.3肌腱干细胞的鉴定
采用流式细胞仪鉴定细胞表面抗原,肌腱干细胞表面抗原标志CD90、CD44均呈阳性,而CD14、CD34均呈阴性(见图3)。证实之前分离的干细胞为肌腱干细胞,极大程度排除细胞污染的可能。
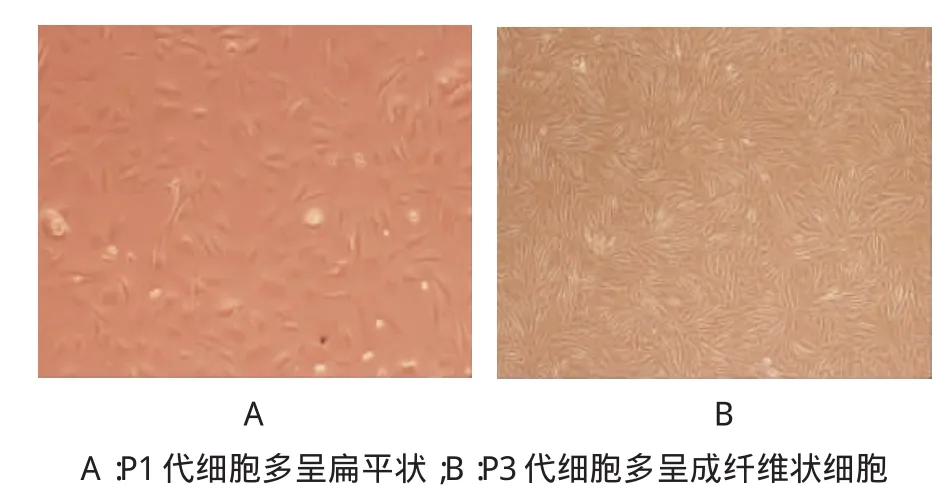
图1 肌腱干细胞(光镜×100)
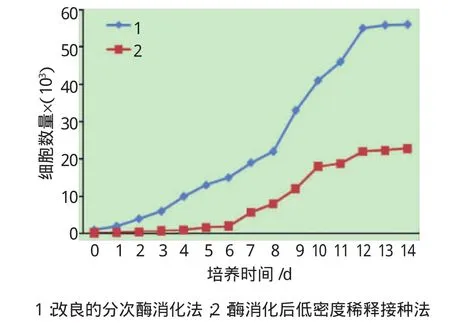
图2 改良分次酶消化法和酶消化后低密度稀释接种法培养的原代兔肌腱干细胞生长曲线比较
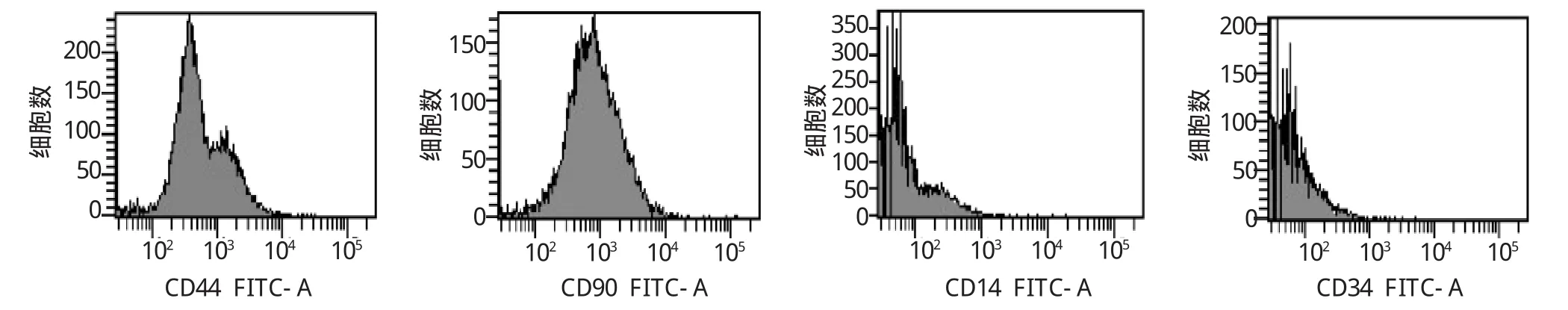
图3 流式细胞仪检测表面标志抗原表达,提示培养的肌腱干细胞表达CD44、CD90,不表达CD14和CD34
2.4肌腱干细胞诱导分化的鉴定
2.4.1成骨分化能力肌腱干细胞经21 d成骨诱导后,形成钙盐沉积,碱性磷酸酶染色为灰黑色颗粒或块状、条状沉淀,可见明显的钙化结节(见图4A)。
2.4.2成软骨分化能力肌腱干细胞经21 d成软骨诱导后,形成软骨样组织,质地较为坚硬,阿尔新蓝染色可见蓝染的Ⅱ型胶原,细胞外有软骨基质形成(见图4B)。
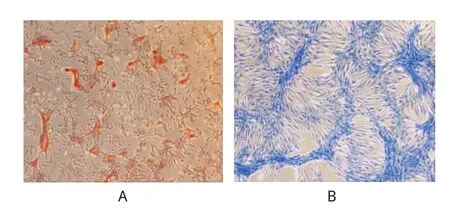
图4 肌腱干细胞(光镜×100)
3 讨论
自2007年BI等[6]首次从肌腱中分离出肌腱干细胞,并证实其具有多向分化潜能以后。其他学者也先后报道从人和动物的肌腱中分离培养出肌腱干细胞,并进一步明确该细胞具有多向分化潜能和自我更新能力[7-8]。随着人们对体育锻炼的日益重视,肌腱病的发病率也在逐年的提高,其以肌腱局部疼痛、肿胀、功能障碍为主要表现,肌腱病与肌腱干细胞的异常分化有关。肌腱干细胞具有明确的向成骨及成软骨分化,该特性适合修复股骨头坏死的病理过程,因此有望成为治疗股骨头坏死新的种子细胞[9]。然而据RUI[2]和BI等[6]的研究发现,在肌腱组织中肌腱干细胞含量极低,且在生理状态下处于休眠期,不发生增殖和分化。如何建立有效的肌腱干细胞体外分离培养方法是肌腱干细胞研究的核心问题。
目前肌腱干细胞可以从大鼠、家兔等的肌腱组织中分离培养获得[3,7],其体外分离的主要方法是将酶消化法和低密度稀释接种法相结合,酶消化法主要利用胶原酶消化组织间质,使细胞彼此分离,充分发挥肌腱干细胞增殖能力,且对细胞的损伤较小,低密度稀释接种法是利用干细胞能在较低的接种密度时增殖速度较其他已分化的细胞快的特点。但该方法在体外分离培养的过程中只对未消化完全的组织块进行过滤除杂,会使原代细胞中杂质细胞较多,而杂质细胞会影响肌腱干细胞增殖速度,只有经过连续传代后才能逐渐达到纯化的目的。本研究采用改良分次酶消化法,用0.25%胰酶和3mg/mlⅡ型胶原酶分次消化,在胶原酶的选择上采用Ⅱ型胶原酶,在前期实验过程中发现其优于Ⅰ型胶原酶,更适合消化肌腱组织,弃胰酶消化液和首次胶原酶消化液后,过滤除去未消化完全的组织块,再连续用滤器过滤除去杂质细胞后重悬细胞接种,该方法有效地避免原代细胞中杂质细胞较多的问题,但离心的过程可能会对细胞造成损伤,不过从结果上看原代细胞保持干细胞良好的增殖能力,且获得的肌腱干细胞数量相对前种方法更多,改良分次酶消化法细胞纯度也较前种方法更高,是一种可行且更加有效的方法。
实验利用改良分次酶消化法分离纯化大量肌腱干细胞,细胞培养至P3代时,可得到活性良好、形态均一、较高纯度的肌腱干细胞。然而肌腱干细胞仍缺乏特异性的免疫标志物,目前已证实,肌腱干细胞具有和骨髓间充质干细胞(BMSCs)等其他干细胞相似的标志物:白细胞分化抗原分化群(CD44、CD90、CD90.1、CD90.2、CD105、CD146)、干细胞抗原-1(Sca-1)、基质细胞抗原(Stro-1)、核干细胞因子(NS)等。不表达造血干细胞表面标记物CD34和白细胞分化抗原CD14[10]。该数据表明肌腱干细胞与BMSCs非常相似,但又不完全一致。有研究进一步证实肌腱干细胞中肌腱相关标记物(tenomodulin,scleraxis,typeⅠcollagen,decorin和biglycan)、软骨相关标记物(typeⅡcollagen和aggrecan)以及骨相关标记物(ALP和Os teocalcin)的mRNA表达均明显高于BMSCs[6]。在人和鼠的肌腱干细胞中都没有CD18的表达,而在BMSCs中就存在这种分子[11],该差异可能决定肌腱干细胞在分化时不同于BMSCs。但其特征性的免疫标志物还有待进一步研究。本实验经流式细胞仪检测发现,改良分次酶消化法培养P3代细胞能够较稳定、均一地表达细胞表面抗原CD90、CD44,几乎不表达CD34、CD14,证实该方法可制备纯度较高的肌腱干细胞群。
除检测细胞表面标志物外,本实验还分别将P3-P4代的肌腱干细胞向成骨、成软骨方向进行诱导。结果显示,在诱导分化过程中,分别诱导出成骨细胞、成软骨细胞的标志-钙化结节和蓝染的Ⅱ型胶原,证实本方法培养的肌腱干细胞具有向成骨细胞、成软骨细胞分化潜能。
综上所述,本研究采用改良分次酶消化法成功分离、纯化肌腱干细胞,此法分离培养的肌腱干细胞具有活性良好、形态均一、较高纯度的特点,因此有望成为较理想的组织工程种子细胞,为肌腱干细胞的进一步研究和应用提供良好的基础。
[1]芮云峰,郭永刚,等.BMP-2诱导人髌腱来源肌腱干细胞成软骨分化的实验研究[J].中国修复重建外科杂志,2013,27(12):1492-1498.
[2]RUI Y F,LUI P P,WONG Y M,et al.Altered fate of tendonderived stem cellsisolated from a failed tendon-healing animal model of tendinopathy[J].Stem Cells Dev,2013,22(7):1076-1085.
[3]LONGO U G,LAMBERTI A,MAFFULLI N,et al.Tissue engineered biological augmentation for tendon healing:a systematic review[J].Br Med Bull,2011,98:31-59.
[4]王双利,查振刚,等.改进酶消化法培养SD大鼠成骨细胞及其鉴定[J].实用医学杂志,2008,24(6):915-918.
[5]秦胜男,王文,傅世铨,等.人髌腱干细胞的分离培养与鉴定[J].中国矫形外科杂志,2014,22(24):2269-2276.
[6]BI Y,EHIRCHIOU D,KILTS T M,et al.Identification of tendon stem/progenitor cells and the role of the extracellular matrix in their niche[J].Nat Med,2007,13(10):1219-1227.
[7]ZHANG J Y,WANG J H.Characterization of differential properties of rabbit tendon stem cells and tenocytes[J].BMC Musculosk-elet Disord,2010,11:10.
[8]胡超,唐康来,陈万,等.大鼠跟腱来源肌腱干细胞的分离培养及鉴定[J].第三军医大学学报,2013,35(11):1097-1101.
[9]张立岩,徐睿.肌腱干细胞的特性及在股骨头坏死治疗中的应用[J].中国临床医生杂志,2015,43(3):30-33.
[10]LEE W Y,LUI P P,RUI Y F.Hypoxia-mediated efficient expansion of human tendon-derived stem cells in vitro[J].Tissue Eng Part A,2012,18(5/6):484-498.
[11]YIN Z,CHEN X,CHEN J L,et al.The regulation of tendon stem cell differentiation by the alignment of nanofibers[J].Biomaterials,2010,31(8):2163-2175.
(张蕾编辑)
Isolation and culture of rabbit tendon stem cells by modified fractional enzyme digestion and identification of their induced differentiation*
Li-yan Zhang1,Xin Sun2,Dan Tian2,Rui Xu1,Hao Lei1,Jin-hui Ai1,Hua Wang1,Hai-tao Wang1,Ji-ying Chen3,Wei Chai3
(1.The First Department of Orthopaedics,the Affiliated Hospital of Beihua University,Jilin,Jilin 132001,China;2.Life Science Research Center,Beihua University,Jilin,Jilin 132001,China;3. Department of Orthopedics,General Hospital of Chinese PLA,Beijing 100853,China)
Objective To isolate and culture rabbit tendon stem cellsin vitro by a modified fractional enzyme digestion method,observe their biological characteristics,and induce and identify their differentiation.Methods Rabbit patellar tendon tissue was removed under sterile condition.After the tissue was digested by a modified fractional enzyme digestion method and enzyme digestion method respectively,a low-density dilution inoculation method was adopted to isolate,culture and passage the rabbit tendon stem cells.Morphological characteristics of the cells were observed under an inverted phase contrast microscope and the growth curves of the cells isolated from the tendon tissue with the two methods were drawn.The expressions of tendon stem cell surface antigen markers were identified by a flow cytometer.The P3-P4 generations of the tendon stem cells were induced for the differentiation into osteoblasts and chondroblasts,and the differentiation was identified.Results The proliferation of tendon stemcells isolated by the modified fractional enzymatic digestion and inoculated with low-density dilution inoculation method was accelerated,and the cell shapes were uniform with few impure cells.Surface antigen markers CD90 and CD44 of the isolated tendon stem cells were positive,but CD34 and CD14 were negative,indicating that the isolated cells were the tendon stem cells and the identified tendon stem cells had the ability of differentiation into osteoblasts and chondroblasts.Conclusions The modified fractional enzyme digestion for isolation and culture of rabbit tendon stem cells is simple and practicable.The growth and passage speed of the cells are satisfactory,their viability is good,and the purity is high.In addition,the successful isolation and culture of tendon stem cells may create a new way for the research on tendon-related diseases.
modified enzyme digestion method;tendon stem cell;differentiation and identification
10.3969/j.issn.1005-8982.2016.18.001
1005-8982(2016)18-0001-05
中国分类号:R 318A
2016-04-27
国家自然科学基金委员会资助项目(81301564);吉林省教育厅“十二五”科学技术研究项目(吉教科合字【2015】第141号);吉林省科技厅项目(20130624003JC);吉林省教育厅“十二五”科学技术研究项目(吉教科合字【2011】第132号);吉林市科技项目(201536048)
孙新,E-mail:sunxinbh@126.com;Tel:18604498911
