MicroRNA-219-5p靶向E-钙黏蛋白调控上皮间质转化抑制肝癌细胞侵袭转移
2016-10-22朱理辉罗勇廖文秋张琍李国庆
朱理辉,罗勇,廖文秋,张琍,李国庆
(南华大学附属第二医院1.消化内科,2.重症医学科,湖南衡阳421001)
MicroRNA-219-5p靶向E-钙黏蛋白调控上皮间质转化抑制肝癌细胞侵袭转移
朱理辉1,罗勇2,廖文秋1,张琍1,李国庆1
(南华大学附属第二医院1.消化内科,2.重症医学科,湖南衡阳421001)
目的研究MicroR NA-219-5p(miR-219-5p)靶向E-钙黏蛋白(E-Cadherin)调控上皮间质转化(EMT)抑制肝癌细胞侵袭转移的分子机制。方法首先通过生物信息学方法,寻找与E-Cadherin结合特异性最好、稳定性强的miR NAs。在30例肝癌组织和20例癌旁肝组织中,通过蛋白免疫印迹法(Western blot)检测E-Cadherin的表达水平;实时荧光定量PCR检测(qR T-PCR)miR-219-5p表达,分析两者之间的相关性。在高转移和低转移的肝癌细胞株中,qR T-PCR检测miR-219-5p表达,Western blot检测E-Cadherin、N-cadherin表达。采用Lipofectamine 2000将miR-219-5p模拟子(mimic)、抑制子(inhibitor)、阴性对照组(negative contral)转染到肝癌HepG2细胞系,qR T-PCR检测miR-219-5p表达,Western blot检测E-Cadherin、N-cadherin的表达;Transwell方法检测miR-219-5p表达改变对肝癌细胞侵袭转移能力的影响。结果生物信息学发现miR-219-5p与E-Cadherin结合最稳定,且特异性最好。肝癌组织中miR-219-5p低表达、E-Cadherin高表达,而癌旁组织中miR-219-5p高表达、E-Cadherin低表达。高转移细胞株中miR-219-5p高表达、E-Cadherin低表达而N-cadherin高表达,在低转移细胞株中miR-219-5p低表达、E-Cadherin高表达而N-cadherin低表达(P<0.05)。miR-219-5p水平表达增高,引起E-Cadherin表达下调,N-cadherin高表达;miR-219-5p表达下调,可引起E-Cadherin表达上调,N-cadherin低表达(P<0.05);HepG2-miR-219-5p模拟子细胞株中侵袭细胞计数为(24±3)个/高倍镜视野,明显低于对照组细胞株(P<0.05)。结论miR NA-219-5p可通过靶向结合E-Cadherin,调控EMT信号通路,抑制肝癌细胞的侵袭转移。
miR NA;肝癌;侵袭转移;E-Cadherin;上皮间质转化
原发性肝细胞癌(hepatocellular carcinoma,HCC)是原发于肝细胞或肝内胆管细胞的恶性肿瘤,恶性程度高,容易发生血道转移,早期诊断困难。因此,临床上大多数肝癌患者就诊时,已处于临床中晚期,预后较差[1]。目前,临床上治疗肝癌总的疗效仍不理想,大多数患者治疗失败的原因是由于肿瘤发生转移[2-3]。目前针对肝癌转移复发的分子机制的研究,对于探索肝癌的临床治疗新方法和提高疗效,具有重要的临床和现实意义。
上皮间质转化(epithelial mesenchymal transition,EMT)指上皮细胞转变为具有间质细胞表型的生物学过程。在胚胎的发育、炎症、组织的重建、癌症转移过程中具有重要作用[4-5],其主要的特征有:如E-钙黏蛋白(E-cadherin)、β-catenin、角蛋白等表达下调,而间质细胞表型的N-钙黏蛋白(N-cadherin)、波形蛋白等表达上调,并且诱导上皮-间质转化的细胞因子和转录因子表达上调等[6-7]。肿瘤细胞发生EMT,导致上皮细胞失去极性,黏附能力下降,从而失去与基底膜的连接,获得较高的迁移与侵袭能力,以及降解胞外基质等能力[8]。EMT与肿瘤侵袭转移关系密切,但有关EMT的调控分子机制目前尚不清楚。研究发现,在HCC临床研究和动物实验中,发现EMT的发生与肝癌细胞的转移以及化疗药物耐药有关,在此过程中,许多microRNAs(miR)分子参与了EMT的调节[9]。本研究拟探讨肝癌细胞中,miR调控E-Cadherin影响EMT与肝癌细胞侵袭转移的分子机制。
1 资料与方法
1.1临床标本及资料
30例原发性肝癌组织标本及20例癌旁正常肝组织标本均来自南华大学附属第二医院消化内科住院患者活检或手术切除的新鲜标本。原发性肝癌患者,男性19例,女性11例;年龄32~75岁,中位平均(55.5±7.2)岁。20例癌旁正常肝组织来源于肝组织活检。所有病例均经两位高年资副主任以上职称的病理医生诊断,结果均证实准确无误。置入-80℃冰箱冷冻保存备用。
1.2细胞株
肝癌细胞系HepG2、人肝癌细胞低转移细胞系MHCC97-L、人肝癌细胞高转移细胞系MHCC97-H均购自中南大学细胞中心。
1.3主要试剂
免疫组织化学SP法试剂盒为福州迈新生物公司产品,鼠抗人单克隆E-Cadherin、N-cadherin抗体、β-actin抗体、过氧化物酶标记的二抗、脂质体Lipofectamine 2000均购自美国Santa Cruz公司,qRT-PCR试剂为日本TaKaRa公司产品,Transwell侵袭试剂盒为美国Corning公司产品,Matrigel胶为美国B&D公司产品。
1.4生物信息学分析
E-Cadherin(CDH1)的靶miRNAs预测:通过miRwalk在线程序进行,利用10个常用的生物信息学软件对miRNA-CDH1之间的结合进行预测和分析。预测与CDH1结合的最佳靶miRNA:通过mi-Randa在线程序进行热力学稳定性评分以及序列保守性评分,对miRNAs-CDH1之间结合的特异性和稳定性进行排序。
1.5qRT-PCR
首先采用Trizol法提取总RNA。PCR扩增采用两步法进行。程序设定如下:95℃、30 s进行1个循环;95℃、30s,60℃、30s,进行40个循环。miR-219-5p的qRT-PCR引物,正向引物:5'-CCGCCCCGGGC CGCGGCUCC-3',反向引物:5'-GCCCCCAAACCUCG AGCGGG-3',由广州锐博生物科技有限公司技术合成。在实时荧光定量PCR仪上进行检测,实验重复3管,取平均值。反应体系如下:10μmol/L正向引物1μl;10μmol/L反向引物1μl;DNA模板2μl;ddH2O 8.5μl;2×SYBR Primix Ex TaqTMⅡ12.5μl;总反应体系为25μl。
1.6蛋白免疫印迹法(Western blot)
提取细胞的总蛋白,Bradford法测蛋白浓度;蛋白样品置于100℃水浴中变性5 min;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)电泳,设定电压为100 V,时间约1~2 h;采用聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜三明治转移法,转膜电压为100 V,时间为1 h;丽春红溶液染色3~5 min;5%脱脂奶粉封闭,1~2 h;杂交袋中,加入5%的封闭液和一抗(浓度为1︰1 500),4℃冰箱中过夜;再与二抗结合(浓度1︰1 000);暗室中压上X线片,曝光约30~90 s,定影显影、洗片,最后通过扫描仪进行图像扫描。
1.7Trasnwell实验
采用Lipofectamine2000将miR-219-5p模拟子(mimic)、抑制子(inhibitor)、阴性对照组(negative contral)转染到肝癌HepG2细胞系,获得3个重组细胞株:HepG2-miR-219-5p mimic、HepG2-miR-NC、HepG2-miR-219-5p-inhibitor。具体步骤如下:培养细胞密度到3×105/孔,6孔板接种。细胞融合度达80%时,进行脂质体转染。Transwell侵袭小室实验:①侵袭小室的预处理:首先将Matrigel胶与无血清培养基按1︰100稀释,将稀释液用来浸泡侵袭小室。在侵袭小室上面加入100μl稀释的基质胶,紫外线消毒杀菌。②小室腔压力的平衡:在小室的上腔中加入200μl、下腔中加入600μl的无血清培养基,平衡小室腔内的压力。③侵袭细胞计数:将侵袭小室取出,对膜上的细胞加无水乙醇进行固定,结晶紫染色。将未侵入基质的肿瘤细胞通过棉签轻轻擦拭掉,未除掉即为已经成功侵入基质胶中的肿瘤细胞,计数10个高倍视野中(×20)侵袭细胞的数目,重复3次,取均值,进行统计分析。
1.8统计学方法
采用SPSS 17.0统计软件进行数据分析,计量资料用均数±标准差(±s)表示,3组均数的比较用方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1miRWalk预测CDH1(E-cadherin)基因的靶miRNAs
采用miRwalk在线程序对CDH1的靶miRNA进行预测,结果发现10个软件当中有5个以上预测到有20个miRNAs可与CDH1结合(见表1)。
2.2miRanda预测miRNA-CDH1的结合
上述20个靶miRNAs在miRanda软件当中的热动力学稳定性分值和序列保守性分值见表2。结果发现,符合条件的miRNAs(热动力学稳定性分值≤-0.1,序列保守性分值为0.5~0.7)有8个,其中,miR-219-5p与CDH1结合的热动力学稳定性得分最低,说明miR-219-5p-CDH1之间的结合稳定性最高、特异性最好。
2.3肝癌组织中miR-219-5p与E-Cadherin表达的关系
30例肝癌组织中miR-219-5p平均表达水平低于20例癌旁肝组织,两者表达的差异有统计学意义;而肝癌组织中E-Cadherin相对表达水平高于癌旁肝组织,经t检验,两者表达差异有统计学意义(t=10.354,P=0.000,见图1)。说明肝癌组织中出现miR-219-5p低表达和E-Cadherin高表达,而癌旁肝组织中出现miR-219-5p高表达和E-Cadherin低表达。
2.4肝癌细胞中miR-219-5与E-Cadherin表达的关系
分析显示在高转移细胞株MHCC97-H中miR-219-5p相对水平低于低转移细胞株MHCC97-L,高转移细胞株MHCC97-H中E-Cadherin相对表达水平低于低转移细胞株MHCC97-L,高转移细胞株MHCC97-H中N-cadherin相对表达水平高于低转移细胞株MHCC97-L(见图2)。说明肝癌细胞中miR-219-5p表达下调,导致E-Cadherin表达下调,miR-219-5p可能通过调控E-Cadherin/N-cadherin的表达水平,与肝癌细胞侵袭转移有关。
2.5miR-219-5p与E-Cadherin结合验证
3个重组细胞株HepG2-miR-219-5p mimic、HepG2-miR-NC、HepG2-miR-219-5p-inhibitor中,HepG2-miR-219-5p mimic细胞株中miR-219-5p水平表达增高,而E-Cadherin表达水平下调,N-cadherin高表达;HepG2-miR-219-5p-inhibitor细胞株中miR-219-5p水平表达下调,而E-Cadherin表达水平上调,N-cadherin低表达(见图3)。说明转染miR-219-5p mimic后,miR-219-5p表达水平增高,下调E-Cadherin而N-cadherin上调;而转染miR-219-5p inhibitor后,miR-219-5p表达水平下调,上调E-Cadherin而N-cadherin下调。说明miR-219-5p能和E-Cadherin的发生结合下调其表达水平,与EMT有关。
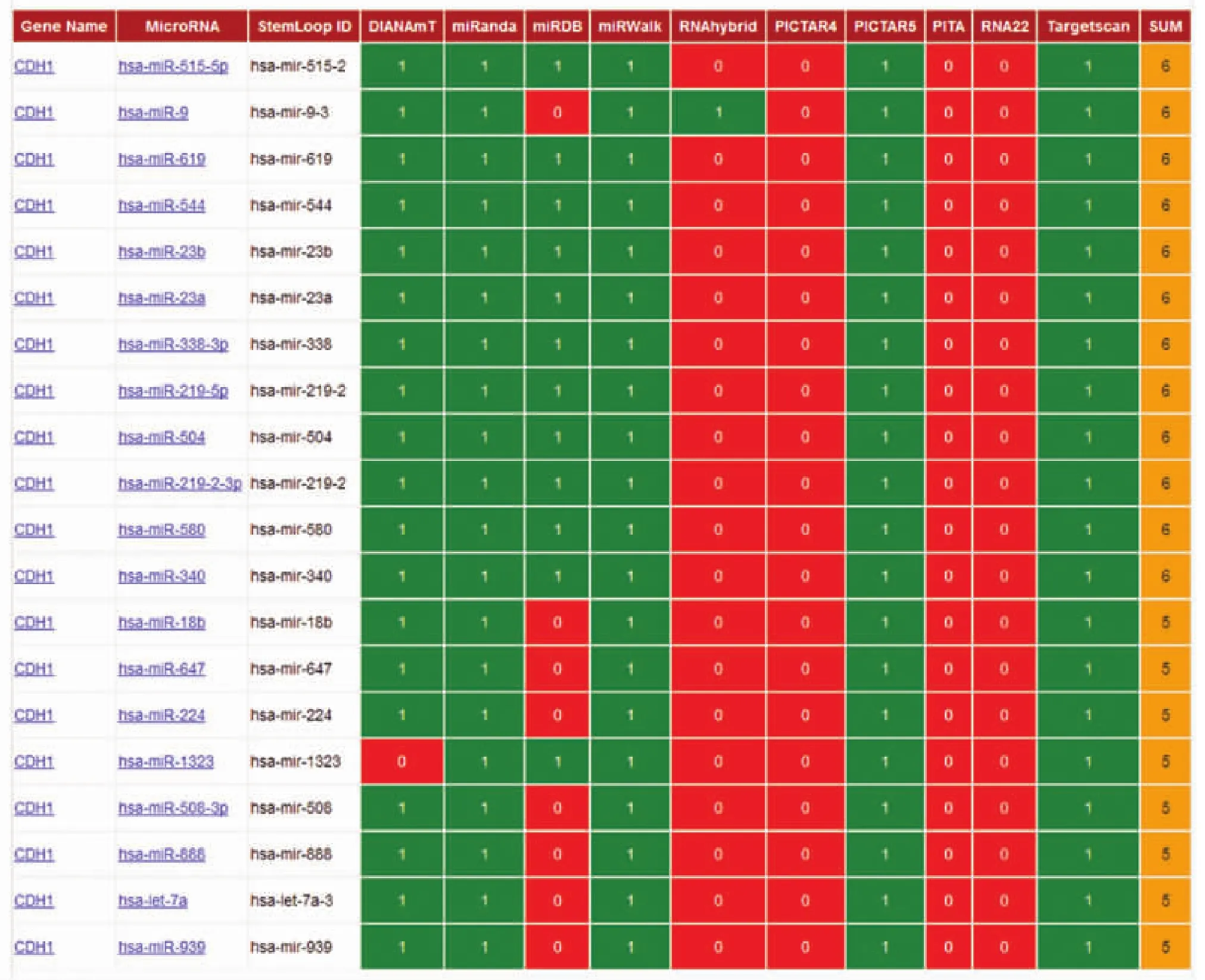
表1 预测的20个miRNAs可与CDH1结合
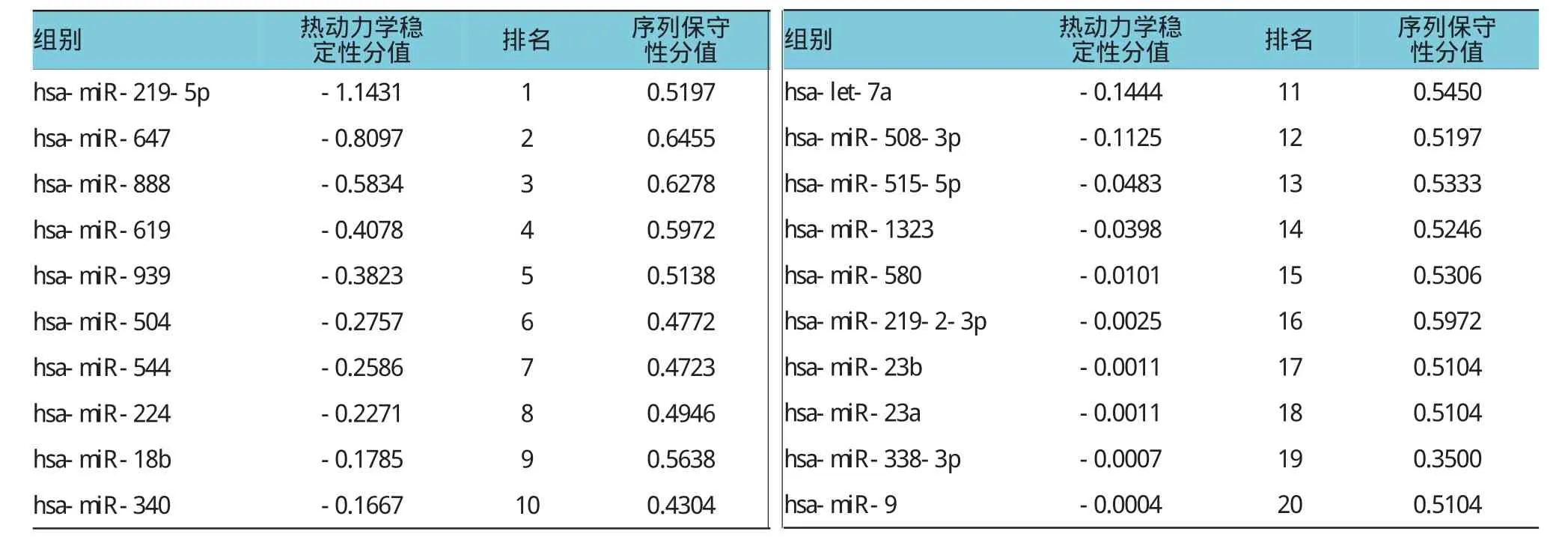
表2 预测的12个miRNAs的热动力学稳定性和序列保守性得分
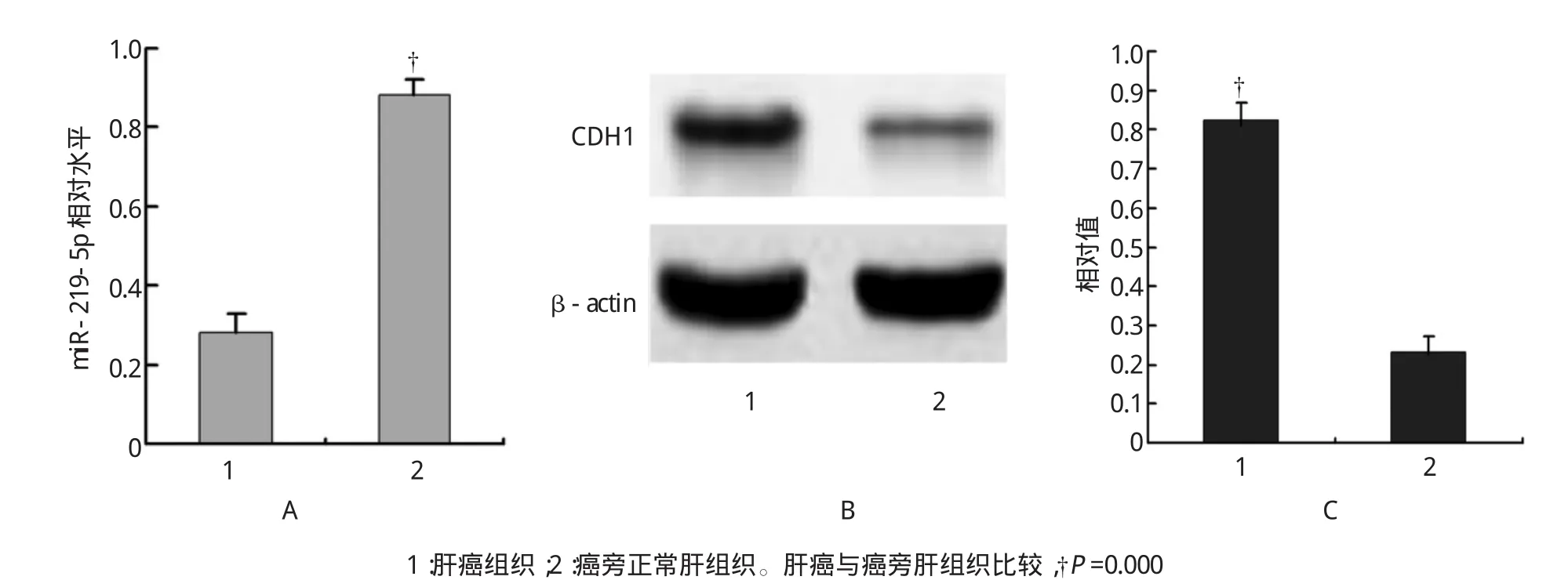
图1 肝癌和癌旁肝组织中miR-219-5p与E-Cadherin表达的关系
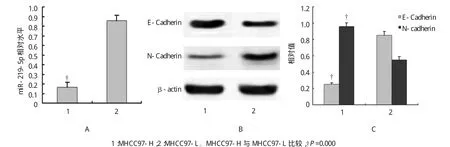
图2 肝癌细胞中miR-219-5p与E-Cadherin、N-cadherin表达关系
2.6miR-219-5p下调E-Cadherin与肝癌侵袭能力变化
Transwell实验检测转染miR-219-5p mimic下调E-Cadherin后,结果显示,HepG2-miR-219-5p mimic细胞株中侵袭细胞计数为(24±3)个/高倍镜视野,明显低于HepG2-miR-NC的(47±5)个/高倍镜视野、HepG2的(51±5)个/高倍镜视野,经t检验,两者差异有统计学意义(t=9.952,P=0.003,见表3和图4);HepG2-miR-219-5p-inhibitor细胞株中侵袭细胞计数为(97±8)个/高倍镜视野,均明显高于其他3组,经t检验,差异有统计学意义(t=8.856,P= 0.005,见表3和图4)。
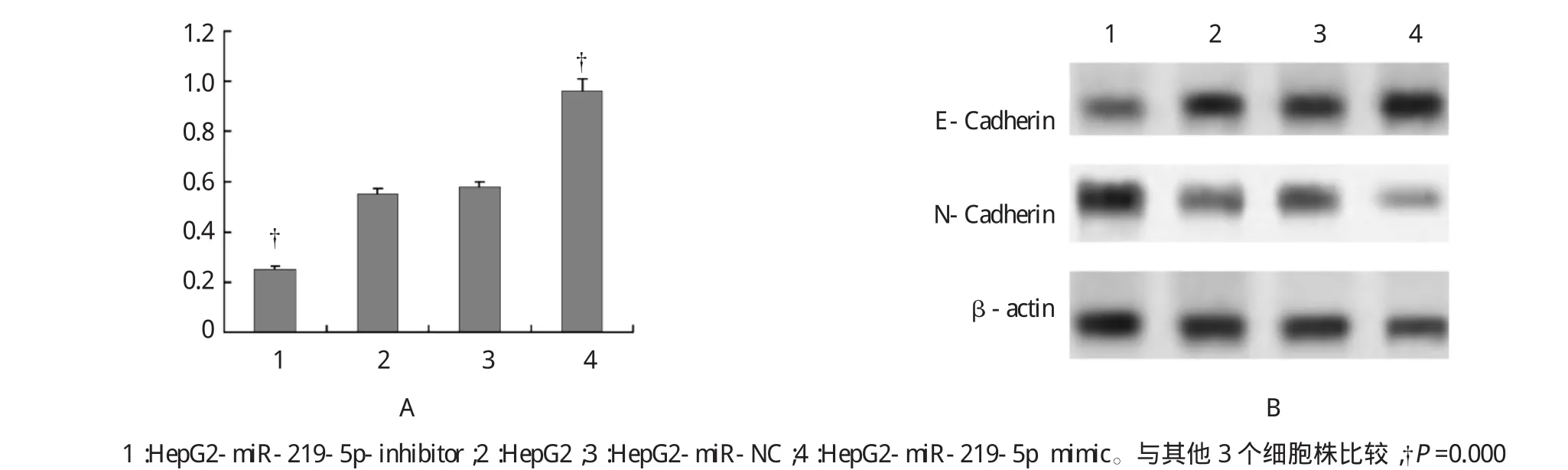
图34 个细胞系中miR-219-5p与E-Cadherin表达关系
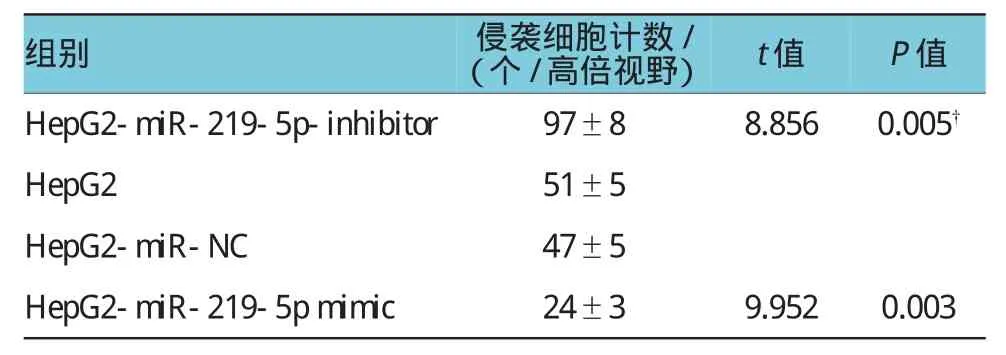
表3 不同肝癌细胞系的侵袭细胞计数
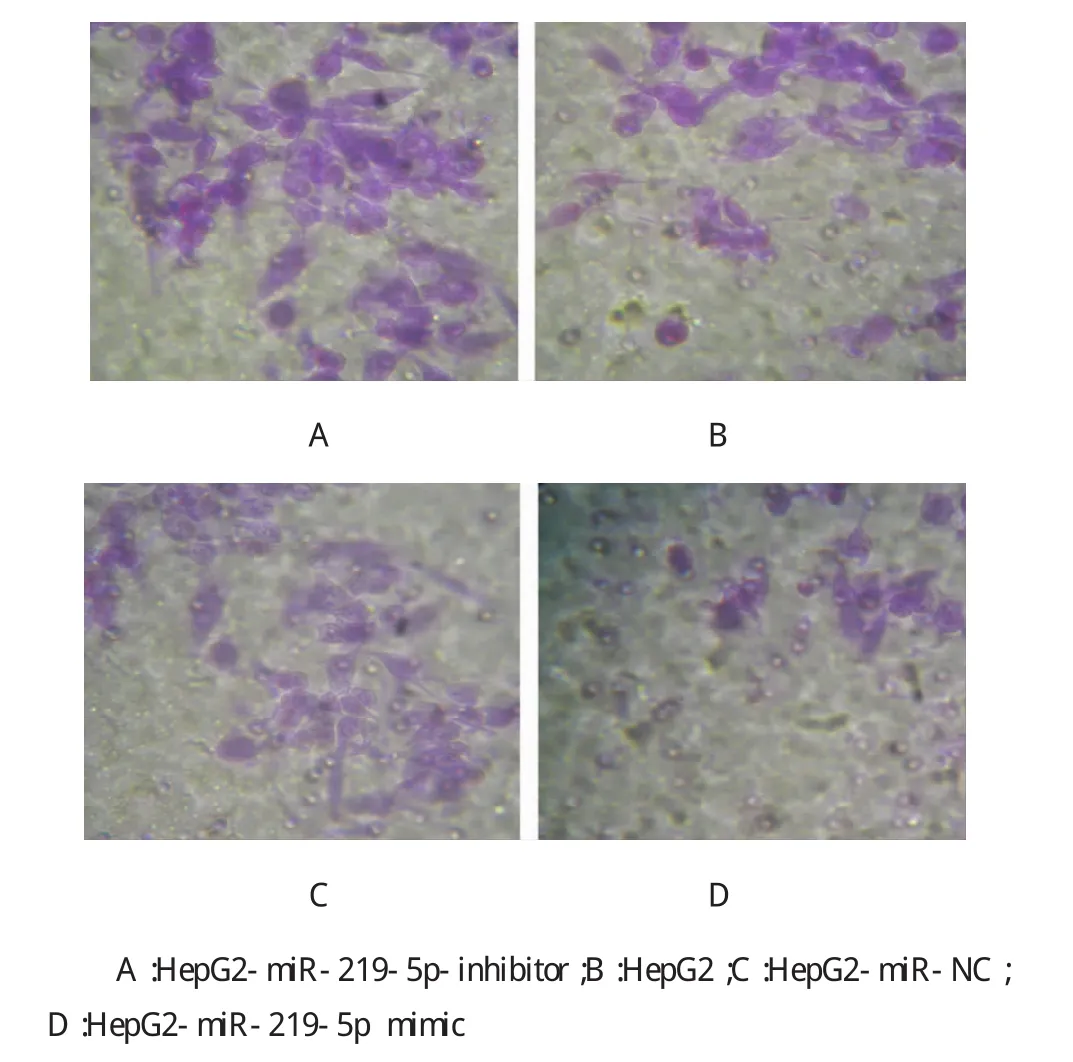
图4 侵袭实验检测不同肝癌细胞系的侵袭能力(×200)
3 讨论
恶性肿瘤最显著的生物学特征是能够发生转移,肿瘤细胞的转移过程是一个多基因、多步骤、多环节的动态变化过程[10]。该过程中涉及到复杂的细胞生物学过程:肿瘤细胞的黏附、侵袭、胞外基质的重塑、肿瘤血管的发生以及机体的免疫状态发生改变等环节[11]。肝细胞癌的转移涉及到许多基因和蛋白分子以及转移相关信号通路的改变[12-14]。该基因和蛋白的调控受许多因素的调控,近年来,有关miRNA调控基因表达与肿瘤侵袭转移的关系研究已成为肿瘤研究当中的热点和重点。
EMT是肿瘤发生转移的主要分子事件之一,是一个复杂的动态发生的过程。其中,细胞骨架的重构是EMT发生的早期事件,主要表现为上皮细胞通过EMT获得了间质细胞的表型[15]。E-cadherin主要功能是维持细胞间紧密连接的完整性,阻止细胞发生侵袭和转移扩散,因此,低表达E-cadherin的细胞往往可以诱导EMT的发生[16]。N-cadherin是细胞间黏连的主要结构性成分,其主要功能是介导细胞间的黏附和迁移[17]。
EMT与多种肿瘤的浸润和转移相关,EMT是肿瘤侵袭转移的一个重要步骤,在该过程当中,许多miRNAs分子参与EMT的调节[18-20]。EMT也在肝癌转移中具有重要作用,然而EMT对肝癌转移的影响是多方面的。宋莹等[21]发现,肝细胞生长因子可能通过诱导Snail的表达促进肝癌细胞EMT的发生,与肝癌发生、发展有关。隋承光等[22]发现,过表达miR-100通过抑制mTOR的表达抑制肝癌细胞的迁移及侵袭能力,主要是通过上调E-cadherin的表达,阻抑EMT过程的发生。
miRNA-mRNA之间的相互作用具有严格的互补结合的特点,通过相关软件预测miRNA-mRNA结合,寻找特定的靶基因具有较好的可行性。本研究首先采用miRwalk在线程序,通过多个生物信息学软件进行联合检测,结合多个软件的检测结果具有“交集”性,则说明预测的可靠性较好[23]。结果发现,miRwalk在线程序对CDH1的靶miRNA进行预测,结果发现10个软件当中有5个以上预测到有20个miRNAs可与CDH1结合,符合条件的miRNAs有8个,其中,miR-219-5p与CDH1结合的热动力学稳定性得分最低,说明miR-219-5p-CDH1之间的结合稳定性最高、特异性最好。
对于生物信息学结果需要进行实验验证,本研究发现,30例肝癌组织中miR-219-5p平均表达水平低于20例癌旁肝组织中;而肝癌组织中E-Cadherin相对表达水平高于癌旁肝组织中。同时在肝癌细胞系中,研究发现在肝癌细胞中miR-219-5p表达下调,导致E-Cadherin表达下调,miR-219-5p可能通过调控E-Cadherin/N-cadherin的表达水平,与肝癌细胞侵袭转移有关。
miR-219-5p是与E-Cadherin(CDH1)是否具有靶向结合,为本研究合成miR-miR-219-5p inhibitor和miR-miR-219-5p mimic以及阴性对照组,分别转染到肝癌细胞,以观察miR-miR-219-5p对CDH1的靶向调控作用。结果发现,HepG2-miR-219-5p mimic细胞株中miR-219-5p水平表达增高,而E-Cadherin表达水平下调,N-cadherin高表达;HepG2-miR-219-5p-inhibitor细胞株中miR-219-5p水平表达下调,而E-Cadherin表达水平上调,N-cadherin低表达。说明转染mimic后,miR-219-5p表达水平增高,下调E-Cadherin而N-cadherin上调;而转染inhibitor后,miR-219-5p表达水平下调,上调E-Cadherin而N-cadherin下调。miR-219-5p可靶向结合E-Cadherin并下调其表达水平,与EMT有关。
E-cadherin能够维持细胞间的紧密连接的完整性,阻止细胞发生侵袭和转移扩散,其表达下调被证明是肿瘤细胞发生侵袭转移的早期事件,低表达E-cadherin细胞往往可以诱导EMT的发生[24]。N-cadherin是细胞间黏连的主要结构性成分,介导细胞间的黏附和迁移,N-cadherin在上皮恶性肿瘤中的表达往往上调,其高表达往往通过调控EMT而促进肿瘤侵袭和转移[25]。近年来研究发现E-cadherin/N-cadherin在许多肿瘤中都存在异常表达,说明E-cadherin/N-cadherin在肿瘤的发生、发展以及侵袭转移中起着重要的作用[26-27]。
本研究发现,转染miR-219-5p mimic后,miR-219-5p表达水平增高,下调E-Cadherin而N-cadherin上调;而转染miR-219-5p inhibitor后,miR-219-5p表达水平下调,上调E-Cadherin而N-cadherin下调。同时通过transwell实验发现,转染miR-219-5p mimic后侵袭细胞计数明显低于HepG2-miR-NC、HepG2;转染miR-219-5p inhibitor后细胞株中侵袭细胞计数明显高于HepG2-miR-NC、HepG2。说明miR-219-5p上调,下调E-Cadherin而N-cadherin表达增加,抑制肝癌细胞侵袭转移;而miR-219-5p下调,上调E-Cadherin而N-cadherin表达减少,抑制肝癌细胞侵袭转移。miR-219-5p靶向E-Cadherin调控EMT在肝癌侵袭转移中有重要作用,针对E-Cadherin的分子靶向治疗在临床肝癌治疗中可能有重要作用。
[1]夏景林.原发性肝癌的规范化诊疗[J].中国临床医生,2012,40(1): 26-30.
[2]吴凡,王黎明,吴健雄,等.巨大肝癌外科治疗的预后影响因素[J].中华肝胆外科杂志,2014,20(5):328-332.
[3]TAN Z M,SUN B C.Effects of antiviral therapy on preventing liver tumorigenesis and hepatocellular carcinoma recurrence[J]. World Journal of Gastroenterology,2013,19(47):8895-8901.
[4]KARAMITOPOULOU E.Role of epithelial-mesenchymal transition in pancreatic ductal adenocarcinoma:is tumor budding the missing link[J].Front Oncol,2013,17(3):221.
[5]FRANCO-CHUAIRE ML,MAGDA CAROLINA S C,CHUAIRENOACK L.Epithelial-mesenchymal transition(EMT):principles and clinical impact in cancer therapy[J].Invest Clin,2013,54(2): 186-205.
[6]GHELDOF A,BERX G.Cadherins and epithelial-to-mesenchymal transition[J].Prog Mol Biol Transl Sci,2013,116:317-336.
[7]IRANTES C,ESPINOSA I,FERRER I,et al.Epithelial-to-mesenchymal transition and stem cells in endometrial cancer[J].Hum Pathol,2013,44(10):1973-1981.
[8]YUN S J,KIM W J.Role of the epithelial-mesenchymal transition in bladder cancer:from prognosis to therapeutic target[J].Korean J Urol,2013,54(10):645-650.
[9]VAN ROOIJE,KAUPPINEN S.Development of microRNA therapeutics is coming of age[J].EMBO Mol Med,2014,6(7): 851-864.
[10]STOCKMANN C,SCHADENDORF D,KLOSE R,et al.The impact of the immune system on tumor:angiogenesis and vascular remodeling[J].Front Oncol,2014,4:69.
[11]TARNOWSKI M,GRYMULA K,TKACZ M,et al.Molecular mechanisms regulating metastasis of cancer cells with special emphasis on rhabdomyosarcoma[J].Postepy Hig Med Dosw(Online),2014,68:258-270.
[12]ZHANG Y,ZHAN Y,ZHANG D,et al.Eupolyphaga sinensis Walker displays inhibition on hepatocellular carcinoma through regulating cellgrowth and metastasis signaling[J].SciRep, 2014,4:5518.
[13]CHEN R,DONG Y,XIE X,et al.Screening candidate metastasis-associated genes in three-dimensional HCC spheroids with different metastasis potential[J].Int J Clin Exp Pathol,2014,7(5): 2527-2535.
[14]SUN Y,SONG G D,SUN N,et al.Slug overexpression induces stemness and promotes hepatocellular carcinoma cell invasion and metastasis[J].Oncol Lett,2014,7(6):1936-1940.
[15]PORTO L P,DOS SANTOS J N,RAMALHO L M,et al.E-cadherin regulators are differentially expressed in the epithelium and stroma of keratocystic odontogenic tumors[J].J Oral Pathol Med, 2016,45(4):302-311.
[16]PIOTROWSKI-DASPIT A S,TIEN J,NELSON C M.Interstitial fluid pressure regulates collective invasion in engineered human breast tumors via Snail,vimentin,and E-cadherin[J].Integr Biol (Camb),2016,8(3):319-331.
[17]WANG M,REN D,GUO W,et al.N-cadherin promotes epithelial-mesenchymal transition and cancer stem cell-like traits via ErbB signaling in prostate cancer cells[J].Int J Oncol,2016, 48(2):595-606.
[18]YAO J,DENG B,ZHENG L,et al.miR-27b is upregulated in cervical carcinogenesis and promotes cell growth and invasion by regulating CDH11 and epithelial-mesenchymal transition[J]. Oncol Rep,2016,35(3):1645-1651.
[19]TANG J,LI Y,WANG J,et al.Molecular mechanisms of microRNAs in regulating epithelial-mesenchymal transitions in human cancers[J].Cancer Lett,2016,371(2):301-313.
[20]ZHAO N,SUN H,SUN B,et al.miR-27a-3p suppresses tumor metastasis and VM by down-regulating VE-cadherin expression and inhibiting EMT:an essential role for Twist-1 in HCC[J].Sci Rep,2016,6:23091.
[21]宋莹,刘浩,尹江,等.肝细胞生长因子诱导人肝癌细胞上皮间质转化[J].中国生物化学与分子生物学报,2015,31(7):716-722.
[22]隋承光,孟凡东,付立业.MicroRNA-100调节mTOR表达对肝癌细胞侵袭转移及上皮间质转化的影响及机制研究[J].现代肿瘤医学,2015,23(1):15-19.
[23]DWEEP H,GRETZN,STICHTC.miRWalk database for miRNA-target interactions[J].Methods Mol Biol,2014,1182: 289-305.
[24]ZHAO P,GUO S,TU Z,et al.Grhl3 induces human epithelial tumor cell migration and invasion via downregulation of E-cadherin[J].Acta Biochim Biophys Sin(Shanghai),2016,48(3):266-274.
[25]MARTÍNEZ-RAMÍREZ AS,GARAY E,GARCÍA-CARRANCÁ A,et al.The P2RY2 receptor induces carcinoma cell migration and EMT through cross-talk with epidermal growth factor receptor[J].J Cell Biochem,2016,117(4):1016-1026.
[26]KAUSHIK N K,KAUSHIK N,YOO K C,et al.Low doses of PEG-coated gold nanoparticles sensitize solid tumors to cold plasma by blocking the PI3K/AKT-driven signaling axis to suppress cellular transformation by inhibiting growth and EMT[J]. Biomaterials,2016,87:118-130.
[27]YU A Q,DING Y,LI C L,et al.TALEN-induced disruption of Nanog expression results in reduced proliferation,invasiveness and migration,increased chemosensitivity and reversal of EMT in HepG2 cells[J].Oncol Rep,2016,35(3):1657-1663.
(张蕾编辑)
MicroRNA-219-5p regulates EMT and inhibits invasion and metastasis of hepatoma cells by targeting E-cadherin
Li-hui Zhu1,Yong Luo2,Wen-qiu Liao1,Li Zhang1,Guo-qing Li1
(1.Department of Gastroenterology,2.Intensive Care Unit,the Second Affiliated Hospital of Nanhua University,Hengyang,Hunan 421001,China)
Objective To investigate the molecular mechanism of microRNA-219-5p(miR-219-5p)targeting E-cadherin(CDH1)in the regulation of epithelial mesenchymal trasition(EMT),thus inhibiting the invasion and metastasis of hepatoma cells.Methods Bioinformatics methods were used to determine miRNAs with the best specificity and stability of binding to E-cadherin.The correlation between E-cadherin expression detected by Western blot,and miR-219-5p level by qRT-PCR in 30 hepatoma tissues and 20 normal tissues,respectively,was analyzed. miR-219-5p level was detected by qRT-PCR.E-cadherin and N-cadherin levels were detected by Western blot in high and low metastatic hepatoma cell lines.miR-219-5p mimic,inhibitor and negative control were transfected into HepG2 cell line by Lipofectamine 2000,miR-219-5p expression was detected by qRT-PCR and the expressions of E-cadherin and N-cadherin were detected by Western blot.And the effects of miR-219-5p expression change oninvasive and metastatic abilities were also tested by the transwell method.Results Bioinformatics methods showed that miR-219-5p was the best target miRNA with the highest specificity and stability for binding to E-cadherin. miR-219-5p had low expression and E-cadherin had high expression in the HCC,while miR-219-5p had high expression and E-cadherin had low expression in the paracancerous tissues.There were high expression of miR-219-5p,low expression of E-cadherin and high expression of N-cadherin in highly metastatic cell line MHCC97-H. There were low expression of miR-219-5p,high expression of E-cadherin and low expression of N-cadherin in low metastatic cell line MHCC97-L(P<0.05).Increased miR-219-5p caused E-cadherin down-regulation and N-cadherin up-regulation.miR-219-5p down-regulation caused E-cadherin up-regulation and N-cadherin down-regulation in HepG2-miR-219-5p-inhibitor cell line(P<0.05).The invasion cell count was(24±3)/HP in the HepG2-miR-219-5p mimic cells which was significantly lower than that in the control group(P<0.05). Conclusions miRNA-219-5p can specifically bind to E-Cadherin and regulate the EMT signaling pathway,thus suppress the invasion and metastasis of hepatoma cells.
miRNA;hepatoma;invasion;metastasis;E-cadherin;EMT
R 573.2
A
10.3969/j.issn.1005-8982.2016.18.005
1005-8982(2016)18-0022-08
2016-04-18
罗勇,E-mail:fordluo@qq.com
