聚丙烯酸盐—丙烯酰胺水凝胶的制备及对重金属离子吸附性能的研究
2016-10-21刘宛宜杨璐泽于萌刘淼
刘宛宜 杨璐泽 于萌 刘淼


摘要:以丙烯酸(AA)、丙烯酰胺(AM)为单体,K2S2O8为引发剂,N,N′亚甲基双丙烯酰胺为交联剂,采用水溶液聚合法合成P(AAAM)水凝胶,通过正交实验优化了P(AAAM)水凝胶的制备工艺。对制备的P(AAAM)水凝胶进行了SEM和XPS分析,探讨了P(AAAM)水凝胶对Cu2+、Pb2+、Zn2+和Cd2+的吸附等温线和吸附动力学行为,研究了P(AAAM)水凝胶的粒径、吸附温度、pH值和重金属离子的初始浓度对P(AAAM)水凝胶吸附性能的影响。实验结果表明,所制备的P(AAAM)水凝胶是一种具有三维网络结构的高分子材料,其表面的氨基和羧基残基能够与重金属离子发生螯合反应。减小P(AAAM)水凝胶粒径、增大溶液pH值、升高吸附环境温度均有利于吸附反应的进行。粒径为0.097~0.15 mm的P(AAAM)水凝胶粉末,在35℃、pH=5的条件下进行吸附等温线实验,得到水凝胶对重金属Cu2+, Pb2+, Zn2+和Cd2+的理论最大吸附量分别为186, 588, 208和403 mg/g。P(AAAM)水凝胶对重金属离子的吸附符合准二级动力学模型(R2>0.98),吸附等温线符合Langmuir吸附等温线(R2>0.95)。干扰离子实验和理论模拟均证明P(AAAM)水凝胶对Pb2+具有良好的吸附性。
关键词 :丙烯酸盐; 丙烯酰胺; 水凝胶; 重金属离子; 吸附
1 引 言
随着现代工业的快速发展,环境问题日益严重,其中重金属离子污染给动植物的生长、繁殖以及人类的身体健康和生存环境带来了严重的威胁[1]。因此,建立重金属离子废水的高效、环保、低成本的处理方法是环保领域的一项重要课题。目前,除吸附法外,常用于处理重金属离子废水的方法主要有膜分离、浮选、化学沉淀、离子交换、氧化还原等[2,3]。但以上技术常存在膜通量有限、成本高、设备占地面积大、污泥产生量大等问题,并易造成二次污染。采用吸附法处理重金属废水,吸附材料主要集中在沸石和硅藻土等无机吸附剂、功能化的多孔材料、纤维和树脂等有机吸附剂及活性炭和草木灰等碳质类吸附剂[4], 但实验成本较高、分离困难、反应速度慢、对极高或极低浓度环境水样吸附能力有限 [5,6]。
水凝胶作为具有三维网络结构的新型高分子材料,因其能够感知和响应环境变化的刺激,具有良好的水渗透性和生物相容及降解性,且可以根据需要引入不同螯合基团,已被广泛应用于农林、园艺,工业、农业,生物医学、药学等领域[7~9]。作为一种新型环境友好型吸附材料,水凝胶为解决水体中重金属离子污染问题提供了新途径。
作为一种高效吸水性凝胶树脂,丙烯酸丙烯酰胺类水凝胶的制备方法及吸附性质受到了广泛关注,但外界环境对其吸附性质的影响尚缺乏系统研究。温度、酸碱度、离子强度等外界条件均能够影响水凝胶对重金属离子的吸附量[10]。本研究采用水溶液聚合法合成P(AAAM)水凝胶,通过正交实验优化了P(AAAM)水凝胶的制备工艺,将氨基和羧基成功引入到水凝胶中,并系统考察了P(AAAM)水凝胶粒径、吸附温度、pH值、干扰离子对重金属离子吸附量的影响,以及水凝胶回收再利用价值。结果表明,制得的P(AAAM)水凝胶对重金属离子Pb2+具有优异的吸附特性; 吸附速度快,在1 h内即可达到平衡吸附;因具有良好的溶胀效果,在简单条件下即可得到良好的分离;3次循环解吸再生后其对重金属离子仍保持一定的吸附能力,可降低废水处理成本。
2 实验部分
2.1 仪器与试剂
AAS700型石墨炉原子吸收分光光度计(美国Perkin Elmer公司);JOES JSM6700F型场发射扫描电子显微镜(日本JEOL公司);ESCALAB 250 X射线电子能谱(美国Thermo公司)。
丙烯酸(AA)、丙烯酰胺(AM)、乙二胺四乙酸二钠(C10H14N2Na2O8·H2O)、K2S2O8、PbNO3、Cu(NO3)2·3H2O、Zn(NO3)2·6H2O、Cd(NO3)2·4H2O、NaNO3、Ca(NO3)2·4H2O、Mg(NO3)2·6H2O(分析纯,国药集团化学试剂有限公司);N,N′亚甲基双丙烯酰胺(MBA,分析纯,阿拉丁上海晶纯生化科技股份有限公司);实验用水为超纯水(≥18.2 MΩ·cm,ELGA CLXXDM2)。
2.2 P(AAAM)水凝胶的制备
在三口烧瓶中依次加入适量的丙烯酸(AA)、NaOH和丙烯酰胺(AM),溶于一定量的蒸馏水中,加入交联剂N,N′亚甲基双丙烯酰胺,在室温下磁力搅拌10 min,通入N2以排尽烧瓶中的氧气,加入引发剂K2S2O8后密封,在50℃恒温水浴聚合反应8 h。将反应得到的产物以蒸馏水洗涤、浸泡和过滤,重复多次,以去除非凝胶部分,在70℃恒温干燥至恒重,粉碎,筛分,备用。
2.3 P(AAAM)水凝胶的表征
采用JOES JSM6700F型场发射扫描电子显微镜表征所制备P(AAAM)水凝胶的表面形貌;以ESCALAB 250型X射线电子能谱仪表征所制备P(AAAM)水凝胶吸附重金属离子前后表面元素组成变化。
2.4 丙烯酸和丙烯酰胺共聚正交实验
本实验采用水溶液聚合法合成P(AAAM)水凝胶,而聚合反应受单体比例(摩尔比)、中和度、引发剂和交联剂用量(与单体质量百分比)等多种因素影响,因此以正交实验法设计凝胶制备方案,以期得到具有较好吸附能力的水凝胶。正交实验因素及水平表如表1所示。
2.5 P(AAAM)水凝胶的吸附性能
2.5.1 P(AAAM)水凝胶的吸附能力 称取0.1 g干燥筛分后的P(AAAM)水凝胶粉末于100 mL锥形瓶中,加入50 mL、1 g/L重金屬溶液(含有Cu2+, Pb2+, Zn2+和Cd2+),在25℃以200 r/min恒温振荡24 h[3,5,11]。吸附结束后,静止,取上清液,稀释,以原子吸收分光光度计测定溶液中重金属离子的含量,并计算P(AAAM)水凝胶的平衡吸附量。平衡吸附量计算公式如下[12]:
式中, Qe为吸附达平衡时P(AAAM)水凝胶的吸附量(mg/g); V为加入重金属离子溶液的体积(L); C0为吸附前溶液中重金属离子的初始浓度(mg/L); Ce为吸附平衡后溶液中重金属离子的浓度(mg/L); m为称取P(AAAM)水凝胶的质量(g)。
吸附条件对吸附性能的影响以单一变量法进行实验,其中, P(AAAM)水凝胶粒径研究分级范围为0.300~0.450 mm, 0.200~0.300 mm, 0.150~0.200 mm, 0.125~0.15 mm, 0.105~0.125 mm, 0.097~0.105 mm, 0.088~0.097 mm和0.088 mm以下;重金属离子溶液pH值的研究范围为1~7;吸附温度的研究范围为15~50℃;干扰离子实验中添加与重金属离子质量浓度比为1∶1和2∶1干扰离子进行实验。吸附性能实验全程做空白和平行实验。
2.5.2 P(AAAM)水凝胶的吸附行为 吸附动力学:取4个系列100 mL锥形瓶,分别加入0.1 g P(AAAM)水凝胶粉末,50 mL 1 g/L重金属离子溶液(含Cu2+, Pb2+, Zn2+和Cd2+),在25℃以200 r/min恒温振荡反应不同时间(5, 10, 15, 20, 25, 30, 35, 40, 50和60 min)。
吸附等温线及热力学参数:取4个系列100 mL锥形瓶,分别加入0.1 g P(AAAM)水凝胶粉末,50 mL不同初始浓度(1, 5, 25, 50, 75, 100, 200, 400, 600, 800, 1000和2000 mg/L)的重金属离子溶液(Cu2+, Pb2+, Zn2+和Cd2+),分别在25℃, 35℃, 45℃,200 r/min恒温振荡24 h。
3 结果与讨论
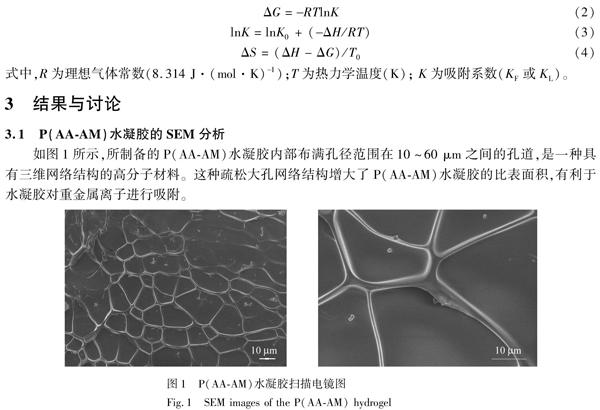
3.1 P(AAAM)水凝胶的SEM分析
如图1所示,所制备的P(AAAM)水凝胶内部布满孔径范围在10~60 μm之间的孔道,是一种具有三维网络结构的高分子材料。这种疏松大孔网络结构增大了P(AAAM)水凝胶的比表面积,有利于水凝胶对重金属离子进行吸附。
3.2 丙烯酸和丙烯酰胺共聚正交实验结果
以丙烯酸与丙烯酰胺的摩尔比(A)、丙烯酸的中和度(B)、引发剂用量(C)和交联剂用量(D)4种因素为考察对象,设计正交实验方案(表1),研究其对重金属离子吸附量的影响。
结果表明, P(AAAM)水凝胶对吸附Cu2+的最优水平为:C3A3B3D3;对Pb2+的最优水平为:B3A1D1C3;对Zn2+的最优水平为:B3C3A1D3;对Cd2+的最优水平为: A1D3C3B3。
根据显著性和极差结果分析,4种因素对P(AAAM)水凝胶吸附重金属离子量的影响较显著,而影响大小的顺序不同,但以P(AAAM)水凝胶对重金属离子吸附量的角度考虑,4种因素对吸附重金属离子的最优水平基本相同。因此,综合考虑选择A1B3C3D3为最优水平作为制备P(AAAM)水凝胶的最佳配比方案,即丙烯酸与丙烯酰胺的摩尔比为1∶0.3、丙烯酸的中和度为80%、引发剂用量为2.0%、交联剂用量为0.7%。
3.3 不同因素对P(AAAM)水凝胶吸附重金属离子效果的影响
3.3.1 P(AAAM)水凝胶粒径对吸附效果的影响 实验表明,P(AAAM)水凝胶粒径对重金属离子吸附量的影响并不十分显著,但随着粒径从0.450 mm减小到0.088 mm时,P(AAAM)水凝胶的吸附量不断增加,当粒径小于0.088 mm时,P(AAAM)水凝胶的吸附量开始出现下降的趋势。这是因为,当P(AAAM)水凝胶质量相同时,随着粒径减小,P(AAAM)的表面积增大,因此会使水凝胶暴露更多的活性吸附点位[14];但当粒径进一步减小时,水凝胶颗粒之间会发生一定程度的聚集,从而削弱了重金属离子与吸附颗粒之间的结合能力[15]。因此考虑到吸附效果及对P(AAAM)水凝胶的充分利用,本实验选择0.097~0.150 mm水凝胶粉末进行研究。
3.3.2 pH值对吸附效果的影响 P(AAAM)水凝胶在不同溶液pH值条件下对重金属离子(Cu2+, Pb2+, Zn2+, Cd2+)吸附效果见图2。当溶液pH值由1增加到4时,4种重金属离子的吸附量均呈现出迅速增大的趋势。P(AAAM)水凝胶对Pb2+和Cd2+的吸附量增大趋势尤为显著,分别由28.0和6.37 mg/g增大到447.43和301.2 mg/g。当溶液pH值由4增大到6时(Pb2+的pH值增大到5),4种离子的吸附量逐渐达到饱和;而当溶液pH>6时,吸附量开始下降。这是因为,当pH值较低时,溶液中过多的H+使P(AAAM)水凝胶中的氨基和羧基质子化生成NH+3和COOH,从而削弱了其与重金属离子的螯合能力,同时H+也会与重金属离子发生竞争吸附,而占据了更多吸附点位;当pH值逐渐增大时,水凝胶上NH+3和COOH去质子化,大量的NH2和COO 与重金属离子发生螯合作用,使重金属离子的吸附量大幅上升[16];但当pH值过大时,水溶液中的OH易于重金属离子发生水解作用,形成的羟基配合物溶解在水中或形成氢氧化物沉淀,因此降低了重金属离子的吸附量[17]。
3.3.3 温度对吸附效果的影响
不同反应环境温度对P(AAAM)水凝胶对重金属离子吸附效果结果表明,随着吸附温度从15℃上升到50℃,4种重金属离子的吸附量均明显增大,Zn2+吸附量增大得最为明显,从150.05 mg/g增大到250.4 mg/g。此现象提示P(AAAM)水凝胶对金属离子的吸附反应可能为吸热反应,升高温度有利于吸附反应的进行。
3.3.4 干扰离子对吸附效果的影响
实际环境污染水样中,有害重金属离子会与多种阴阳离子共存,其中高浓度的盐离子可能会降低凝胶吸附剂对重金属离子的吸附效果。为模拟实际环境水样,向重金属离子溶液中添加与重金属离子质量浓度比为1∶1和2∶1的钠盐、钙盐和镁盐,以研究其对P(AAAM)水凝胶吸附效果的影响。不同干扰离子对P(AAAM)水凝胶吸附重金属离子效果的影响如表2所示。溶液中干扰离子的存在使P(AAAM)水凝膠对重金属离子的吸附效率有所降低,这可能由于干扰离子的存在与重金属离子共同竞争P(AAAM)水凝胶表面的吸附点位,使有效重金属离子浓度降低,导致水凝胶与重金属离子的配位能力下降从而使吸附量降低。但干扰离子对Pb2+的吸附量基本无影响,说明P(AAAM)水凝胶对Pb2+具有良好的选择吸附性。
3.4 P(AAAM)水凝胶对重金属离子的吸附动力学
在不同时间(5, 10, 15, 20, 25, 30, 35, 40, 50和60 min)内,P(AAAM)水凝胶对初始浓度为1 g/L的重金属离子(Cu2+, Pb2+, Zn2+, Cd2+)的吸附效果如图3所示。在吸附反应的初期(0~5 min),P(AAAM)水凝胶对重金属离子的吸附量迅速增加,可达到吸附总量的70%~80%;吸附25 min时,P(AAAM)水凝胶对重金属离子的吸附过程进入平缓期,此时约可达到吸附总量的94%;吸附30 min后,P(AAAM)水凝胶对重金属离子的吸附基本达到平衡。此现象说明P(AAAM)水凝胶能够快速吸附重金属离子[3,10,18]。
式中, Ce, Qe, Qm分别为重金属离子溶液初始的平衡浓度(mg/L)、吸附达平衡时P(AAAM)水凝胶对重金属离子的吸附量(mg/g)、P(AAAM)水凝胶对重金属离子的饱和吸附量(mg/g); KF和KL分别为Freundlich, Langmuir平衡常数; n为浓度指数。
对P(AAAM)水凝胶吸附4种重金属离子的初始浓度和平衡吸附量进行Freundlich, Langmuir吸附等温模型拟合,结果如图6和表4所示。Freundlich和Langmuir吸附等温模型均可以较好拟合P(AAAM)水凝胶对4种重金属离子的吸附过程,拟合方程的相关系数RF, RL均大于0.95;对于Cu2+, Zn2+和Cd2+,Langmuir吸附等温式的拟合结果更优,RL均大于0.98;但对于Pb2+,Freundlich吸附等温式模型拟合得到的RF(0.995)大于RL(0.986)。这说明P(AAAM)水凝胶对Cu2+, Zn2+和Cd2+的吸附过程更符合单分子层吸附[23],而对P(AAAM)水凝胶对Pb2+的吸附过程并不局限于均匀的单分子层吸附,可能存在不均匀的多分子层吸附[24]。4种重金属离子的n均大于1,说明吸附过程易于进行[25];其中n(Pb2+)和Qm(Pb2+)分别为2.615和587.99 mg/g均大于其它3种离子的n和Qm值,说明此P(AAAM)水凝胶更易吸附Pb2+。与同类丙烯酸类水凝胶相比,优化制备的P(AAAM)水凝胶对重金属Pb2+表现出尤为突出的吸附效果,吸附量可达5~19倍[3,12,18,20],说明此凝胶对重金属Pb2+具有良好的选择吸附性。
3.5.2 热力学参数分析
分析P(AAAM)水凝胶对重金属离子的吸附等温线发现,Langmuir吸附等温式对Cu2+, Zn2+和Cd2+的拟合结果更优, 因此Freundlich吸附等温式对Pb2+的拟合结果更优。故选择KL作为Cu2+, Zn2+和Cd2+的吸附系数,KF作为Pb2+的吸附系数。吸附反应的ΔG, ΔH, ΔS见表5,ΔH均为正值,ΔG均为负值,说明P(AAAM)水凝胶对4种重金属离子的吸附反应均为自发的吸热反应[26];且随着温度升高,ΔG逐渐减小,说明升高温度有利于吸附反应的进行,与前文温度因素实验的结论一致。
3.6 P(AAAM)的吸附再生
以0.1 mol/L EDTA2Na对吸附重金属离子后的水凝胶P(AAAM)Cu, P(AAAM)Pb, P(AAAM)Zn, P(AAAM)Cd进行解析再生,循环3次。实验结果表明,0.1 mol/L EDTA2Na对P(AAAM)Cu的脱附效率分别为98.0%, 92.0%和83.0%,对P(AAAM)Pb的脱附效率分别为96.5%, 88.3%和80.1%,对P(AAAM)Zn的脱附效率分别为95.4%, 87.4%, 81.3%,对P(AAAM)Cd的脫附效率分别为96.8%, 89.1%, 82.4%。经过反复3次的吸附再生后, P(AAAM)的脱附率仍大于80%,且对重金属仍具有一定的吸附效果,说明P(AAAM)可在一定程度上进行回收再利用。
3.7 P(AAAM)水凝胶的XPS分析
为研究P(AAAM)水凝胶对重金属离子的吸附机制,分别对水凝胶P(AAAM)和吸附重金属离子后的水凝胶P(AAAM)Cu, P(AAAM)Pb, P(AAAM)Zn, P(AAAM)Cd进行电子能谱分析。其宏观XPS光谱图显示,除检测出P(AAAM)中的C1s(285 eV), N1s(399.7 eV), O1s(531.6 eV)的特征峰外,还在吸附重金属离子后的水凝胶P(AAAM)Cu, P(AAAM)Pb, P(AAAM)Zn, P(AAAM)Cd分别检测出Cu2p(934.6 eV), Pb4f(138.8 eV), Zn2p(1022.4 eV)和Cd3d(406.0 eV)的特征峰,说明重金属离子已经成功吸附到P(AAAM)水凝胶的表面。另外,P(AAAM)水凝胶吸附重金属离子后,P(AAAM)中的N1s和O1s特征峰从399.7和531.6 eV处分别位移至400.2和532.1 eV(P(AAAM)Cu), 399.8和531.7 eV (P(AAAM)Pb), 399.96 和532.1 eV(P(AAAM)Zn), 400.1和532.14 eV (P(AAAM)Cd)处,说明重金属离子是通过与P(AAAM)中的羧基和氨基残基的相互作用而吸附到P(AAAM)水凝胶中。
4 结 论
以AA、AM为单体,通过水溶液聚合法合成P(AAAM)水凝胶,由正交实验得到对重金属离子具有高效吸附效果的水凝胶制备工艺。所合成的P(AAAM)水凝胶具有三维网状结构并能够通过羧基和氨基残基与重金属离子相互作用。P(AAAM)水凝胶对重金属离子的吸附符合准二级动力学模型(R2>0.98);吸附等温线复合Langmuir吸附等温线(R2>0.95)。在实验范围内,减小P(AAAM)水凝胶粒径、增大溶液pH值、升高吸附环境温度均有利于吸附反应的进行。以普遍投料比例为前提,保持水凝胶的质量(0.1 g)不变,P(AAAM)水凝胶对Pb2+的吸附效果尤为突出,最大吸附量Qm可到达588 mg/g,并具有良好的选择吸附性。3次循环解吸再生后P(AAAM)对重金属离子仍具有一定的吸附能力,降低了废水处理的成本。研究成果表明P(AAAM)水凝胶对污水中重金属离子特别是Pb2+的分离与清除有潜在的应用价值。
References
1 Li G L, Zhao S S, Liu J Y, Jiang G B. J. Hazard. Mater., 2011, 192(1): 277-283
2 Cui Y, Ge Q C, Liu X Y, Chun T S. J. Membrane Sci., 2014, 467, 188-194
3 Hua R, Li Z K. Chem. Engineer. J., 2014, 249: 189-200
4 ZHANG CaiHua, LI GuiJuan, WANG JiaHai. Chinese J. Anal.Chem., 2014, 42(4): 607-615
张财华, 李桂娟, 王家海. 分析化学, 2014, 42(4): 607-615
5 Luo S L, Li X J, Chen L, Chen J L, Wan Y, Liu C B. Chem. Engineer. J., 2014, 239: 312-321
6 Javadian H. J. Ind. Eng. Chem., 2014, 20(6): 4344-4352
7 Dragan E S. Chem. Engineer. J., 2014, 243, 572-590
8 Adewunmi A A, Ismail S, Sultan A S. J. Appl. Polym. Sci., 2015, 132(28): 42110
9 Abou ElFadl F I, Abd ElMohdy H L. Polymer Engineer. Sci., 2015, 55(6): 1441-1449
10 SaberSamandari S, SaberSamandari S, Nezafati N, Yahya K. J. Environ. Manage., 2014, 146: 481-490
11 Irani M, Ismail H, Ahmad Z, Fan M H. J. Environ. Sci., 2015, 27: 9-20
12 Liu P, Jiang L P, Zhu L X, Wang A Q. Ind. Eng. Chem. Res., 2014, 53(11): 4277-4285
13 Wang J J, Liu F. Polymer Bull., 2013, 70(4): 1415-1430
14 Ding C M, Gao X F, Han Y L, Ma X S, Wang J W, Liu S B, Zhang K. J. Energy Chem., 2015, 24(1): 45-53
15 GUO DouDou, PANG Hao, LIU HaiLu, XU LiLi, ZHENG JingXin, LIAO Bing. Chemistry and Industry of Forest Products, 2014, 34(1): 8-12
郭逗逗, 庞 浩, 刘海露, 徐莉莉, 郑景新, 廖 兵. 林产化学与工业, 2014, 34(1): 8-12
16 Moradi O, Aghaie M, Zare K, Monajjemi M, Aghaie H. J. Hazard. Mater., 2009, 170: 673-679
17 Wang W, Ma Y, Li A M, Zhou Q, Zhou W W, Jin J. J. Hazard. Mater., 2015, 294: 158-167
18 Puspitasari T, Oktaviani, Pangerteni D S, Nurfilah E, Darwis D. Macromol. Symposia, 2015, 353(1): 168-177
19 ZHANG Juan, DENG HuiPing, YABUTANI Tomoki, YASUZAWA Mikito. Environmental Science, 2011, 32(11): 3348-3356
張 娟, 邓慧萍, 薮谷智規, 安澤幹人. 环境科学, 2011, 32(11): 3348-3356
20 Jiang L P, Liu P. J. Colloid Interf. Sci., 2014, 426(15): 64-71
21 Chen A B, Yu Y F, Zhang Y, Xing T T, Wang Y Y, Zhang Y X, Zhang J. J. Hazard. Mater., 2014, 279: 280-288
22 Li R J, Liu L F, Yang F L. J. Hazard. Mater., 2014, 280: 20-30
23 Liu B J, Lv X, Meng X G, Yu G L, Wang D F. Chem. Engineer. J., 2013, 220: 412-419
24 OrozcoGuareo E, SantiagoGutiérrez F, MornQuiroz J L, HernandezOlmos S L, Soto V, de la Cruz W, Manríquez R, GomezSalazar S. J. Colloid Interf. Sci., 2010, 349, 583-593
25 Evren M, Acar I, Gülü K, Gülü G. Can. J. Chem. Eng., 2014, 92(1): 52-59
26 Bhattacharyya R, Ray S K, Mandal B. J. Ind. Eng. Chem., 2013, 19: 1191-1203
Abstract By using potassium sulfate and N,N′methylenebisacrylamide as initiator and acrosslinker, the poly(acrylateacrylamide) (P(AAAM)) hydrogel was optimized through orthogonal test and prepared by aqueous polymerization of sodium acrylate and acrylamide. The results of SEM and XPS experiments indicated that the P(AAAM) hydrogel had threedimensional network structure with carboxyl and acylamino residues. The carboxyl and acylamino residues could efficiently interact with heavy metal ions to form chelates. The adsorption isotherm and kinetic behavior of Cu2+, Pb2+, Zn2+ and Cd2+ on P(AAAM) hydrogel were discussed. And the effects of particle size, the temperature, the pH value and the initial concentration of metal ions in solution on the adsorption capacity were investigated. The results showed that the particle size of the P(AAAM) hydrogel, the pH value and the adsorption temperature of the solution could influence the adsorption reaction. The maximum absorption amounts of 0.097-0.15 mm P(AAAM) hydrogel to Cu2+, Pb2+, Zn2+ and Cd2+ were 186, 588, 208 and 403 mg/g, respectively under the optimal conditions such as 35℃ and pH 5. The adsorption kinetic followed the pseudosecondorder kinetic mode (R2>0.98) and the adsorption isotherm fit the Langmuir equation (R2>0.95).The interfering ions experiment showed that the P(AAAM) hydrogel had good selective adsorption to Pb2+.
Keywords Acrylate; Acrylamide; Hydrogel; Heavy metal ions; Adsorption behavior
