大豆PM1蛋白对脂质体及兔红细胞的稳定作用
2016-10-21陈丽伊刘国宝郑易之
陈丽伊,刘国宝,郑易之
深圳大学生命与海洋科学学院,深圳市微生物基因工程重点实验室, 广东深圳518060
【生物工程 / Bioengineering】

大豆PM1蛋白对脂质体及兔红细胞的稳定作用
陈丽伊,刘国宝,郑易之
深圳大学生命与海洋科学学院,深圳市微生物基因工程重点实验室, 广东深圳518060
利用浊度法、粒径法和相差显微镜技术研究反复冻融条件下大豆PM1蛋白(属于第4组胚胎晚期富集蛋白)对1-棕榈酰基-2-油酰基卵磷脂(1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine, POPC)脂质体的保护作用.结果发现,与未经冻融处理的POPC样品相比,经冻融胁迫POPC脂质体浊度升高、粒径增大,在GmPM1存在时,经冻融的POPC脂质体浊度和粒径增大程度明显降低,脂质体聚集物明显减少.在冻融条件下,GmPM1蛋白对兔血红细胞有明显保护作用.在低温胁迫中,GmPM1可能通过稳定细胞膜的磷脂起到保护细胞膜的作用.
胚胎晚期富集蛋白;PM1蛋白;生物膜;脂质体;冷冻保护;浊度法;粒径法;兔红细胞
胚胎晚期富集蛋白(late embryogenesis abundant protein,LEA)是在种子胚胎发育晚期大量表达并积累的蛋白质,在植物抵抗干旱、高盐、低温及重金属等非生物胁迫过程中发挥重要保护功能[1-3].LEA 蛋白大多数为10~30 kD(1 D=1 u)的低相对分子质量蛋白,多由碱性和亲水性氨基酸组成,并富含甘氨酸及小分子量氨基酸,如丙氨酸和丝氨酸.LEA蛋白通常缺少半胱氨酸和色氨酸,疏水氨基酸含量也较低.该蛋白质还具有高度亲水性和热稳定性[3].LEA蛋白通常可分为7组[4].目前,对前3组LEA蛋白的保护作用已进行了较多研究,而对第4组LEA蛋白(LEA4蛋白)的相关研究较少,其保护作用的分子机理仍不清楚.LEA4蛋白有以下结构特征:没有重复的特征性基序;N端较保守,具有可形成高比例兼性α-螺旋的倾向;C端多呈无规则卷曲[5].文献[6-7]研究显示,当干旱胁迫时,拟南芥LEA4基因的mRNA表达量将大幅度增加.拟南芥AtLEA4-5基因过表达后,植株抗旱能力明显增强;而在拟南芥基因组中敲除或缺失AtLEA4-5基因后,植株内缺少相应的LEA4蛋白,同时也表现出对水分胁迫的敏感性.可见,LEA4蛋白在植物抵抗非生物胁迫时确实发挥着重要作用[7].
目前,关于LEA4蛋白对植物耐受胁迫保护作用机制的研究还不多.一些体外实验证明,LEA4蛋白可能对生物大分子具有多重保护作用.最近,Cuevas-Velazquez等[8]证明,冻融下拟南芥AtLEA4-2和AtLEA4-5蛋白具有保护乳酸脱氢酶(lactate dehydrogenase,LDH)活性的能力.Shih等[9]还证明,在干燥条件下大豆GmPM1和GmPM28蛋白(均属于LEA4)通过与脂质分子的互作,降低磷脂的相变温度,由此推测,这2个大豆LEA4蛋白对细胞膜具有保护作用.在本课题组前期工作中,证明了大豆GmPM1和GmPM9蛋白(属于LEA4)可结合Fe3+,并可清除羟基自由基,因此推测这2个LEA4蛋白可减轻重金属对细胞的毒害、缓解由干旱和高盐胁迫引起的膜过氧化损伤[10].然而,目前尚缺少LEA4蛋白是否具有对细胞膜保护功能的直接证据.
细胞膜的化学成分有40%的蛋白质和50%的脂类, 后者以磷脂为主.脂质体是利用磷脂分子在水相中形成稳定脂双层膜的趋势制备的人工膜.液体里的悬浮脂质体固体数量可通过浊度进行描述.溶液中脂质体固体颗粒大小(即粒径)可利用光散射技术进行测量.相差显微镜术可直观反映脂质体的形态学变化.本研究所用大豆PM1蛋白(Genbank登录号为M80666)属LEA4蛋白,由173氨基酸残基组成.本研究首先制备了1-棕榈酰基-2-油酰基卵磷脂(1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine, POPC)脂质体,然后通过浊度法、粒径测定和光学显微镜术研究了经反复冻融的脂质体的改变,以及冻融条件下大豆PM1蛋白对脂质体的保护作用,并探讨了大豆PM1蛋白作为抗冻保护蛋白在红细胞保存上的应用前景.
1 材料与方法
1.1菌株和载体
大肠杆菌重组质粒pET28a-GmPM1和大肠杆菌菌株BL21star由本实验室保存.
1.2方法
1.2.1脂质体制备及冻融处理
脂质体制备参照Clarke等[11]的方法,即称取100 mg的POPC(Avanti Polar Lipids,Inc.),用500 μL氯仿溶解,氮气吹干,随后用3 mL磷酸盐缓冲液(10 mmol/L,pH=7.4)重新溶解.溶解的POPC用装有100 nm聚碳酸酯膜的挤压机(Avanti Polar Lipids,Inc.)反复挤压,制备成直径为100 nm的脂质体.用磷脂定量试剂盒(Wako Pure Chemical Industries,Ltd)定量后,再用磷酸盐缓冲液(10 mmol/L,pH=7.4)稀释至20 mg/mL.
将本实验室保存的重组质粒pET28a-GmPM1转化BL21star菌株,利用异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside, IPTG)诱导带有6个组氨酸(His)标签的重组蛋白His-PM1表达,再利用镍离子亲和层析柱纯化蛋白.经凝血酶切去6×His标签,采用凝胶过滤层析法除去凝血酶后得到目的蛋白.取100 μL脂质体加入等体积磷酸盐缓冲液或蛋白溶液(磷酸盐缓冲液溶解).所用PM1蛋白的质量浓度分别为0.04、0.10、0.40和0.80 mg/mL[12].选取与PM1相对分子质量相近的奇异果甜蛋白(约20 kD)作为阴性对照[12],质量浓度为0.80 mg/mL.实验设对照组和实验组.对照组置于28 ℃孵育30 min,实验组在28 ℃孵育30 min后,置于-80 ℃冷冻30 min,28 ℃溶解30 min,反复冻融3次.实验共重复3次.
1.2.2浊度法检测溶液中脂质体数量变化
取对照组和实验组的样品各20 μL,用10 mmol/L 磷酸盐缓冲液(pH=7.4)稀释至200 μL,用紫外分光光度计(Ultrospec 2100 pro,Amersham Biosciences,Inc.)测定波长为400 nm 时的光密度D(400). 数据用OriginPro 8软件进行作图.
1.2.3粒径法检测溶液中脂质体颗粒大小变化
取对照组和实验组的样品各80 μL,用10 mmol/L 磷酸盐缓冲液(pH=7.4)稀释至4 mL,用粒度仪(ZetaPlus,Brookhaven Instruments Corporation)测定其粒径.采用OriginPro 8软件对数据进行作图.1.2.4相差显微镜法观察溶液中脂质体形态学改变
取对照组和实验组样品各5 μL,置于相差显微镜(BX51,Olympus Corporation)下观察.
1.2.5兔红细胞计数法
将50 μL体积分数为0.2%的兔红细胞(南京森贝伽生物科技有限公司)与等体积柠檬酸缓冲液(取葡萄糖2.050 g、柠檬酸钠0.800 g、柠檬酸0.055 g和NaCl 0.420 g混合,加去离子水定容至100 mL,调节pH=6.1,高压灭菌后4 ℃保存)、奇异果甜蛋白(阴性对照,终质量浓度为5.00 mg/mL)、PM1蛋白(在1.2.2和1.2.3节对脂质体有保护作用的蛋白质量浓度为0.80 mg/mL的基础上,提高PM1质量浓度分别至1.60、2.50和5.00 mg/mL)、甘油(终体积分数为5%)、PM1+甘油混合液.4 ℃孵育30 min后,用TC20细胞计数器(Bio-Rad)统计未经冻融的兔红细胞的数量,将加入蛋白或甘油的样品分别置于-80 ℃或-20 ℃下30 min[13],室温融解30 min,反复冻融3次后进行细胞计数.用冻融处理后的红细胞数量与未冻融红细胞数量的比例作图进行比较.
2 结果分析
2.1浊度法鉴定冻融条件下PM1对POPC脂质体的保护作用
通过检测样品溶液的D(400)反映脂质体的浊度.结果表明,未经冻融的POPC脂质体D(400)值较低;经冻融处理的脂质体溶液的浊度明显上升,表明冻融处理使脂质体受到了破坏;加入奇异果甜蛋白(阴性对照)后经冻融的POPC脂质体的浊度也明显上升,可见奇异果甜蛋白对POPC脂质体没有保护作用.
在POPC脂质体溶液中加入PM1蛋白,并经冻融胁迫,随着PM1蛋白质量浓度增加,脂质体溶液浊度上升程度逐渐降低;当蛋白质量浓度达到0.80 mg/mL时,POPC脂质体的浊度几乎未发生改变(图1).该结果表明,较高质量浓度的PM1蛋白对冻融后的脂质体起明显的稳定作用.
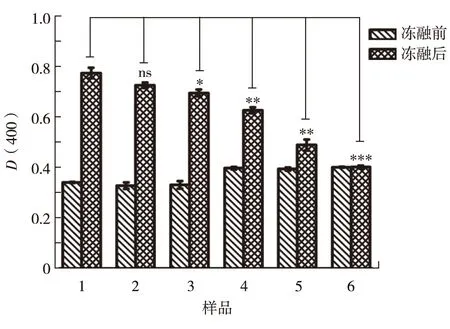
1为POPC脂质体;2为加入0.80 mg/mL奇异果甜蛋白的POPC脂质体;3为加入0.04 mg/mL PM1的POPC脂质体;4为加入0.10 mg/mL PM1的POPC脂质体;5为加入0.40 mg/mL PM1的POPC脂质体;6为加入0.80 mg/mL PM1的POPC脂质体图1 浊度法显示冻融条件下PM1对POPC脂质体的保护作用Fig.1Protection effect of PM1 protein on POPC liposome under the freezing-thawing condition by turbidity assay
2.2粒径法鉴定冻融条件下PM1对POPC脂质体的保护作用
采用粒径法测定溶液中POPC脂质体的粒径.结果显示,制备好的POPC脂质体粒径大小均为130~160 nm,经反复冻融后,约有65%的脂质体粒径维持在110~160 nm,27%的脂质体粒径增大至1 500~2 500 nm.加入奇异果甜蛋白的脂质体经过冻融后,约70%的脂质体体积维持在100~170 nm,30%脂质体增大至1 500~2 500 nm.加入低质量浓度的PM1蛋白(0.04和0.10 mg/mL)时,约有70%的脂质体粒径维持在100~170 nm,25%以上的脂质体粒径增大至400~800 nm.随着PM1蛋白质量浓度的增加,脂质体粒径的增大程度降低;当蛋白的质量浓度达到0.40和0.80 mg/mL时,90%以上的脂质体粒径维持在110~170 nm处(图2),表明在冻融条件下较高质量浓度的PM1可维持脂质体粒径的稳态.
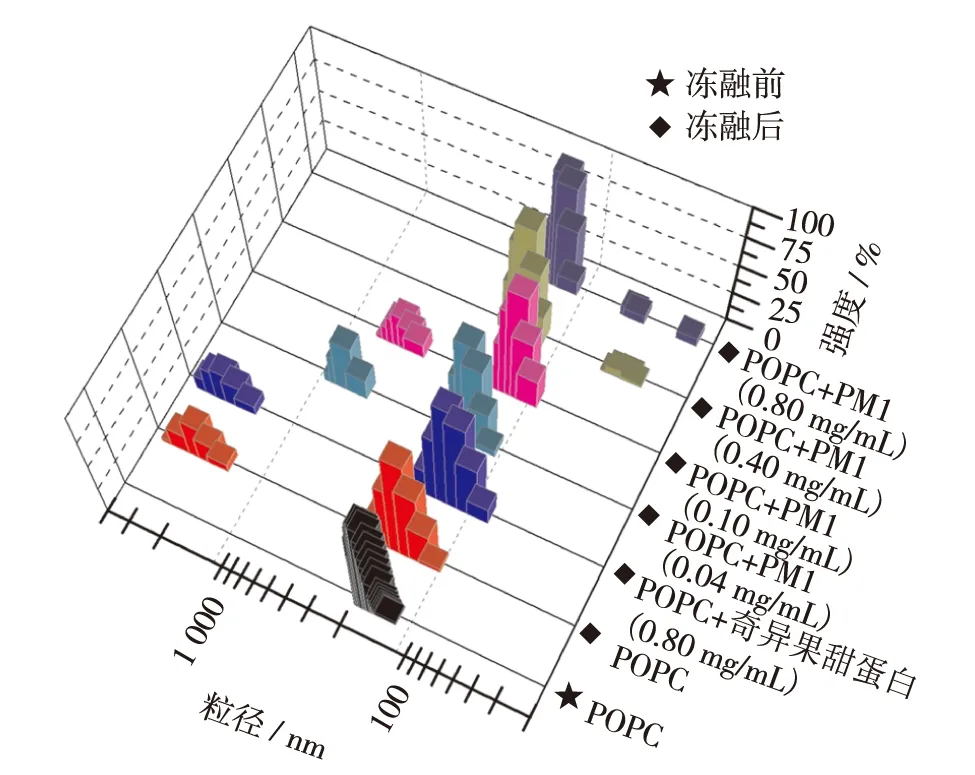
图2 粒径法显示冻融条件下PM1对POPC脂质体的保护作用Fig.2 Protection effect of PM1 protein on POPC liposome under the freezing-thawing condition by particle size assay
2.3相差显微镜术显示在冻融条件下PM1对POPC脂质体的保护作用
取制备好的POPC脂质体样品5 μL置于相差显微镜下观察,所观察视野中为均质状态,如图3(a);经冻融处理后,脂质体明显聚集,呈块状的聚集物,如图3(d).加入0.80 mg/mL奇异果甜蛋白的POPC脂质体样品经过反复冻融后也出现明显的聚集,如图3(e);在脂质体溶液中添加0.80 mg/mL PM1蛋白,再经冻融处理,样品中仅出现少量的脂质体聚集物,如图3(f).
2.4PM1蛋白对兔红细胞的稳定及保护作用
进一步研究PM1蛋白对兔血红细胞的保护作用.首先,将兔血红细胞溶液经-80℃及室温反复冻融处理,计数时发现,经处理的兔红细胞全部破裂(结果未出示).之后,将兔红细胞溶液放置较温和冻融条件下,即-20 ℃及室温冻融处理(图4).研究发现,经反复冻融处理的兔红细胞剩余量为未冻融样品的55%.将奇异果甜蛋白(5.00 mg/mL)加入到兔红细胞溶液中,经冻融后其细胞剩余量未发生明显改变;加入较低质量浓度(0.80、1.60和3.20 mg/mL)PM1蛋白的未显示明显的保护兔细胞膜作用(结果未出示);而加入较高质量浓度(5.00 mg/mL)PM1蛋白的兔红细胞,经冻融后细胞剩余量为未冻融样品的72%.可见,在-20 ℃及室温冻融条件下,较高质量浓度(5.00 mg/mL)PM1可明显提高对兔红细胞的抗冻保护作用.

图3 相差显微镜术显示经冻融处理后PM1对POPC脂质体的保护作用Fig.3 Protection effect of PM1 protein on POPC liposome under the freezing-thawing condition by phase contrast microscopy
在兔红细胞中加入体积分数为5%的甘油后,经冻融处理,兔红细胞剩余量为60%,可见体积分数为5%的甘油对兔红细胞没有明显的保护效果;若同时加入5.00 mg/mL PM1和体积分数为5%的甘油,其兔红细胞剩余量为87%,可见较高质量浓度PM1蛋白与体积分数为5%的甘油对兔红细胞的保护有协同效果.
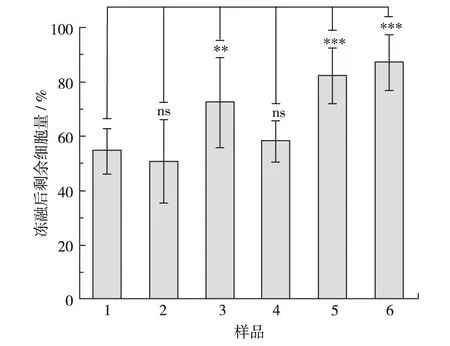
1为兔血红细胞溶液;2为加入5.00 mg/mL奇异果甜蛋白的兔血红细胞溶液;3为加入5.00 mg/mL PM1蛋白的兔血红细胞溶液;4为加入体积分数为5%甘油的兔血红细胞溶液;5为同时加入5.00 mg/mL 奇异果甜蛋白和体积分数为5%的甘油的兔血红细胞溶液;6为同时加入5.00 mg/mL PM1蛋白和体积分数为5%的甘油的兔血红细胞溶液图4 计数法显示在冻融条件下PM1对兔血红细胞的保护作用Fig.4 Protection effect of PM1 protein on rabbit red blood cells under the freezing-thawing condition by cell count assay
3 讨 论
细胞膜系统是构成细胞的最重要部分,其化学组成主要有脂类、蛋白质和糖类.细胞膜有重要的生理功能,既可维持细胞内稳定的代谢环境,又能调节和选择物质进出细胞.而干旱、高盐和冻害等非生物逆境胁迫,对植物造成的主要损伤之一就是破坏细胞膜及内膜系统的稳定性,导致胞内电解质外渗及细胞代谢紊乱等[5].将大麦HVA1(所表达产物属于LEA3)基因转化水稻,在干旱条件下,转基因水稻的膜泄露程度明显减低,意味着植物体内大麦HVA1蛋白可能具有保护膜的功能[14].体外实验还证明,部分植物LEA蛋白具有保护膜结构的功能.如在干燥胁迫下,植物细胞内的线粒体会受到破坏,影响呼吸作用.Tolleter等[15]证明豌豆LEAM(属于LEA3)蛋白可与干燥的膜类似物-POPC中的磷酸基团结合,并可在干燥条件下降低模拟线粒体内膜(含有线粒体主要磷脂组分的脂质体)的泄漏程度,推测在干旱等胁迫下LEAM可通过保护线粒体内膜,维持其呼吸作用的稳定.此外,天然状态下的豇豆DHN1蛋白(属于LEA2)呈无结构状态;当DHN1蛋白与小单层脂质体共同孵育时,其兼性α-螺旋的比例显著增加,推测在非生物胁迫时,该蛋白可能通过构象改变结合磷脂分子从而保护细胞膜或细胞内的膜结构[16].
生物在遭受低温胁迫时,会发生细胞脱水、形成结晶,引起细胞膜结构破裂,细胞或细胞器受到损伤.本研究证明,冻融胁迫可引起POPC脂质体的破裂,继而融合成较大粒径的脂质体,且脂质体也有相互聚合的趋势,因此,可在显微镜下观察到明显聚集、呈块状的脂质体聚集物.加入较高质量浓度的大豆PM1蛋白对经反复冻融的脂质体有明显的稳定作用.同时本研究还证明,高质量浓度的大豆PM1蛋白对经冻融的兔红细胞也有显著的保护作用.上述结果意味着在植物(细胞)受到冷冻胁迫时,大豆PM1蛋白可通过稳定细胞膜磷脂保护细胞膜,稳定膜的代谢活动,减轻植物的冷害或冻害.
在非生物胁迫下,LEA蛋白可保护蛋白(酶)活性,并防止其聚集,其保护作用机制主要以“分子屏蔽模型”解释[17-18].LEA蛋白为无序蛋白.在分子屏蔽模型中,无序的LEA 蛋白不与被保护的蛋白质发生明显相互作用,它们可填充于被保护蛋白质分子之间,以物理屏障阻止被保护蛋白质分子间的互作,减少了部分变性蛋白分子的聚集.在LEA蛋白保护膜的作用中,推测大豆PM1蛋白同样是以“分子屏蔽”作用稳定磷脂分子层,继而保护膜结构,因此,较高质量浓度的大豆PM1蛋白对脂质体及细胞膜结构可能有明显、较强的“分子屏蔽及稳定”的效果.我们将进一步研究PM1蛋白(及一些特殊氨基酸)与不同磷脂分子的互作,以及PM1蛋白对磷脂分子流动性的影响,以期揭示PM1蛋白稳定磷脂分子的分子机理.大豆PM1蛋白(协同低体积分数的甘油)表现出稳定兔血红细胞的重要功能,可能具有以下应用前景:用于制备耐冻、耐寒转基因植物的生产;也可作为蛋白质冻存保存剂稳定生物类制品,如卵细胞、胚胎、红细胞及其捐赠器官等.
/
[1] Battaglia M,Covarrubias A A.Late embryogenesis abundant(LEA)proteins in legumes[J]. Frontiers in Plant Science,2013, 4(2):190-190.
[2] Hand S C,Menze M A,Toner M,et al.LEA proteins during water stress:not just for plants anymore[J]. Annual Review of Physiology, 2011, 73:115-134.
[3] 刘昀,刘国宝,李冉辉,等.胚胎晚期富集蛋白与生物的干旱胁迫耐受性[J].生物工程学报,2010,26(5):569-575.
Liu Yun,Liu Guobao,Li Ranhui,et al. Functions of late embryogenesis abundant proteins in desiccation-tolerance of organisms:a review[J].Chinese Journal of Biotechnology,2010,26(5):569-575.(in Chinese)
[4] Battaglia M,Olvera-Carrillo Y,Garciarrubio A,et al.The enigmatic LEA proteins and other hydrophilins[J].Plant Physiology,2008,148(1): 6-24.
[5] Cuevas-Velazquez C L,Rendon-Luna D F,Covarrubias A A.Dissecting the cryoprotection mechanisms for dehydrins[J]. Frontiers in Plant Science, 2014, 5(5):583.
[6] Schmid M,Davison T S,Henz S R,et al.A gene expression map of Arabidopsis thaliana development[J].Nature Genetics, 2005, 37(5):501-506.
[7] Olvera-Carrillo Y,Campos F,Reyes J L,et al.Functional analysis of the group 4 late embryogenesis abundant proteins reveals their relevance in the adaptive response during water deficit in Arabidopsis thaliana[J].Plant Physiology,2010,154(1):373-390.
[8] Cuevas-Velazquez C L,Saab-Rincon G,Reyes J L,et al.The unstructured N-terminal region of Arabidopsis group 4 late embryogenesis abundant (LEA) proteins is required for folding and for chaperone-like activity under water deficit[J].Journal of Biological Chemistry,2016,291(20):10893-10903.
[9] Shih M D,Hsieh T Y,Lin T P,et al.Characterization of two soybean (Glycine max L.) LEA Ⅳ proteins by circular dichroism and fourier transform infrared spectrometry[J].Plant and Cell Physiololgy,2010,51(3):395-407.
[10] Liu Guoba,Xu Hong,Zhang Liao,et al.Fe-binding properties of two soybean (Glycine max L.) LEA4 proteins associated with antioxidant activity[J].Plant and Cell Physiology,2011,52(6):994-1002.
[11] Clarke M W,Boddington K F,Warnica J M,et al.Structural and functional insights into the cryoprotection ofmembranes by the intrinsically disordered dehydrins[J].Journal of Biological Chemistry,2015,290(45):26900-26913.
[12] Michaela H,Rumiana D,Jan L,et al.The intrinsically disordered late embryogenesis abundant protein LEA18 from Arabidopsis thaliana modulates membrane stability through binding and folding [J]. Biochimica et Biophysica Acta,2011,1808(1):446-453
[13] 唐秋民. 冷冻生物技术在红细胞保存中的应用[J]. 中国医学文摘老年医学,2006,15(1):6-9.
Tang Qiumin. Application of freeze biotechnology in maintaining the red blood cell[J].Chinese Medical Abstract Geriatrics,2006,15(1):6-9.(in Chinese)
[14] Babu R C,Zhang Jingxian,Blum A,et al.HVA1,a LEA gene from barley confers dehydration tolerance in transgenic rice (Oryza sativa L.) via cell membrane protection[J]. Plant Science,2004,166(4):855-862.
[15] Tolleter D,Hincha D K,Macherel D.A mitochondrial late embryogenesis abundant protein stabilizes model membranes in the dry state[J].Biochimica et Biophysica Acta, 2010, 1798(10):1926-1933.
[16] Koag M C,Fenton R D,Wilkens S,et al.The binding of maize DHN1 to lipid vesicles.Gain of structure and lipid specificity[J].Plant Physiology,2003,131(1):309-316.
[17] Tunnacliffe A,Wise M J.The continuing conundrum of the LEA proteins[J].Naturwissenschaften, 2007,94(10):791-812.
[18] Hughes S L,Schart V,Malcolmson J,et al.The importance of size and disorder in the cryoprotective effects of dehydrins[J].Plant Physiology, 2013,163(3):1376-1386.
【中文责编:晨兮;英文责编:艾琳】
2016-06-21;Accepted:2016-07-14
Protection effect of soybean PM1 protein on liposome and the rabbit red blood cells
Chen Liyi,Liu Guobao, and Zheng Yizhi†
College of Life Sciences and Oceanography, Shenzhen University, Shenzhen Key Laboratory of Microbiology and Gene Engineering, Shenzhen 518060, Guangdong Province, P.R.China
We exploit approaches of a turbidity assay, a particle-size assay and a phase contrast microscopy to explore the protective effect of soybean protein PM1(LEA4) on 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine (POPC) liposome under the condition of repeated freezing and thawing. The results show that the turbidity and particle size of POPC liposome increased significantly after the treatment of freezing and thawing in contrast to those without freezing-thawing treatment; the increase of the turbidity and particle size of POPC liposome is reduced significantly after freezing-thawing treatment in the presence of PM1, and POPC aggregates decrease dsignificantly under a phase microscopy. The PM1 protein can maintain the stability of red blood cells from rabbit under the freezing-thawing condition.It can be inferred that PM1 could protect cell membranes by stabilizing its phospholipids under freezing-thawing stress.
late embryogenesis abundant (LEA) protein; PM1 protein; membrane; liposome; cryoprotection; turbidity assay; particle size assay; rabbit red blood cell
Chen Liyi,Liu Guobao, Zheng Yizhi. Protection effect of soybean PM1 protein on liposome and the rabbit red blood cells[J]. Journal of Shenzhen University Science and Engineering, 2016, 33(5): 441-446.(in Chinese)
Q 943.2; Q 71
Adoi:10.3724/SP.J.1249.2016.05441
国家自然科学基金资助项目(31370289)
陈丽伊(1991—),女,深圳大学硕士研究生.研究方向:植物抗逆分子生物学.E-mail:912705323@qq.com
Foundation:National Natural Science Foundation of China (31370289)
† Corresponding author:Professor Zheng Yizhi. E-mail: yzzheng@szu.edu.cn
引文:陈丽伊,刘国宝,郑易之. 大豆PM1蛋白对脂质体及兔红细胞的稳定作用[J]. 深圳大学学报理工版,2016,33(5):441-446.
