基于hsp70mRNA的RT-qPCR方法评估水中病源微生物的灭活效果*
2016-10-20侯阳阳冉治霖李绍峰
侯阳阳,冉治霖,李绍峰
(1.沈阳建筑大学市政与环境工程学院,辽宁沈阳116109;2.深圳信息职业技术学院交通与环境学院,广东深圳518172;3.深圳职业技术学院深圳市城市节水及工业污水资源化技术重点实验室,广东深圳518055)
基于hsp70mRNA的RT-qPCR方法评估水中病源微生物的灭活效果*
侯阳阳1,冉治霖2,李绍峰3
(1.沈阳建筑大学市政与环境工程学院,辽宁沈阳116109;2.深圳信息职业技术学院交通与环境学院,广东深圳518172;3.深圳职业技术学院深圳市城市节水及工业污水资源化技术重点实验室,广东深圳518055)
基于热诱导hsp70mRNA的表达,建立一种RT-qPCR方法来评估水中病源微生物的灭活效果。以大肠杆菌为实验对象,通过RT-qPCR方法定量hsp70mRNA表达,以氯胺消毒样本与空白对照样本的hsp70mRNA表达量之比,确定灭活效果。实验结果显示:该方法检测的灵敏度为900cfu·mL-1;对氯胺灭活效果的检测,该方法的灭活率明显低于平板培养检测结果。基于hsp70mRNA的RT-qPCR方法,具有准确、快速、特异性强的优点,可用于评价水中病源微生物的灭活效果。
热休克蛋白70mRNA;逆转录定量PCR;大肠杆菌;检测;灭活
微生物致病风险是影响供水安全的一个重要问题。据统计,美国每年发生748000例隐孢子虫病例[1];全球每年约60000名儿童感染轮状病毒[2];3%~6%的肺炎是由嗜肺军团菌引起的;其中,受到病原性微生物污染的饮用水是此类疾病传播的重要途径。解决这一问题不仅需要饮用水消毒技术的快速发展,开发准确、快速、特异性强的水中病源微生物灭活效果评价技术也是一个关键问题。
目前,国内外在水中病源微生物活性评价方面开发了多种新型方法,包括:EPA 1623法、IFA(免疫荧光检测法)、细胞感染、原位杂交技术、RT-PCR技术等,但各方法均有不足之处[3]。逆转录定量PCR(reverse transcription-quantitative polymerase chain reaction,RT-qPCR)是一种定量mRNA转录水平的重要方法[4],而mRNA的转录水平又与生物机体的活性相关[5],因此,RT-qPCR技术在微生物活性检测领域得到大量运用[6-8]。
热休克蛋白的表达是生物体内的一种自我保护机制,当生物体受到外界刺激时,表达产生热休克蛋白以增强抵御外界环境变化的能力[9,10]。采用hsp70mRNA作为微生物活性检测的目的基因[11],经过热诱导,其表达量会大大增加[10,12],因此,相比其他目的基因RNA,以hsp70mRNA作为检测定量的目的基因具有更高的灵敏度。本研究基于诱导水环境中微生物hsp70mRNA表达,运用RT-qPCR技术,以水环境中常见的细菌(大肠杆菌)研究对象,建立一种快速、精确的检测方法,并应用于评价水环境中病源微生物灭活效果。
1 实验部分
1.1实验材料
本实验使用的大肠杆菌标准菌株(Escherichia coli,ATCC 25922)购自广东环凯微生物科技有限公司,大肠杆菌培养采用LB培养基(胰蛋白胨10g,酵母提取物5g,NaCl10g,蒸馏水1000mL,121℃灭菌20min)。PCR实验所用耗材均购自Thermo Fisher Scientific公司。
1.2主要实验仪器和试剂盒
Applied Biosystems QuantStudio6 Flex荧光定量PCR仪(Thermo Fisher Scientific公司,美国);NanoDrop2000超微量分光光度计(Thermo Fisher Scientific公司,美国);TProfessional Standard Gradient96 PCR仪(耶拿公司,德国);MIKRO 200R冷冻离心机(Hettich公司,德国)。
总RNA提取试剂盒TRIzol Reagent、逆转录试剂盒High Capacity cDNA Reverse Transcription Kits Protocol、荧光定量试剂盒SYBR SelectMaster Mix、均购自Invitrogen公司。
1.3实验方法
1.3.1引物合成根据GenBank中公布的大肠杆菌hsp70基因序列(D10765),利用Primer Premier5.0软件设计荧光定量引物序列。上游序列为:5'-TGT TCTGACTGGTGACGTGAAA-3';下游序列为:5'-TG CTTGGTCGGGATAGTGG-3';引物序列由由华大基因合成。扩增片段长度为126bp,扩增序列为:
TGTTCTGACTGGTGACGTGAAAGACGTACTGC TGCTGGACGTTACCCCGCTGTCTCTGGGTATCGAA ACCATGGGCGGTGTGATGACCACGCTGATCGCGA AAAACACCACTATCCCGACCAAGCA
1.3.2定量标准品制备本实验采用的标准品为质粒标准品,具体制备方法见参考文献[13]。提取含有hsp70基因的质粒DNA,用超微量分光光度计测量质粒DNA浓度。按以下公式计算质粒标准品拷贝数:
质粒标准品拷贝数(copies·μL-1)=(NL×10-9)×m/(n×660)
式中NL:阿伏伽德罗常数6.02×1023,m:质粒标准品DNA浓度,ng·μL-1;n:扩增序列长度,bp;双链DNA一对核苷酸的质量为660g·mol-1。
本实验中提取的质粒DNA浓度为151.9ng· μL-1,计算得到质粒标准品初始浓度为1.1× 1012copies·μL-1。将初始质粒标准品按10倍梯度稀释得到qPCR的定量标准品。
1.3.3诱导条件的优化为了提高检测方法的效率和灵敏度,需要选择最适宜的条件诱导hsp70mRNA表达。本实验采用热诱导方式,主要优化热诱导温度和时间。取培养过夜的大肠杆菌于离心管中,每个样品1.5mL,分为4组,用HBSS缓冲溶液漂洗3遍;4组菌液分别在37、39.5、42、44.5℃下作用;各组分别在0,30,60,90,120,180min取样(已分装与离心管中),立即提取RNA并用RT-PCR方法定量hsp70mRNA拷贝数。
1.3.4RT-qPCR过程
(1)总RNA提取取经过热诱导菌液1.5mL,4℃、5000r·min-1离心3min,尽弃上清收集菌体,加入1mL TRIzolReagent,反复抽吸振荡,静置5min;加入0.2mL氯仿,静置3min,4℃、12000r·min-1离心15min,将上清液移至另一离心管中(注意吸取上清液时避免吸取中间白色层);向上清液中加入0.5mL异丙醇,室温静置10min;4℃、12000r·min-1离心10min,尽弃上清,加入75%酒精1mL温和洗涤沉淀,4℃、7500r·min-1离心5min,尽量去上清,室温晾干5~10min;加入30μLDEPC处理水溶解RNA沉淀,55~60℃水浴10~15min。用超微量分光光度计测定RNA浓度并检测OD260/OD280。
(2)RNA逆转录采用TProfessional Standard Gradient 96 PCR仪将大肠杆菌总RNA逆转录到cDNA,反应体系由以下成分组成:2.0μL 10×RT Buffer,0.8μL25×dNTPMix,2.0μL10×RT Random Primers,1.0μL MultiScribeTMReverse Transcriptase,1.0μL RNase Inhibitor,2μL RNA,11.2μL Nuclease-free H2O反应体系总体积为20μL。反应程序为:25℃反应10min,37℃反应120min,85℃反应5min,保持10℃到反应结束。
(3)定量PCR采用Applied Biosystems Quant Studio 6 Flex实时荧光定量PCR仪定量目的基因cDNA,SYBR Green标记目的基因,退火温度为59℃。反应体系由以下成分组成:1.0μL正向引物(10μM),1.0μL反向引物(10μM),5μL cDNA,10μL SYBRR Select Master Mix(2X),3.0μL RNase-freewater,反应体系总体积为20μL。反应程序为:50℃反应2min,1个循环;95℃反应2min,95℃反应15s,59℃反应15s,72℃反应1min,40个循环。
1.3.5灵敏度实验将过夜培养的大肠杆菌菌液做十倍梯度稀释,每个梯度取样1.5mL,离心用HBSS平衡溶液漂洗3次,经过42℃热诱导1h后,提取RNA用RT-qPCR方法定量各稀释梯度hsp70 mRNA拷贝数,同时用平板培养法计数大肠杆菌浓度。
1.3.6大肠杆菌灭活检测实验将培养过夜的大肠杆菌菌液用PBS缓冲液做适当稀释,模拟待消毒水样。分别用初始浓度为0.5,1,3,5,10mg·L-1的氯胺(NH2Cl)处理10min,对照样本未做消毒处理。消毒结束后立即用10%的无菌硫代硫酸钠(Na2S2O3)中和,终止消毒。分别取样、离心、用HBSS平衡溶液漂洗3次。室温放置1h后,转移至42℃培养箱热诱导1h,用RT-qPCR方法定量hsp70mRNA拷贝数。同时用平板培养法计数活菌数。
1.3.7消毒效果评价对于平板培养法,消毒效果依据经过消毒后水样中大肠杆菌的存活率进行判断,灭活率S1=lg(Nt/N0),Nt为经过消毒后水样中剩余的大肠杆菌数,N0为未经消毒实验前水样中的大肠杆菌数。对于本实验中基于hsp70mRNA的定量RT-qPCR检测方法,消毒效果依据经过消毒后水样中大肠杆菌hsp70mRNA的表达效率来判断。灭活率S2=lg(Mt/M0),Mt为经过消毒后水样中大肠杆菌hsp70mRNA表达量,M0为未经消毒实验的对照样品中hsp70mRNA表达量。
2 结果与讨论
2.1qPCR的检测区间与特异性
以质粒标准品浓度为横坐标,临界循环数(threshold cycle)为纵坐标建立定量目的基因浓度的标准曲线(图1)。

图1 hsp70定量PCR标准曲线Fig.1 qPCR standard curve of hsp70 gene
由图1可知,目的基因浓度最优检测区间为1.1× 101~1.1×108copies·μL-1。标准曲线方程为y=-3.254x+39.3,式中y代表Ct值,x代表基因浓度的对数值。
大肠杆菌定量标准曲线的线性相关系数(R2)为0.996,目的基因定量PCR扩增效率为102.9%。PCR溶解曲线呈单一的熔点峰,峰型窄而尖(图2),峰值为(84±0.3)℃,由溶解曲线图可知,PCR扩增产物特异性良好,不存在非特异性扩增。

图2 hsp70溶解曲线Fig.2 Melt curve of hsp70 gene
图2结果表明,本实验建立的定量hsp70 cDNA(mRNA)的标准曲线检测范围广、灵敏度较高,且扩增产物特性性良好。
2.2诱导条件优化结果
4组菌液分别在37、39.5、42、44.5℃进行热诱导;各组分别在0,30,60,90,120,180min取样,立即提取RNA并用RT-PCR方法定量hsp70 cDNA拷贝数。经过不同温度和时间诱导后hsp70 cDNA的表达拷贝数见图3。

图3 不同温度诱导hsp70基因表达Fig.3 Induction of hsp70 gene by different temperature
由图3可知,热诱导之前各组样本的hsp cDNA大致相同,都在2.5×105copies左右。诱导温度保持37℃,随着作用时间增加,hsp70 cDNA含量基本不变,依然保持2.5×105copies;诱导温度升高到39.5℃,随着作用时间增加,hsp70 cDNA含量逐渐升高,120min时达到1.4×106copies,此后hsp70 cDNA含量基本不再增加;诱导温度为42℃时,随着作用时间增加,hsp70 cDNA含量迅速增加,30min时已到达1.05×106copies,60min时达到1.4×106copies,此后延长作用时间,hsp70 cDNA含量不再增加;诱导温度为44.5℃,hsp70 cDNA含量先是迅速增加,30min时已经达到1.3×106copies,此后又逐渐下降。
诱导温度为37℃,与大肠杆菌培养温度相同,hsp70mRNA表达量基本保持不变。当诱导温度为39.5℃,hsp70mRNA表达量达到最大需要120min,而当诱导温度为42℃时,只需60min,即可达到相同的诱导效果。当诱导温度为44.5℃时,hsp70mRNA的表达量先急剧增加,30min后逐渐下降,究其原因,可能是较高的温度影响了菌体的代谢,这与热诱导隐孢子虫hsp70 mRNA表达研究结果相似[11]。综上所述,hsp70mRNA最适宜的诱导条件为42℃作用60min。
2.3灵敏度检测结果
由10倍梯度稀释的大肠杆菌目的基因PCR扩增曲线(图3)可知,大肠杆菌浓度在9×102~9×107cfu·mL-1存在扩增曲线,而当浓度为9×10cfu·mL-1时,已不能产生扩增曲线。实验结果表明该方法的最低检测限低至900cfu·mL-1。
图4中,1~7分别为浓度的大肠杆菌样品,8为阴性对照。

图4 灵敏度检测结果Fig.4 Results of sensitivity test
本实验建立的RT-qPCR检测方法对大肠杆菌的检测限最低低至900cfu·mL-1,较段弘扬[14]等报道的大肠杆菌的最低检测限大大降低。这主要是由热休克蛋白的独特性质决定的。当生物体受到热处理或其他外界刺激后,生物体内的hsp70mRNA表达量会大量增加[12]。相比β-tubulin、amyloglucosidase、CP2等基因mRNA,以hsp70mRNA作为活性检测的目标基因可以提高RT-qPCR检测的灵敏度[15]。
2.3消毒效果检测
取待检测样品1.5m L,提取RNA,运用RT-qPCR方法定量大肠杆菌hsp70 cDNA拷贝数。经过不同浓度氯胺消毒样本的检测扩增曲线如图4所示,1~5的氯胺投加量0、0.5、1、3、5mg·L-1,而经10mg·L-1氯胺消毒的样本,不能检测出基因扩增。根据Ct值和标准曲线方程可计算出hsp70 cDNA的拷贝数,结果见表1。

图5 RT-qPCR检测结果Fig.5 Results of detection by RT-qPCRmethod

表1 RT-qPCR检测对应的CT值及拷贝数Tab.1 Number of copies of hsp70 cDNA/RNA
平板培养法检测模拟消毒水样中大肠杆菌浓度为cfu·mL-1。通过平板培养法和RT-qPCR方法检测氯胺灭活大肠杆菌灭活效果见表2。
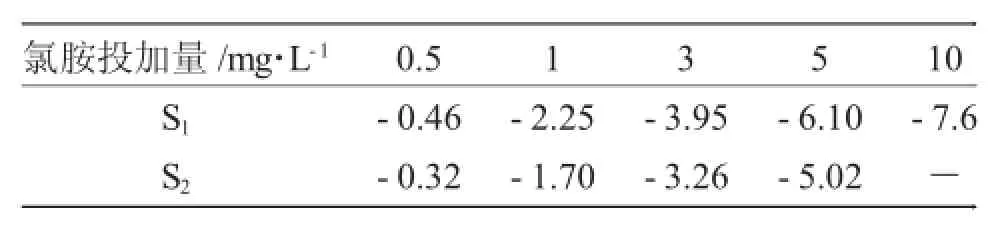
表2 两种方法检测效果对比Tab.2 Comparison of detection affectby twomethods
对比两种方法检测的对数灭活率可知,RT-qPCR方法与培养法之间具有一定的相关性,RT-qPCR方法检测的灭活率低于培养法检测结果。而经过10mg·L-1的氯胺灭活10min后,使用RT-qPCR方法检测不到扩增曲线,说明此时大肠杆菌浓度已经低于RT-qPCR方法检测的最低检测限。
氯胺消毒灭活大肠杆菌实验中,平板培养法检测的对数灭活率高于RT-qPCR方法检测结果。可能是由于当细菌受到外界环境压力后可以进入“具有活性但不可培养(viable butnonculturable,VBNC)”[16]的状态,这种状态下细菌无法通过常规的培养法检测出来,但“VBNC”状态的病原菌仍然保持代谢活性和致病性,基于mRNA的PCR技术可以检测这种状态的细菌[17]。
消毒剂的灭活处理作为一种外界刺激,也会促进微生物体内hsp70mRNA的表达的增加,所以经过灭活的微生物不能立即使用该RT-qPCR进行检测[18]。经过消毒处理的大肠杆菌需在室温放置1h,消除已灭活大肠杆菌hsp70mRNA的影响,再通过42℃热刺激1h诱导有活性菌体hsp70mRNA大量表达,此时hsp70mRNA的表达量与大肠杆菌的活性具有相关性,可以通过RT-qPCR进行灭活效果检测。
3 结论
(1)本实验以水中典型的病源微生物(大肠杆菌)为研究对象,基于RT-qPCR方法定量经过热诱导hsp70mRNA表达量。目的基因质粒标准品建立的标准曲线最优检测区间在1.1×101~1.1× 108copies·μL-1,且扩增产物特异性良好。
(2)热诱导大肠杆菌hsp70mRNA表达的最适宜条件是42℃作用1h。
(3)本实验以1.5mL的取样量提取mRNA,进行RT-qPCR检测,对大肠杆菌的最低检测限可达900cfu·mL-1。
(4)对于大肠杆菌消毒效果检测,平板培养法与RT-qPCR方法具有一定的相关性,但平板培养法检测的灭活率大于RT-qPCR方法检测结果。RT-qPCR方法可以检测处于“VBNC”状态的细菌。
[1]Wallender EK,Ailes EC,Yoder JS,et al.Contributing factors to disease outbreaks sssociated with untreated groundwater[J]. GroundWater,2014,52(6):886-897.
[2]Espinosa A C,Mazari-HiriartM,Espinosa R,et al.Infectivity and Genome Persistence of Rotavirus and Astrovirus in Groundwater and SurfaceWater[J].WaterResearch,2008,42(10-11):2618-2628.
[3]冉治霖,胡健龙,张朝升,等.饮用水中致病原生动物的检测及灭活研究[J].深圳信息职业技术学院学报,2013,11(1):81-86.
[4]Nolan T,Hands RE,Bustin SA.Quantification ofmRNA using real-timeRT-PCR[J].Nature Protocols,2006,1(3):1559-1582.
[5]Bej A.K.,Mahbubani M.H,et al.Detection of viable Legionella pneumophila inwaterby polymerase chain reaction and gene probe methods.Appl&EnvironMicrobiol,1991,57(2):597-600.
[6]Ye K P,ZhangQQ,Jiang Y,et al.Rapid detection ofviable Listeriamonocytogenesin chilled pork by real-time reverse transcriptase PCR[J].Food Control,2012,25(1):117-124.
[7]罗予,李杰,刘娜.RT-PCR检测金黄色葡萄球菌[J].Chinese JournalofMicroecology,2011,23(8):714-716.
[8]Ndoye B,Rasolofo EA,LaPointeG,et al.A review of themolecular approaches to investigate the diversity and activity of cheesemicrobiota[J].Dairy Science&Technology,2011,91(5):495-524.
[9]Bashir S,Bashir H,etal.Heatstock and the heatshock proteins:an overview[J].International Journal of Medical Science and Public Health.2013,2(3):489-494.
[10]De MA.Theheat-shock response[J].New Horizons,1995,3(2):198-207.
[11]Garcés-Sanchez G,W ilderer PA,et al.Assessmentof the viability of Cryptosporidium parvum oocysts with the induction ratio of hsp70mRNA production inmanure[J].JournalofMicrobiological Methods,2013,94(3):280-289.
[12]Maresca B,Kobayashi GS.Hsp70 in parasites:as an inducible protective protein and as antigen[J].Experientia,1994,50(11-12):1067-1074.
[13]胡秀华,何苗,刘丽,等.水中轮状病毒实时定量PCR外标准品的构建[J].环境科学,2008,29(2):380-385.
[14]段弘扬,班海群,张流波.RT-PCR技术快速检测水消毒效果的研究[J].中国消毒学杂志.2014,31(6):585-588.
[15]Liang Z,Keeley A,Detection ofviable Cryptosporidium parvum in soil by reverse transcription-real-time PCR targeting hsp70 mR-NA[J].Applied and EnvironmentalMicrobiology,2011,77(18):6476-6485.
[16]Oliver JD,Dagher M,Linden K G.Induction of Escherichia coli and Salmonella typhimurium into the viable but nonculturable state following chlorination ofwastewater[J].Water Health,2005, 3(3):249-257.
[17]Malorny B,Hoorfar J,Bunge C,et al.Multicenter validation of the analytical accuracy of Salmonella PCR:towards an international standard[J].Applied and EnvironmentalMicrobiology,2003,69(1):290-296.
[18]Bajszar G,Dekonenko A.Stress-induced hsp70 gene expression and inactivation of cryptosporidium parvum oocysts by chlorine-based oxidants[J].Applied And EnvironmentalMicrobiology, 2010,76(6):1732-1739.
Assessing the inactivation of pathogenicm icroorganism s in water based on reverse transcription quantitative PCR with hsp70mRNA*
HOU Yang-yang1,RAN Zhi-lin2,LIShao-feng3
(1.School ofMunicipal and Environmental Engineering,Shenyang Jianzhu University,Shenyang 116109,China;2.Departmentof Transportation and Environment,Shenzhen Institute of Information Technology,Shenzhen 518172,China;3.Shenzhen Key Laboratory of IndustrialWater Saving and Municipal Sewage Reclamation Technology,Shenzhen Polytechnic Institute,Shenzhen 518055,China)
Based on the expression of heat shock-induced hsp70 mRNA,a reverse transcription quantitative polymerase chain reaction(RT-qPCR)assay method was established to assess the inactivation of pathogenic microorganisms in water.With escherichia colias experimental objects,the copy numbers of hsp70mRNA was quantified by RT-qPCR method after heat shock induced,the effect of inactivation was evaluated by comparing the copy numbers of chloraminated sample and control sample.The results shows that the sensitivity of detection was 900cfu·m L-1;for the detection of chloram ine inactivation,the inactivation of this method was significantly lower than that of plate culturemethod.The RT-qPCR method based on hsp70 mRNA was rapid,specific and highly sensitive,and used to assess the inactivation of pathogenicmicroorganisms in water.
hsp70mRNA;RT-qPCR;E.Coli;detection;inactivation
R123.6
A
10.16247/j.cnki.23-1171/tq.20160914
2016-03-29
深圳市科技创新计划基础研究(学科布局)(No.JCYJ201602 26092135176)
侯阳阳(1989-),男,河南鹤壁人,硕士生(沈阳建筑大学与深圳职业技术学院联合培养),主要研究方向:水污染控制技术。
李绍峰(1972-),男,黑龙江佳木斯人,博士,教授,主要研究方向:水污染控制及污水资源化技术。
