离子液体催化微波促进下的3,4-二氢嘧啶-2-酮衍生物的无溶剂合成*
2016-10-20李佰林袁陈缘蔡丽莎黄恩玲
李佰林,袁陈缘,蔡丽莎,黄恩玲
(台州学院医药化工学院,浙江台州318000)
离子液体催化微波促进下的3,4-二氢嘧啶-2-酮衍生物的无溶剂合成*
李佰林*,袁陈缘,蔡丽莎,黄恩玲
(台州学院医药化工学院,浙江台州318000)
以新型磺酸跟酸性离子液体为催化剂,通过微波辐射下促进Biginelli缩合反应,在无溶剂条件下合成了3,4-二氢嘧啶-2-酮衍生物。结果表明,微波温度为120℃,反应时间为30min时产物收率为85%~95%。产物可通过过滤与催化剂分离,催化剂经过简单处理和重复利用。该方法与传统方法相比,反应具有产率高、污染少、操作简单、环境友好等优点。
Biginelli反应;离子液体;3,4-二氢嘧啶-2-酮;微波辐射
3,4-二氢嘧啶-2-酮类化合物(简称DHPM)具有重要的药物活性,可用作钙拮抗剂以及很强的抗HIVgp-120-CD4作用等,并在抗微生物、抗病菌、抗肿瘤、抗菌和消炎等领域有广泛的应用[1]。还具有调节Ca2+通道等作用[2]。过去的10年里,大量新而复杂的胍类生物碱从海洋生物资源中分离提取出来,研究发现很多存在于海洋生物中的活性生物碱大都具有二氢嘧啶酮母核,该类生物碱是第一次被报道能够抑制HIVgp-120-CD4细胞组合的小分子量天然产物,有望成为治疗获得性免疫缺陷综合症(AIDS)的药物[3]。由于这类化合物的重要药物活性,因而,这类化合物的合成研究已成为近年来生物活性有机杂环化合成研究的热点之一[4]。1893年,Biginelli首次报道了乙酰乙酸乙酯、芳香醛和脲在浓盐酸催化下于乙醇中回流18h得到了3,4-二氢嘧啶-2酮衍生物[5]。随后科学家对此反应做了大量的改进,在方法上采用了如微波合成、超声合成等合成技术[6,7];催化剂方面采用了离子液体、苯甲酸、Mn(Ac)2、FeCl3、MCM-41等[8-13]改进措施。改进后的这些反应通常都是在有机溶剂中或在传统加热方式下进行,不仅反应时间长,条件苛刻,而且有的还需要稀有金属催化剂,对环境有一定程度的污染。
目前,绿色有机合成化学已越来越引起人们的重视,其中寻找环境友好的反应介质是绿色化学研究的一个重要课题。无溶剂反应体系当然最能满足这一要求。微波促进有机合成技术已经成功应用于各类有机反应,并成为一门前言的应用型学科[14]。离子液体作为一种环境友好的反应介质和催化剂已经成功应用于各类有机反应,如含咪唑骨架的离子液体就成功应用于Biginelli缩合反应[15],并得到了良好的产物有收率。在前期工作中,已成功将功能化酸性离子液体催化剂应用于吲哚的合成(其结构见图1)[16]。本文将以其为催化剂,芳香醛、乙酰乙酸甲酯与尿素为原料,通过微波促进Biginelli缩合反应制取3,4-二氢嘧啶-2-酮类衍生物。

图1 含有双磺酸基团的酸性离子液体结构Fig.1 Acidic ILs bearing two alkyl sulfonic acid groups
1 实验部分
1.1仪器和试剂
Mercury-VX200 plus核磁共振仪(美国Varian公司),DMSO-d6为溶剂,TMS为内标;XT-4显微熔点仪(上海荆和分析仪器有限公司),温度计未校正;MAS-Ⅲ型微波制样系统(上海新仪微波化学科技有限公司)。
无水乙醇等都为分析纯试剂,使用前无需干燥处理。其它试剂均为市售分析纯,离子液体为自制。
1.2催化剂的合成
将三甲基硅咪唑(14.0g 0.1mol)加入到100m L三口烧瓶中,冰浴条件下缓慢滴加1,3-丙烷磺酸内酯(24.4g0.2mol),滴加完毕后并在冰浴条件下继续搅拌30min,滴加约5mL水,继续搅拌5h左右,减压蒸馏脱去水和三甲基硅醇,得到中间产物两性化合物。向所得中间产物的水溶液中滴加等摩尔的三氟甲磺酸(15.0g 0.1mol),滴加完毕后回流2h,最后于90℃条件下减压脱溶除去溶剂水,得到浅黄色透明状离子液体43.2g,收率95%。1H NMR(400MHz, D2O,δppm):δ2.14~2.19(m,4H),2.76~2.79(t,4H, J=7.5Hz),4.20~4.23(t,4H,J=7.5 Hz),7.39~7.41(d,2H,J=1.5Hz),8.70(s,1H).13CNMR(100MHz,D2O, δppm):20.9,28.1,49.0,50.1,122.5,135.3.Anal. Calcd.forC10H10N2O2F3S3:C,26.37;H,2.20;N,6.16;O, 31.65;F,12.52;S,21.10;Found:C,26.36;H,2.19;N, 6.15;O,31.63;F,12.51;S,21.11.
1.33,4-二氢嘧啶-2-酮衍生物的合成
将芳香醛(50mmol)、乙酰乙酸甲酯(50mmol)、尿素(55mmol)和离子液体(2.5mmol)加入100mL三口烧瓶中混合,将三口烧瓶放入微波反应器内,设置微波辐射时间为30min,温度为120℃。待反应结束,停止微波加热,冷却后加入50mL冰水充分搅拌,过滤反应液,滤饼用蒸馏水洗涤3次。含有离子液体的滤液蒸馏除水后,可直接重新使用。产物经干燥处理后,用无水乙醇重结晶得纯产物4见图2。

图2 3,4-二氢嘧啶-2-酮衍生物的合成Fig.2 Synthesis of 3,4-dihydropyrimidine-2(1H)-ones

表1 3,4-二氢嘧啶-2-酮衍生物的合成Tab.1 Synthesis of 3,4-dihydropyrimidin-2(1H)-one catalyzed by[(HSO3-p)2im][CF3SO3]
4a:1H NMR(400 MHz,DMSO-d6):9.21(s, 1H),7.68(s,1H),7.32-7.21(m,5H),5.16-5.14(d, J=3.4 Hz,1H),3.54(s,3H),2.26(s,3H);13CNMR(100 MHz,DMSO-d6)166.5,152.9,149.4,145.3, 129.1(2C),127.9,126.9(2C),99.7,54.5,51.5,18.5. 4b:1H NMR(400MHz,DMSO-d6):9.21(s,1H),7.71(s,1H),7.14(d,J=8.0Hz,2H),6.87(d,J=8.0Hz, 2H),5.08(d,J=3.4Hz,1H),3.73(s,3H),3.53(s, 3H),2.24(s,3H);13CNMR(100MHz,DMSO-d6)166.5,159.1,152.9,149.0,137.5,128.0(2C),114.4(2C),99.9,55.7,53.8,51.4,18.5。
4c:1H NMR(400MHz,DMSO-d6)9.16(s,1H), 7.74(s,1H),7.12-7.06(m,4H),5.11(d,J=3.4 Hz, 1H),3.53(s,3H),2.26(s,3H),2.25(s,3H);13CNMR(100 MHz,DMSO-d6)166.5,152.9,149.1,142.4, 137.1,129.6(2C),126.8(2C),99.7,54.2,51.4,21.3, 18.5。
4d:1H NMR(400MHz,DMSO-d6)9.21(s,1H), 7.74(s,1H),7.25(d,J=8.0 Hz,1H),5.12(d,J=2.0Hz,1H),3.73(s,3H),3.55(s,3H),2.25(s,3H);13C NMR(100 MHz,DMSO-d6)166.5,159.9,152.9, 149.5,146.8,130.3,118.8,113.0,112.8,99.5,55.6, 54.3,51.5,18.5。
4e:1H NMR(400MHz,DMSO-d6)9.15(s,1H), 7.24(s,1H),7.03(d,J=8.0Hz,2H),6.89(d,J=8.0 Hz,2H),5.49(s,1H),3.80(s,3H),3.47(s,3H), 2.29(s,3H);13CNMR(100MHz,DMSO-d6)166.4, 157.2,152.9,149.9,131.9,129.4,127.4,120.9,111.9, 97.9,56.1,51.4,49.4,18.4。
4f:1H NMR(400MHz,DMSO-d6)9.19(s,1H), 7.69(s,1H),6.89(d,J=10.0 Hz,2H),6.70(d,J=10.0 Hz,1H),5.10(d,J=3.4 Hz,1H),3.72(s,6H),3.54(s, 3H),2.25(s,3H);13C NMR(100MHz,DMSO-d6)166.5,152.9,149.2(2C),148.7,137.8,118.4,112.4, 111.1,99.7,56.2(2C),54.0,51.5,18.5。
4g:1H NMR(400MHz,DMSO-d6)9.28(s,1H),7.79(s,1H),7.42-7.17(m,4H),5.16(d,J=3.4 Hz,1H),3.55(s,3H),2.27(s,3H);13CNMR(100 MHz,DMSO-d6)166.4,152.6,149.9,147.7,133.7, 131.2,127.9,126.8,125.5,99.0,54.1,51.6,18.6。
4h:1HNMR(400 MHz,DMSO-d6)9.28(s,1H),7.79(s,1H),7.57-7.55(m,1H),6.37-6.43(m,1H),6.10(d,J=3.0Hz,1H),5.20(d,J=3.8 Hz,1H),3.57(s, 3H),2.24(s,3H);13CNMR(100MHz,DMSO-d6)170.9,161.2,157.9,155.1,147.7,115.8,110.7,101.9, 56.3,53.0,23.2。
4i:1H NMR(400MHz,DMSO-d6)9.25(s,1H), 7.92-7.82(m,5H),7.68(s,1H),7.53-7.42(m,4H), 5.33(d,J=3.4 Hz,1H),3.54(s,3H),2.31(s,3H);13C NMR(100 MHz,DMSO-d6)166.6,152.8,149.6, 142.7,133.4,133.0,129.1,128.6,128.1,126.9,126.6, 125.6,125.1,99.4,54.8,51.5,18.6。
4j:1H NMR(400MHz,DMSO-d6):9.21(s,1H),7.76(s,1H),7.41-7.24(m,5H),5.19(d,J=3.4 Hz,1H),3.04(dd,J1=7.0 Hz,J2=7.4 Hz2H),2.29(s,3H),1.14(t,J=7.0 Hz 3H);13CNMR(100MHz, DMSO-d6)166.0,152.8,149.1,145.5,129.1(2C), 127.9,126.9(2C),99.9,59.9,54.6,18.5,14.7。
4k:1H NMR(400MHz,DMSO-d6):9.30(s,1H),7.82(s,1H),7.53-7.26(m,4H),5.19(d,J=3. 0Hz,1H),4.10-3.99(m,2H),2.30(s,3H),1.15(t,J= 7.0 Hz 3H);13C NMR(100 MHz,DMSO-d6)165.8, 152.6,149.7,148.2,131.5,130.9,129.9,125.9,122.2, 99.2,59.9,54.3,18.5,14.7。
2 结果与讨论
2.1催化剂的筛选
以苯甲醛、乙酰乙酸甲酯和尿素为原料,微波辐射时间为30min,温度为120℃,在不同的催化剂催化下的反应结果见表2。
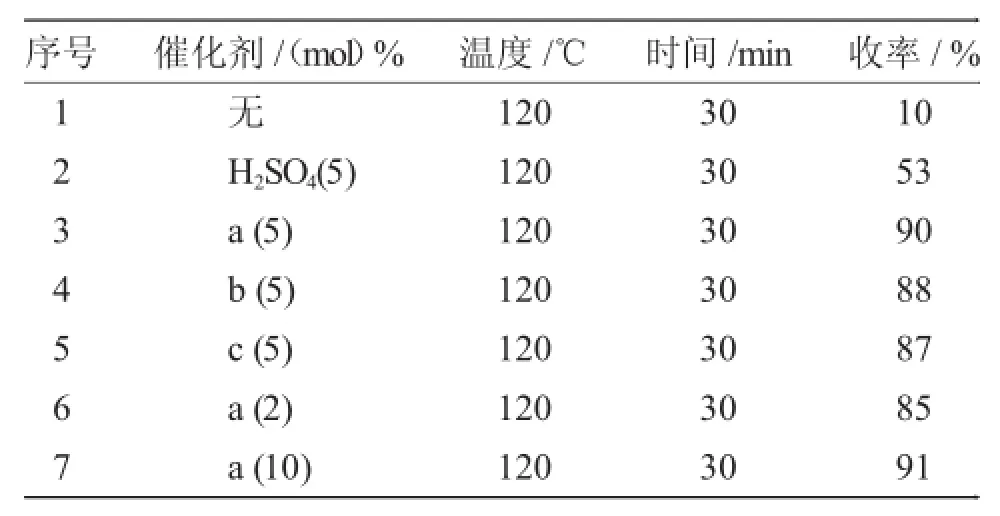
表2 不同催化剂对产物收率的影响Tab.2 Effect of the different catalysts on the yield of compound
在不加任何催化剂下只有少量产物生成,以硫酸催化反应得到53%收率,而以5%mol[(HSO3-p)2im][CF3SO3]为催化剂时,收率达到90%。同时,实验还考察了催化剂用量对反应的影响。当催减少为2%时,收率下降为85%,而增加用量至10%时,产物收率为91%,增加并不明显,因此催化剂最适用量为原料醛的5(mol)%。
2.2反应时间和反应温度的考察
以图1中结构a([(HSO3-p)2im][CF3SO3])的离子液体为催化剂,反应物的物料配比为1∶1∶1.1(苯甲醛10mmol),催化剂用量为苯甲醛的5(mol)%,改变反应时间和反应温度,反应结果见表3。

表3 反应时间及温度对产物收率的影响Tab.3 Effect of the reaction time and temperature on the yield of compound
从表3可以看出,随着反应温度的增加,产物收率有增加的趋势,当温度超过120℃时,温度对收率的影响减弱。同样,当微波时间超过30min后,产物收率也没有增加的趋势。因此,微波时间30min,微波反应温度为120℃是最佳的反应操作条件。
2.3反应物料配比的考察
在微波时间为30min,微波温度为120℃下,以图1中的a为催化剂(用量为醛的5%mol),改变3种原料我物料配比,考察物料配比对产物收率的影响,结果见表4。

表4 物料配比对产物收率的影响Tab.4 Efectof feed ratios on the yield of compound
从表4结果可以看出,尿素过量时有利于产物收率的提高(序号1,2),而乙酰乙酸甲酯和尿素同时过量时,并没有增加产物的收率(序号3),而进一步增加尿素的配比,当尿素的配比达到1∶1∶1.2后,产物的收率并没有进一步增加。因此,苯甲醛:乙酰乙酸甲酯:尿素的最适配比为1∶1∶1.2。
2.4催化剂的回收利用
以10mmol苯甲醛、乙酰乙酸甲酯、尿素反应为例,在上述最适反应条件下,考察反应催化剂的回收利用。反应结束后,反应混合物加10mL冰水充分搅拌,析出产物,产物过滤干燥后用乙醇重结晶。含催化剂的滤液减压蒸干,直接用于催化下次反应。经过5次重复使用后,所得产物收率为88%,可见其催化效果没有明显的降低。

表5 催化剂的循环使用Tab.5 Catalyst recycling for Biginelli reaction
3 结论
与已报道的合成方法相比,含双磺酸基酸性离子液体催化的,微波促进的芳香醛、乙酸乙酰甲酯和尿素的三组分“一锅法”反应,具有反应条件温和、产率高、操作简单、催化剂易得、易保存、可回收重复使用等优点,避免了部分传统合成方法使用有机溶剂、催化剂不能回收利用、反应时间长等不足。该方法为3,4-二氢嘧啶-2-酮类化合物的合成提供了新途径,符合绿色化学要求,有潜在的应用前景。
[1]Nimesh R.K.,DhavalD.H.,Prashant TM,et al.Synthesisand evaluation of in vitroantitubercularactivity and an timicrobialactivity of some novel 4H-chromeno[2,3-d]pyrimidine via 2-amino-4-phenyl4H-chromene-3-carbonitriles[J].Med Chem Res,2011,7(20):854-864.
[2]王喜存,许新兵,权正军,等.PEG-400为绿色反应介质无催化一锅法合成2-氨基-3-氰基-4-芳基-4H苯并色稀衍生物[J].有机化学,2009,29(7):1821-1824.
[3]Roberto B.,Giovanna B.,Maria L.C.,et al.Three-componentprocess for the synthesis of 2-amino-2-chromenes in aqueousmedia[J].Tetrahedron,2001,57(7):1395-1398.
[4]余富朝,严胜骄,林军.无溶剂反应在杂环合成中的应用进展[J].有机化学,2010,30(10):1421-1430.
[5]Tu S.J.,MIAO G.B.,GAOY.,et al.Microwave-prompted reaction of cinnamonitrilederivativeswith 5,5-dimethyl-1,3-cyclohexanedione[J].Chinese J.Chem.,2002,20(7):89-92.
[6]Armido S.,Patrick J.,PeterW.,etal.FluorousSynthesis:Fluomus Protocols for the Ugi and Biginelli Muhicomponent Condensations[J].J.Org.Cbem.,1997,62(9):2917-2924.
[7]廖德仲,王国祥,许怡学.超声波促进合成3,4-二氢嘧啶-2(1H)-硫酮[J].化学试剂,2013,35(11):1048-1050.
[8]于杨,刘迪,刘春生,等.苯甲酸催化一锅合成3,4-二氢嘧啶-2 -(IH)酮[J].化学试剂,2007,29(3):l81-183.
[9]路军,马怀让.三氯化铁催化的一锅法合成3,4-二氢嘧啶-2-酮[J].有机化学,2000,20(5):815-818.
[10]彭家建,邓友全.室温离子液体催化“一锅法”合成3,4-二氢嘧啶-2-酮[J].有机化学,2002,22(1):71-73.
[11]仇明华,詹国胜,于贤勇,等.微波辐射一锅法合成1-羧甲基-3-甲基咪唑四氟硼酸离子液体[J].合成化学,2007,I5(6):763-764.
[12]马金广,张纪明,周建华.无溶剂条件SbCl3催化合成二氢嘧啶酮衍生物[J].山东化学,2011,24(3):22-26.
[13]Kulsum K.,ZebaN.S.,MCM-41 supported perchloric acid forefficientsynthesis of3,4-dihydropyrimidin-2-(1H)-ones via Biginellireaction[J].Monatsh Chem.,2015,146:2097-2105.
[14]金钦汉,戴树珊,黄卡玛.微波化学[M].北京:科学出版社,1999.
[15]Dabiri M.,Salehi P.,?Baghbanzadeh M.et al.Efficient and eco-friendly synthesis of dihydropyrimidinones,bis(indolyl)methanes,and N-alkyland N-arylimides in ionic liquids[J].Tetrahedron Lett,2007,4(4):393-401.
[16]LIBailin,XUDanqian,ZHONG Aiguo,Novel SO3H-functionalized ionic liquidscatalyzed a simple,green and efficientprocedure for Fischer indole synthesis in water undermicrowave irradiation[J].J.FluorineChem.,2012,(144):45-50.
Catalysis by acidic ionic liquids:An efficient synthesis of 3,4-dihydorpym idine(1H)-ones under m icrow ave irradiation and solvent free conditions*
LIBai-lin*,YUAN Chen-yuan1,CAILi-sha1,HUANG En-ling1
(Departmentof Pharmaceutical and Chemical Engineering,Taizhou College,Taizhou 318000,China)
Novel SO3H-functionalized ionic liquidswere successfully applied as catalysts for the one-pot three component Biginelli condensation underm icrowave irradiation without solvent.Various types of 3,4-dihydorpymidine(1H)-oneswere provided in 85%~95%yields and conveniently separated from the reactionmixture by filtration,the dissolved catalyst could be reused with simple treatment.This novel synthetic method is especially favoured because it provides a synergy between ionic liquids andmicrowave irradiation which offers the advantages of high yields,short reaction times,simplicity,and easy workup compared to the conventionalmethods reported in the literature.The structures of all compoundswere confirmed by NMR.
Biginelli reaction;ionic liquids;dihydropyrim idinone;microwave irradiation
O626
A
10.16247/j.cnki.23-1171/tq.20160910
2016-06-06
浙江省教育厅项目(Y201328326)
李佰林(1972-),男,博士,讲师,从事绿化有机合成研究。
