结直肠癌肝转移影像诊断策略
2016-10-19邱大胜
邱大胜
结直肠癌肝转移影像诊断策略
邱大胜

邱大胜华中科技大学影像医学与核医学博士(CT/MR诊断),副主任医师,从事肿瘤影像诊断16年。2010年5月至今从事PET/CT诊断。主持省级课题3项,其中2项为结直肠癌MR磁共振诊断临床研究,如“MRI在直肠癌分期中的应用”及湖北省自然科学基金“低位直肠癌保肛术对排便功能影响的脑fMRI研究”,并参与多项省部级科研课题实施。2015年被评为武汉市中青年骨干人才。担任《临床放射学杂志》、《肿瘤防治研究》及《中华肿瘤学》等杂志审稿专家。学术兼职:湖北省医学会核医学分会委员、湖北省核学会理事、中华医学会核医学分会PET与分子影像学组委员、中国抗癌协会核医学分会委员、湖北省抗癌协会肺癌学组常委。以第一作者发表科研论文25篇,SCI收录3篇,参编教材及专著共3部。
超声、CT、MRI、PET/CT及PET/MR在结直肠癌肝转移诊治中广泛应用,NCCN指南提出结直肠癌肝转移影像学诊断首选增强MR,但对于每个结直肠癌肝转移患者如何选择合适的影像学检查,充分合理地应用有限的资源是临床关注的重点。结合国内外文献及笔者多年的MDT经验,对于结直肠癌肝转移患者,在参照指南的基础上更要结合患者自身病情,由多学科专家讨论做出合理的影像诊断。
结直肠肿瘤;肿瘤转移;肝;影像学诊断
结直肠癌发病率及死亡率在恶性肿瘤中分别位于第4位和第5位[1]。结直肠癌肝转移(colorectal liver metastases,CRCLM)发生率在结直肠癌患者中约占50%,同时性肝转移约占25%[2]。随着外科技术及肝可切除性标准的发展,手术切除是治疗可切除性CRCLM的重要手段[3],而CRCLM术前及接受术前新辅助化疗的病人肝转移的影像学准确评估非常关键[4-5]。目前,CRCLM的影像学评估包括超声造影(contrast-enhanced ultrasonography,CEUS)及术中超声、增强CT、增强MR、FDG-PET/ CT及PET/MR。哪些CRCLM患者能从手术前的影像学检查中获益,如何更合理使用有限的医疗资源是临床关注的重点[6]。
一、肝转移瘤外科治疗的临床价值
肝脏是结直肠癌远处血行转移最常见的部位[7]。CRCLM患者若未接受手术则5年生存率低。手术治疗可切除的CRCLM研究显示,对选择性患者手术切除肝转移是可能治愈的,10年生存率达20%[8]。还有数据显示对再次肝复发的转移病灶可再行手术切除,但5年生存率会随着手术次数而降低。对结直肠癌原发灶和肝转移灶均可切除者可行同时切除或分次切除,对不可切除肝转移且原发肿瘤未出现急性梗阻时,化疗是首选治疗,化疗后再次影像学评估能否切除肝转移灶,如化疗后全面评估存在手术指征则仍然可以切除肝转移灶。所以,肝转移灶能否一期切除还是化疗后切除,影像学评估至关重要[9]。另外,化疗后再切除的肝转移灶的病例影像学复查时机的选择亦十分重要,如化疗后影像检查显示肝转移瘤消退则不可取,临床上一般采取化疗2个周期后再次影像学评估。化疗前外科医生需要预判经过短期化疗转移灶退缩使原来不可切除或潜在可切除转移灶转化为可切除转移灶,原来切除困难的转移灶转化为易切除病灶等。
二、肝转移瘤的影像学评估
CRCLM的影像学评估包括超声、CT、MR、FDG-PET/CT、PET/MR。2000年左右的临床研究提示PET/CT、增强MR、增强CT、超声造影对肝转移瘤的敏感度逐渐减低,而特异度基本近似。经过十年的临床实践,2010年临床研究结果却不同,MR增强较CT增强敏感度更高,成为临床一线诊断CRCLM的方法[4]。而FDG-PET/CT的假阳性与假阴性逐渐被人们认识,特别是对小于1.0 cm的肝脏转移灶更易发生假阴性,因此,FDG-PET/ CT是诊断CRCLM临床二线推荐[10]。
(一)肝脏超声
肝脏超声是诊断结直肠癌肝转移便宜实用的工具,但是,术前肝脏转移灶超声定位较难,术中超声对CRCLM敏感度最高,它可以发现33%~40%的新病灶,而且导致7.5%的CRCLM患者改变了外科手术方案[10]。近期PROMETEO研究[3]表明术中CEUS敏感度最高,MRI较CT、术前CEUS和FDG-PET/CT敏感。FDG-PET/CT敏感度最差;CT增强敏感度不逊于术前CEUS。但术中CEUS不能术前确定不可切除患者,所以外科医师在手术中并没有选择术中超声造影作为判断CRCLM的方法,超声是动态影像,探头的角度、方向及力度的改变使肝脏的扫描切面图像发生改变,不能为临床提供相对恒定的解剖图像,故肝脏超声图像并没有被临床医生作为术前多学科讨论的基本图像,而是作为一个术中引导工具,在术中超声引导下寻找术前影像学诊断的肝转移灶并实施精确手术切除。
(二)MR及CT增强
对于小于1.0 cm的肝内病灶如小血管瘤、囊肿及转移瘤的鉴别诊断,MR增强诊断准确性优于CT增强,达到91%。肝转移瘤MR平扫呈稍长T1稍长T2信号结节(图1A,1B),MR及CT增强特征性表现是门静脉期环形强化(图1C),但对于小于1.0 cm特别是小于0.5 cm的转移灶显示其强化特征比较困难,特别是囊肿囊液密度较高时,周围正常肝实质强化造成环形强化的假象。小于1.0 cm的肝转移瘤特异性肝脏MR对比剂钆塞酸二钠(Gd-EOB-DTPA)等比常规MR对比剂发现肝脏转移灶敏感度更高(95% vs 87%)[7,9]。Gd-EOB-DTPA 是细胞外间隙对比剂,被肝细胞特异性摄取率达到50%,注射后肝实质强化扫描时间窗为5 min到2 h,注射对比剂后20 min的肝实质静态成像对于小病灶的检出率优于动脉期及门静脉期[11]。MR功能成像如MR-DWI可以显示小于1.0 cm的转移瘤,肝转移瘤在DWI图上呈稍高信号(图1D),DWI敏感度达到95%,准确性达到83%,但是空间分辨率不足及磁敏感伪影会影响图像质量。如肝左叶的病灶存在心脏搏动伪影及胃泡气体伪影。另外,肝包膜下的微小转移灶,DWI存在漏诊,而MR增强可以弥补这一不足。所以,在临床工作中MR增强联合DWI共同诊断小于1.0 cm的肝转移灶的敏感度及特异性优于其它影像学方法。因此,肝脏转移瘤的MR诊断提到了前所未有的高度,特别是MR-DWI联合MR肝脏特异性对比剂在结直肠癌肝转移诊断中的价值得到临床肯定[7,11]。NCCN指南推荐结直肠癌肝脏转移瘤的影像学评估首选MR,虽然从目前的临床研究中数据显示肝脏MR对肝脏转移瘤的诊断优于CT、FDG-PET/CT。但是,肝脏磁共振成像仍存在以下问题:(1)患者配合程度;(2)心脏及腹腔大血管的搏动伪影及胃腔内的气体伪影;(3)MR的空间分辨率仍有待进一步提高。上述问题影响了图像质量,从而影响肝脏转移灶的显示,特别是小于1.0 cm的病灶尤为明显,所以,在临床工作中,肝脏磁共振图像并不一定总是令人满意。因此,在针对具体病例时仍具体对待。
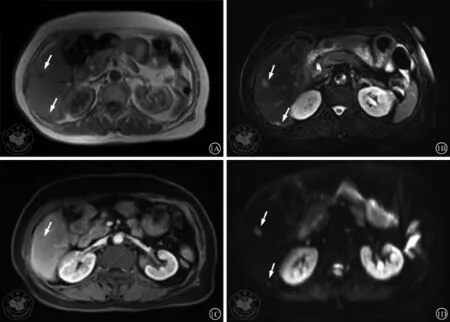
图1 72y/F,直肠癌术后肝转移SIEMENS 3.0TMR成像仪,平扫、Gd-DTPA-增强及DWI,层厚6.5 mm,层间距0.5 mm。图1A、1B:T1WI(TR 120 ms,TE 2.46 ms),T2WI(TR 3000ms,TE 110ms),肝右后下段(VI段)可见两枚稍长T1稍长T2信号小结节,最大径分别为1.1 cm、0.7 cm;图1C:增强第VI较大结节呈环状强化,小结节增强强化不明显;图1D:DWI(TR 6700 ms,TE 93 ms,b=700 s/mm2)可见稍高信号结节(如白色箭头所示)
(三)FDG-PET/CT
FDG-PET/CT既能评估结直肠癌肝外转移也能较准确诊断肝内转移。结直肠癌腹腔内肝外转移的FDG-PET/CT首选,它可以用来检测常规影像学方法难以发现的隐匿性转移灶。对于肝内转移灶大于1.0 cm敏感度达到78%~95%,但是对于小于1.0 cm的肝脏转移灶,敏感度下降到36%,假阴性的原因如下[5]:(1)转移灶的坏死及黏液成分;(2)PET空间分辨率低;(3)呼吸运动;(4)部分容积效应。所以,NCCN指南不推荐FDG-PET/CT作为结直肠癌分期的影像学检查,如常规影像学方法难以明确诊断及该诊断对于治疗方案具有决定性意义,肝内病灶大于1.0 cm,此时可以选择FDG-PET/CT进一步明确诊断。另外,结直肠癌治疗后肿瘤标志物进行性升高,而常规影像学检查阴性,临床仍可以选择FDG-PET/CT进一步检查。
PET/MR一体机是最近在临床使用的一种影像学融合技术,对结直肠癌肝脏转移灶的判断与PET/CT比较,PET/MR可以发现41%的额外肝转移灶[12]。但设备昂贵,目前临床普及程度不够。
总之,影像学检查在结直肠癌分期及再分期中具有非常重要的价值,其中肝转移临床处理与影像学选择非常关键。临床上CRCLM包括CT增强和MR增强,首选增强MR及DWI,但对下述情况如(1)患者配合不好;(2)存在MRI检查禁忌症;(3)CT增强及MR增强难以定性的病灶,而且该病灶对治疗方案影响大的病例;(4)临床需进一步了解腹腔内肝外病灶的情况。上述情况FDG-PET/CT仍然是临床最佳选择之一。而术中超声主要目的是用于术中引导,术中超声增强目前应用较少。而PET/MR一体机是目前诊断CRCLM最佳的影像学技术,但对肺部转移灶的确定仍然存在一定的局限性[12]。总之,对于CRCLM的影像学评估应由结直肠癌MDT相关专家基于指南及患者具体病情做出最优的个体化方案。
[1]陈万清,郑荣寿,张思维.2012年中国恶性肿瘤发病及死亡分析[J].中国肿瘤,2016,25(11):1-8.
[2]Steele Jr,Ravikumar TS.Resection of hepatic metastases from colorectal cancer.Biologic perspective[J].Ann Surg,1989,210(2):127-138.
[3]Rojas FL,Fabio FD,Ercolani G,et al.Imaging in resectable colorectal liver metastasis patients with or without preoperative chemotherapy:results of the PROMETEO-01 study[J].British Journal of Cancer,2014,111(7):667-673.
[4]Legou F,Chiaradia M,Baranes L,et al.Imaging strategies before beginning treatment of colorectal liver metastases[J].Diagnostic and interventional Imaging, 2014,95(5):505-512.
[5]Tirumani SH,Kim KW,Nishino M,et al.Update on the Role of Imaging in Management of Metastatic Colorectal Cancer[J].RadioGraphics,2014,34(7):1908-1928.
[6]Vincent SY,Brendan C,Declan FJ,et al.Optimal imaging sequence for staging in colorectal liver metastasese:Analysis of three hypothetical imaging strategies[J].European Journal of Cancer,2014,50(5):937-943.
[7]Brismar TB,Kartalis N,Kylander C,et al.MRI of colorectal cancer liver metastases:comparison of orally administration manganese with intravebously administered gadobenate dimeglumine[J].Eur radiol,2012,22(3):633-641.
[8]Power DG,Kemeny NE.Role of adjuvant therapy after resection of colorectal cancer liver metastases[J].J Clin Oncol,2010,28(13):2300-2309.
[9]Kim HJ,Lee SS,Byun JH,et al.Incremental value of liver MRI in patients with potentially curable colorectal hepatic metastasis detected at CT:A prospective comparison of DWI,Gadoxetic acid-enhanced MRI ,and a combination of both MR technique[J].Radiology,2015,274(3):712-722.
[10]Bonanni L,deʹLiguori Cainio N,Deshpande R,et al.A comparison of diagnostic imaging modalities for colorectal liver metastases[J].Eur J Surg Oncol,2014,40(5):545-550.
[11]Koh DM,Collins DJ,Wallace T,et al.Combining diffusion-weighted MRI with Gd-EOB-DTPA enhanced MRI improves the detection of colorectal liver metastases[J].The British Journal of Radiology,2012,(85):980-989.
[12]Brendle C,Schwenzer NF,Rempp H,et al.Assessment of metastatic colorectal cancer with hybrid imaging:comparison of reading performance using different combinations of anatomical and functional imaging techniques in PET/MRI and PET/CT in a short case series[J].Eur J Nucl Med Mol Imaging,2016,43(1):123-132.
Diagnostic imaging strategies for colorectal liver metastases
Qiu Dasheng.PET/CT Center,Hubei Cancer Hospital,Wuhan 430079,China
Qiu Dasheng,Email: hbpetct@163.com
Ultrasound,computed tomography (CT),magnetic resonance imaging (MRI),positron emission tomography CT (PET/CT) and positron emission tomography MR (PET/MR) are widely used in the diagnosis and treatment of colorectal liver metastases (CRCLM).Contrast-enhanced MR was the first choice in diagnosis of CRCLM by NCCN guidline.But it is important to choose the appropriate imaging modalities for each patient with CRCLM,and rationally use the limited medical resource.Combined with the literature and the authors experience in MDT.On the basis of reference to guidline and combined the patientʹs own conditions,it could made reasonable decisions by multidisciplinary experts discussion for patients with liver metastases from colorectal cancer.
Colorectal neoplasms;Neoplasm Metastasis;Liver;Imaging diagnosis
2016-06-18)
(本文编辑:杨明)
10.3877/cma.j.issn.2095-3224.2016.05.004
430079湖北省肿瘤医院PET/CT中心
邱大胜,Email:hbpetct@163.com
邱大胜.结直肠癌肝转移影像诊断策略[J/CD].中华结直肠疾病电子杂志,2016,5(5):386-389.
