表皮生长因子受体表达与结直肠癌患者化疗耐药及预后的关系
2016-10-19谭志军刘玉莹李昌生杨彩云
谭志军 刘玉莹 李昌生 杨彩云
表皮生长因子受体表达与结直肠癌患者化疗耐药及预后的关系
谭志军刘玉莹李昌生杨彩云
目的研究表皮生长因子受体(epidermal growth factor receptor,EGFR)与结直肠癌(colorectal cancer,CRC)患者化疗耐药及预后的关系。方法采用免疫组化法分析2010年4月至2012年9月寿光市人民医院37名CRC患者肿瘤组织中EGFR表达强度,采用复合评分系统(0~9)进行评价,并分析其与不同临床病理特征及化疗耐药之间的关系。结果高分化、中分化、低分化CRC肿瘤组织及正常结直肠组织EGFR表达阳性率分别为25%、56.25%、84.62%和16.67%。低分化、中分化CRC患者EGFR阳性表达率与高分化CRC和正常直肠组织相比,差异有统计学意义(χ2=8.576,P=0.003)。37名患者中EGFR强表达率为67.57%。EGFR强表达与CRC临床分期(χ2=4.68,P=0.030)及化疗反应率(χ2=7.27,P=0.007)显著相关。结论EGFR强表达(复合评分≥6)预示化疗反应率低,可能成为CRC化疗耐药的预测指标。
结直肠肿瘤;预后;表皮生长因子受体;化疗耐药
结直肠癌(colorectal cancer,CRC)好发于直肠与乙状结肠交界处,属于常见消化道恶性肿瘤之一。其全球每年新增患者约40万例,在世界范围内,仍是癌症死亡的主要原因之一。在过去几十年中,由于5-氟尿嘧啶(5-FU)、伊立替康(Irinotecan)、奥沙利铂(Oxaliplatin)、卡培他滨(Capecitabine)及分子靶向药物西妥昔单抗(Cetuximab)和贝伐珠单抗(Bevacizumab)等抗肿瘤药物的广泛应用,CRC患者的中位生存期已由12个月延长至月21个月[1-2]。
然而,肿瘤治疗中的化疗耐药及患者预后差仍是目前化疗药物普遍存在问题。临床上死于不同程度耐药的肿瘤患者约占90%以上。其中部分患者属于先天性耐药(nature resistance),另一部分患者属于用药过程中逐渐产生耐药,即获得性耐药(acquired resistance)。近年来国内外学者已对直肠癌耐药机制及预后标志物进行了广泛的研究。CXCL10/CXCR3[3]、X-连锁凋亡蛋白(X-linked inhibitor of apoptosis protein)[4]等可用于预测CRC耐药的生物标志物相继被发现。胸苷磷酸化酶(thymidine phosphorylase,TS)、缺氧诱导因子1α(hypoxia-inducible factor-1α)等则被发现与CRC预后存在关联[5]。
表皮生长因子受体(epithelial growth factor receptor,EGFR)是一个170 kDa的跨膜糖蛋白受体酪氨酸激酶,已在多种癌症中被检测到,被证明与乳腺癌、卵巢癌、膀胱癌、食道癌、子宫颈癌和头颈癌等的预后及临床进展相关[6]。因此,本文对CRC患者肿瘤组织中EGFR的表达与化疗耐药及预后的相关性进行临床实证研究,以期为临床治疗方案的制定及药物研发提供科学依据。
资料与方法
一、一般资料
选取2010年4月至2012年9月经寿光市人民医院病理科专家诊断证实为原发性CRC患者肿瘤组织标本共37例,其中男性30例,女性7例,患者年龄为26~72岁,平均年龄为45.2±10.1岁。其中高分化CRC 8例、中分化CRC 16例,低分化CRC 13例。所有患者术前均未接受放、化疗及免疫治疗,术后给予3个疗程以上以5-FU/亚叶酸钙为基础的联合治疗方案。另取同期6例正常直肠组织作对照。
二、病理切片制备及免疫组化分析
患者肿瘤组织切除后,以10% pH中性福尔马林固定,梯度乙醇脱水(TKY-TSC生物组织智能脱水机,孝感市泰医疗设备有限责任公司),石蜡包埋(TKY-BMA 型石蜡包埋机,孝感市泰医疗设备有限责任公司),修蜡,切5 μm薄片(MICROM HM 315型切片机,美康仪器设备北京有限公司),脱蜡,水化。
免疫组化分析根据参考文献方法[7]略作修改。切片以0.3%过氧化氢甲醇溶液浸泡30 min阻断内源性过氧化物酶活性,然后采用含0.01 mol/L柠檬酸钠缓冲液(pH 6.0,99℃)浸渍40 min以修复抗原。EGFR/113小鼠一抗(上海起发实验试剂有限公司)作为一抗,稀释比例为1:20,室温下孵育60 min;随后采用生物素标记亲和纯化山羊抗小鼠IgG二抗(上海研卉生物科技有限公司)和辣根过氧化物酶-链霉亲和素偶联物(上海鲁汶生物科技有限公司)孵育。DAB显色,苏木紫复染,脱水,透明,OLYMPUS BX-41显微镜观察。阴性对照为磷酸盐缓冲液,阳性对照为已知CRC阳性切片。
三、EGFR表达评分
光学显微镜下对病理切片进行观察计数,按照如下标准进行评价。
阳性结果判定标准:肉眼观察过氧化物沉积物颜色(淡黄色至深褐色),EGFR阳性表达定位于细胞膜和/或胞浆,以染色为淡黄色至深褐色为阳性,未染色为阴性(0),染为淡黄色为弱阳性(1),褐黄色为阳性(2),深褐色为强阳性(3)。
阳性细胞数判定标准:按照阳性细胞占肿瘤细胞总数的比例划分为0:无阳性细胞;1:占1%~24%;2:占25%~50%;3:>50%。
以阳性结果评分与阳性细胞数判定评分乘积作为EGFR表达复合得分,范围为0~9。复合得分<6视为EGFR低表达,复合得分≥6视为EGFR高表达。
四、化疗反应评定
患者完成3疗程化疗后进行化疗反应评定,化疗结束后至少随访1~2年。疗效评价由盆腔CT检查、B超检查、癌胚抗原(carcinoembryonic antigen,CEA)测定进行判断。检查频率为每3~4月一次。参考世界卫生组织标准分级如下[8]:(1)临床完全缓解(complete response,CR):临床症状消失,盆腔检查及B超检查均无包块,CEA值下降至正常;(2)临床部分缓解(partial response,PR):临床症状消失,病灶缩小>50%,无疾病进展表现,CEA值较术前明显下降但未达正常;(3)临床无效:临床症状存在,病灶缩小<50%,盆腔检查及B超检查有包块,病灶增大或复发,CEA值未下降或下降后再升高、病情在3个月内急剧加重,视为临床无效。
五、统计学分析
实验结果采用SPSS17.0进行分析。EGFR表达(<6或≥6)、主要临床指标及化疗反应率比较采用χ2检验进行分析。P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
结 果
一、CRC患者肿瘤组织的EGFR表达
CRC肿瘤组织及正常直肠组织EGFR表达的复合评分(阳性结果评分与阳性细胞数判定评分的乘积)见表1,其中强阳性表达(≥6)为57.57%。而高分化、中分化、低分化CRC肿瘤组织及正常直肠组织EGFR表达阳性率分别为25%、56.25%、84.62%和16.67%。中分化、低分化CRC肿瘤组织与高分化CRC及正常直肠组织EGFR表达阳性率相比差异均具有统计学意义(χ2=8.576,P<0.05)。37名CRC患者中,强阳性患者(≥6)及弱阳性患者(<6)分别为25名(67.57%)、12名(32.43%)。
肿瘤组织中EGFR表达的典型病理图片见图1。由图1可见,CRC患者肿瘤组织的胞浆中EGFR表达呈显著阳性特征。
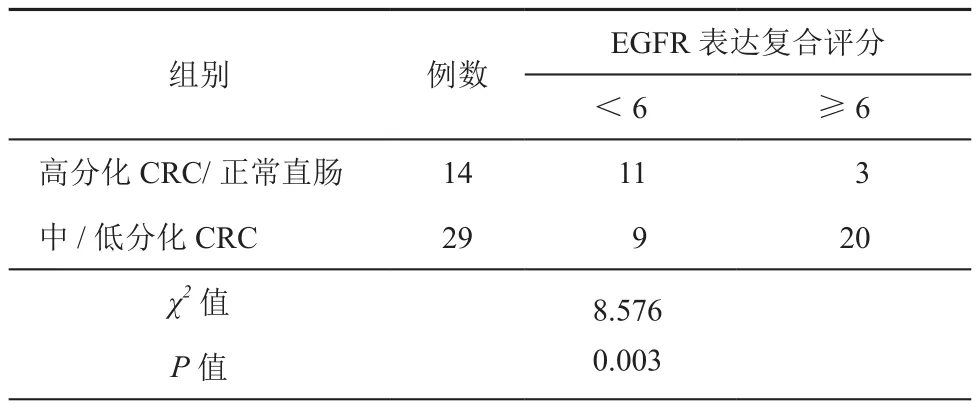
表1 CRC患者肿瘤组织及正常直肠组织中的EGFR表达(例)
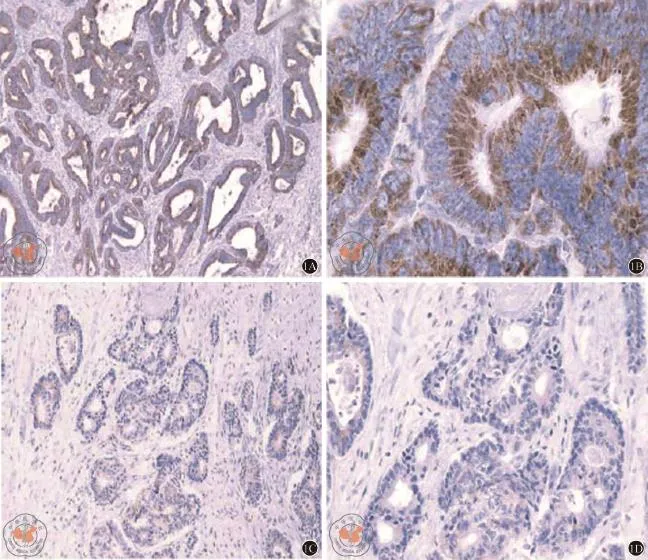
图1 CRC肿瘤组织中EGFR的表达(×100)。A、B:胞浆EGFR表达为强阳性;C、D:胞浆EGFR表达为阳性
二、EGFR表达与CRC患者临床病理特征的关系
化疗结束后对患者进行了为期1~2年的随访,随访至患者死亡或2014年12月。随访率97.4%,患者平均随访时长为14个月。采用单因素分析比较了EGFR表达复合评分与CRC患者临床病理特征间的关系。由表2可见,CRC患者EGFR表达复合评分与患者年龄、性别、肿瘤细胞分化程度、是否淋巴转移、瘤径及CEA水平无关,差异无显著性(P>0.05),但与CRC临床分期相关(P<0.05),M期、Ⅳ期肿瘤组织中EGFR强阳性表达率显著高于Ⅰ~Ⅲ期(χ2=4.68,P<0.05),且分期越晚EGFR强阳性表达率越高。
三、EGFR表达与CRC患者化疗反应率的关系
37名患者中,EGFR强阳性表达者为25名,对化疗有效9名,化疗反应率36%;EGFR弱阳性表达者为12名,对化疗有效10名,化疗反应率83%;两组比较差异具有显著统计学意义(χ2=7.27,P=0.007)。
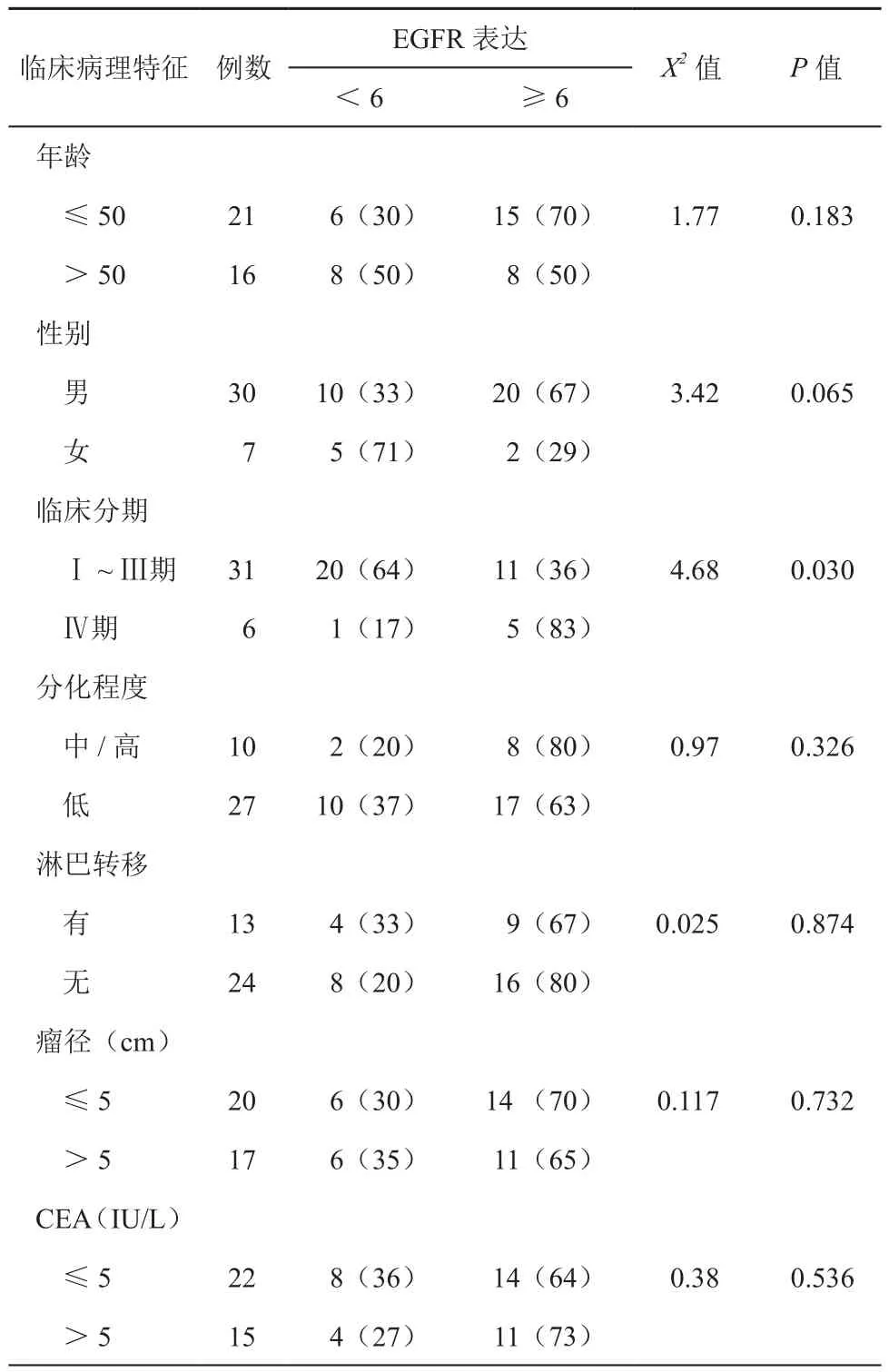
表2 EGFR表达与CRC患者临床病理特征的关系[例(%)]
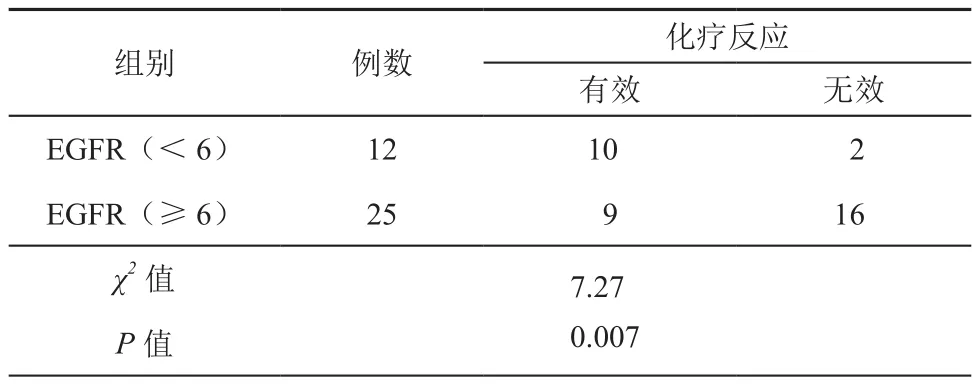
表3 EGFR表达与CRC患者化疗反应率的关系(例)
讨 论
本研究测定了CRC患者肿瘤组织EGFR免疫组化反应活性,并分别采用卡方检验和费舍尔精确检验分析了EGFR表达强度(<6或≥6)与CRC组织学特征、临床特征及化疗反应率间的关系。
EGFR在多种肿瘤中均存在过表达现象,其在CRC中的过表达尤为突出,据报道CRC患者肿瘤组织中EGFR表达率约为25%~77%,且多数与预后不良相关[9]。其中EGFR表达率的报道数据差异较大,在一定程度上与EGFR定量测定方法差异有关。免疫组化法虽然存在重复性差等问题,但仍是目前用于评价EGFR表达的常用方法之一[10]。目前评价EGFR阳性表达通常采用阳性结果评分和阳性细胞数评分两种独立的评分系统,为更为准确的反应EGFR阳性表达的范围及程度,本研究采用了复合评分系统[11]。EGFR阳性表达率结果显示:EGFR在低分化和中分化肿瘤CRC组织中的阳性表达率显著高于高分化肿瘤组织及正常对照组织,表明EGFR过表达与CRC的发病及进展存在一定关联。其中强阳性表达(≥6)为57.57%,与文献报道相一致[9]。
患者年龄、性别、肿瘤细胞分化程度、临床分期、是否淋巴转移、瘤径、静脉浸润及CEA等可能与CRC患者预后相关,但相关程度尚存在争议[12],其中临床分期、浸润深度等被认为属于CRC患者预后的独立影响因素。
Li等[13]研究表明,CRC患者肿瘤组织Bcl-2、B7-H1、EGFR、VEGF表达水平均与年龄、肿瘤浸润程度等无关,其中B7-H1与肿瘤分期显著相关,但其EGFR评分为非复合评分。Jiang等[14]通过Meta分析显示,EGFR表达与CRC患者预后相关及生存期相关。
化疗耐药是目前癌症药物治疗普遍存在的问题,近年来研发并进入临床应用的EGFR拮抗剂类药物如西妥昔单抗和帕尼单抗在CRC治疗中显示了良好的疗效,但目前也已出现获得性耐药,通常在治疗开始后第3~12个月患者即出现耐药[13]。Misale等[14]研究表明,抑制EGFR表达可抑制CRC患者一过性耐药,说明EGFR过表达与CRC患者的化疗耐药存在相关性。本研究中发现,EGFR表达复合评分与化疗反应率显著相关,EGFR强表达(≥6)的肿瘤组织,其化疗反应率显著低于弱表达的肿瘤组织,与上述报道相符。
由于肿瘤药物作用机理复杂,且体内存在Ras/ Raf/MEK/ERK/MAPK通路、PI3K/PDK1/Akt(PKB)通路、PLC-C通路、JAK/STAT通路等多条EGFR信号转导通路,因此,目前尚无法阐明EGFR导致化药耐药的详细机制。关于EGFR致化药耐药的机制有待进一步研究。
[1]Shaza L,Charette N,Hendlisz A.Colorectal cancer:ten years of illusion of progress but advances are on the horizon[J].Rev Med Brux,2015,36(4):263-266.
[2]Jawed I,Wilkerson J,Prasad V,et al.Colorectal Cancer Survival Gains and Novel Treatment Regimens:A Systematic Review andAnalysis[J].JAMA Oncol,2015,1(6):787-795.
[3]Bai M,Chen X,Ba YI.CXCL10/CXCR3 overexpression as a biomarker of poor prognosis in patients with stage II colorectal cancer[J].Mol Clin Oncol,2016,4(1):23-30.
[4]Lech G,Słotwiński R,Słodkowski M,et al.Colorectal cancer tumour markers and biomarkers:Recent therapeutic advances[J].World J Gastroenterol,2016,22(5):1745-1755.
[5]Bai W,Wu Y,Zhang P,et al.Correlations between expression levels of thymidylate synthase,thymidine phosphorylase and dihydropyrimidine dehydrogenase,and efficacy of 5-fluorouracil-based chemotherapy for advanced colorectal cancer[J].Int J Clin Exp Pathol,2015,8(10):12333-12345.
[6]Choi YS,Park M,Kwon HJ,et al.Human Papillomavirus and Epidermal Growth Factor Receptor in Oral Cavity and Oropharyngeal Squamous Cell Carcinoma:Correlation With Dynamic Contrast-Enhanced MRI Parameters[J].AJR Am J Roentgenol,2016,206(2):408-413.
[7]Khan H,Gupta S,Husain N,et al.Correlation between expressions of Cyclin-D1,EGFR and p53 with chemoradiation response in patients of locally advanced oral squamous cell carcinoma[J].BBA Clin,2014,3:11-17.
[8]Jorgensen ML,Young JM,Dobbins TA,et al.Predictors of variation in colorectal cancer care and outcomes in New South Wales:a population-based health data linkage study[J].Med J Aust,2014,200(7):403-407.
[9]Pabla B,Bissonnette M,Konda VJ.Colon cancer and the epidermal growth factor receptor:Current treatment paradigms,the importance of diet,and the role of chemoprevention[J].World J Clin Oncol,2015,6(5):133-141.
[10]Van Emburgh BO,Sartore-Bianchi A,Di Nicolantonio F,et al.Acquired resistance to EGFR-targeted therapies in colorectal cancer[J].Mol Oncol,2014,8(6):1084-1094.
[11]Dréanic J,Maillet M,Dhooge M,et al.Prognostic value of the Glasgow Prognostic Score in metastatic colorectal cancer in the era of anti-EGFRtherapies[J].Med Oncol,2013,30(3):656.
[12]Droeser RA,Hirt C,Eppenberger-Castori S,et al.High myeloperoxidase positive cell infiltration in colorectal cancer is an independent favorable prognostic factor[J].PLoS One,2013,8(5):e64814.
[13]Li XF,Liu XF,Yang YY,et al.Correlation study of Bcl-2,B7-H1,EGFR,VEGF and colorectal cancer[J].Am J Cancer Res,2015,5(7):2277-2284.
[14]Misale S,Bozic I,Tong J,et al.Vertical suppression of the EGFR pathway prevents onset of resistance in colorectal cancers[J].Nat Commun,2015,2515(6):305.
Impact of EGFR expression on chemoresistance and prognosis of colorectal cancer patients
Tan Zhijun,Liu Yuying,Li Changsheng,Yang Caiyun.Department of General Surgery,People′s Hospital of Shouguang,Shouguang 262700,China
Tan Zhijun,Email: 13963668120@163.com
ObjectiveTo investigate the impact of EGFR expression on chemoresistance and prognosis of colorectal cancer.MethodsEGFR expression was analyzed by immunohistochemistry,CRC tumor tissues were collected from 37 patients of Peopleʹs Hospital of Shouguang.A complex score (0~9) was used to evaluated the EGFR immunohistochemical reactivity.Relationship among EGFR strong expression (score≥6),clinico-histological features and chemotherapy response rate were analyses.ResultsEGFR positive rates in high,middle,low differentiation CRC specimens and normal rectal tissues were 25%,56.25%,84.62% and 16.67%,respectively.EGFR positive rates in middle and low differentiation CRC specimens were significant higher than that in the high differentiation ones and normal rectal tissues (χ2=8.576,P=0.003).EGFR was high expressed in 37 patient (67.57%).Both CRC clinical stage (χ2=4.68,P=0.030) and chemotherapy response rate (χ2=7.27,P=0.007) showed significant correlation with EGFR expression.ConclusionsEGFR expression levels in CRC tumor tissues may be used to predict the chemoresistance of CRC.
Colorectal neoplasms;Prognosis;EGFR;Chemoresistance
2016-06-20)
(本文编辑:杨明)
10.3877/cma.j.issn.2095-3224.2016.05.007
262700山东省寿光市人民医院普外科
谭志军,Email:13963668120@163.com
谭志军,刘玉莹,李昌生,等.表皮生长因子受体表达与结直肠癌患者化疗耐药及预后的关系[J/CD].中华结直肠疾病电子杂志,2016,5(5):405-409.
