全反式维甲酸联合三氧化二砷治疗初诊急性早幼粒细胞白血病的疗效及对复发率的影响分析
2016-10-18黄垚刘烨王玮
黄垚 刘烨 王玮
西安市第九医院血液科,西安 710054
全反式维甲酸联合三氧化二砷治疗初诊急性早幼粒细胞白血病的疗效及对复发率的影响分析
黄垚#刘烨王玮
西安市第九医院血液科,西安710054
目的探讨应用三氧化二砷(AS2O3)联合全反式维甲酸(ATRA)与单用ATRA对初发急性早幼粒细胞白血病(APL)诱导治疗的临床疗效及对复发率的影响。方法回顾性分析接受规律治疗的初治120例APL患者的临床资料,所有患者按治疗方法不同分为观察组和对照组,每组60例。观察组予ATRA口服联合AS2O3静脉滴注治疗,对照组仅予ATRA口服治疗,根据外周血白细胞数、肝功能以及临床症状调整药物用量,均治疗直至完全缓解(CR)。观察诱导治疗阶段CR率和早幼粒白血病基因和维甲酸受体基因融合基因(PML-RARα)转阴所需时间和不良反应,巩固化疗后3年总生存率(OS)和复发率,同时分析白细胞水平对预后的影响。结果观察组早期病死率、CR率与对照组比较差异无统计学意义(P>0.05),达到CR时间少于对照组(P<0.05);观察组PML-RARα转阴率和总生存率高于对照组,复发率低于对照组(P<0.05);选取观察组57例患者分析白细胞水平对预后的影响,WBC≥10×109/L患者复发率、病死率、未缓解(NR)率与WBC<10×109/L患者比较,差异无统计学意义(P>0.05),CR率与总生存率则低于WBC<10×109/L患者。结论AS2O3联合ATRA治疗初发APL的疗效较好,达到CR时间缩短,预后提高,白细胞水平对APL的预后有一定影响,导致CR率与总生存率降低。
急性早幼粒细胞白血病;三氧化二砷;维甲酸
Prog,2016,14(7)
急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)是一种特殊类型的急性髓系白血病(acute myeloid leukemia,AML),其发病率占成人白血病的10%~15%,伴有15号和17号染色体易位形成PML-RARα融合基因(promyelocytic leukemia-retinoic acid receptor,PML-RARα)。由于其早期出血倾向以及化疗后大量白血病细胞死亡脱落导致的弥漫性血管内凝血(disseminated intravascular coagulation,DIC)使其早期死亡率较高[1]。其治疗过程包括三个阶段:诱导缓解、巩固化疗和维持治疗,治疗时间为2~3年[2]。研究显示,联合全反式维甲酸(all-transretinoic acid,ATRA)和三氧化二砷(arsenic trioxide,AS2O3)单药治疗APL,均可达到较高的缓解率,其中应用ATRA对APL进行诱导分化完全缓解(CR)率可达90%~94%。APL在起病时多表现为三系减少,20%~25%的患者初诊时的外周血白细胞计数>10×109/L,该类患者在早期诱导治疗中易发生DIC等并发症,影响预后[3]。近年来发现ATRA和AS2O3双诱导治疗APL的临床疗效值得肯定,本研究对120例接受规律治疗的初治APL患者,观察诱导治疗阶段CR率和达到CR的时间以及预后,为进一步推广应用提供依据。
1 资料与方法
1.1一般资料
选取西安市第九医院2005年6月至2013年6月收治的120例接受规律治疗的初治APL患者,对其临床资料进行回顾性分析。纳入标准:初治病例。符合白血病诊断分型中的AML-M3型[4]:①临床表现为发热、出血、黏膜苍白以及淋巴结肿大、胸骨压痛等;②实验室检查:血象示三系减少或白细胞明显增多,外周血提示幼稚细胞增多,骨髓象提示早幼粒细胞≥20%;③基因检测:PML-RARα融合基因及其变异型阳性。排除标准:复发病例;治疗1周内死亡;合并有严重疾病和严重肝肾功能损害的患者;未规律治疗病例,中途退出。按治疗方法不同分为观察组和对照组,每组60例。对照组男36例,女24例,年龄13~75岁,平均(31.4±5.6)岁,血常规示白细胞数为(0.9~176.4)×109/L,平均12.7×109/L,白细胞数大于10×109/L 11例,占35%,凝血象示APTT为19~43.2 s,平均28.8 s;骨髓象示早幼粒细胞为31%~74.5%,增生极度活跃。观察组男34例,女26例,年龄11~78岁,平均(33.4± 6.9)岁,血常规示白细胞数为(0.8~179.4)×109/L,平均13.2×109/L,白细胞数大于10×109/L 13例,占38.3%;凝血象示APTT为18~45.7 s,平均27.5 s;骨髓象示早幼粒细胞为33%~76.5%,增生极度活跃。两组患者性别、年龄、白细胞水平、APTT及骨髓象早幼粒细胞比例等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究获得我院伦理委员会批准,所有患者知情同意。
1.2方法
1.2.1诱导缓解治疗[5]确诊后观察组予AS2O30.16 mg(/kg·d)静脉滴注,每天1次,每次4 h,同时予ATRA 25 mg(/m2·d)口服,每天分3次服用;对照组仅予ATRA口服治疗,剂量方法同观察组。两组均治疗28 d以上,直至CR。每3天查一次血常规,每周查一次肝功能,对于白细胞数>10×109/L患者则加用羟基脲2 g口服或小剂量阿糖胞苷静脉滴注以降低白细胞,对于治疗中白细胞过高的患者可以加用糖皮质类激素以防止发生诱导分化综合征。
1.2.2缓解后巩固化疗[6]两组诱导缓解达到CR后,采用化疗联合ATRA治疗,其中化疗方案为DA、HA、AA交替化疗。DA方案:柔红霉素(dau norubicin rubidomycin,DNR)45~60 mg(/m2·d)×3 d,阿糖胞苷(cytosine arabinoside,Ara-C)100~200 mg(/m2·d)×7 d;MA方案:甲硝唑(metronidazole,MTZ)10~15 mg/(m2·d)×3 d,Ara-C 100~200 mg(/m2·d)×7 d;HA方案:高三尖杉酯碱(homoharringtonine,HHT)1.5~2.5 mg/(m2·d)×7 d,Ara-C 100~200 mg(/m2·d)×7 d。每月1次,完成10次治疗后停止治疗,予氨甲蝶呤(methotrexate,MTX)+Ara-C+地塞米松(dexamethasone,DXM)三联鞘注预防中枢神经系统白血病(central nervous system leukemia,CNSL)。
1.2.3支持治疗诱导治疗时,肝功能异常者考虑加强保肝治疗,积极治疗原发病,根据患者血常规、凝血象及时输注红细胞悬液、单采血小板和新鲜冰冻血浆。注意患者发热时积极查找病原学依据,经验性抗感染治疗,及时调整抗生素的应用。
1.3观察指标及评价标准
参考《血液病诊断及疗效标准(第3版)》[7]进行诊断及疗效判定,观察诱导治疗阶段完全缓解(CR)率。采用RT-PCR检测PML-RARα是否转阴并记录转阴所需时间。记录患者不良反应情况,早期死亡定义为在接受治疗后20 d内死亡;白细胞增高定义为治疗过程中白细胞数>10×109/L;复发标准:骨髓原粒+早幼粒细胞为5%~20%,进行1个疗程治疗后未达到CR标准者,骨髓外白血病细胞浸润者;CR诊断标准:外周血白细胞分类中无白血病细胞,血红蛋白、白细胞和血小板均在正常范围,原粒+早幼粒细胞<5%,红系和巨核细胞系正常。注意观察患者有无头痛、恶心及呕吐、颅内出血、消化道出血、骨及关节痛、水肿、黏膜干燥、溃疡及出血以及维甲酸综合征等不良反应的发生。巩固化疗后随访3年,计算总生存率(OS)和复发率,同时分析白细胞水平对预后的影响。
1.4统计学方法
采用SPSS 16.0统计软件对数据进-行统计分析,正态分布计量资料以均数±标准差(x±s)表示,采用t检验;非正态分布计量资料采用秩和检验;计数资料以率(%)表示,采用χ2检验或Fisher精确概率法,P<0.05为差异有统计学意义。
2 结果
2.1两组患者临床疗效比较
观察组早期死亡和CR例数分别为3例(5.0%)和52例(86.7%),其中2例死于颅内出血,1例死于DIC;而对照组早期死亡和CR例数分别为2例(3.3%)和51例(85.0%),其中1例死于颅内出血,1例死于维甲酸综合征,两组比较,差异均无统计学意义(P>0.05)。观察组达到CR时间为(21.4±6.5)d,明显少于对照组的(34.5±7.6)d,差异有统计学意义(P<0.05)。
2.2两组CR患者预后比较
观察组PML-RARα转阴率和总生存率均高于对照组,复发率低于对照组,差异均有统计学意义(P<0.05)。(表1)
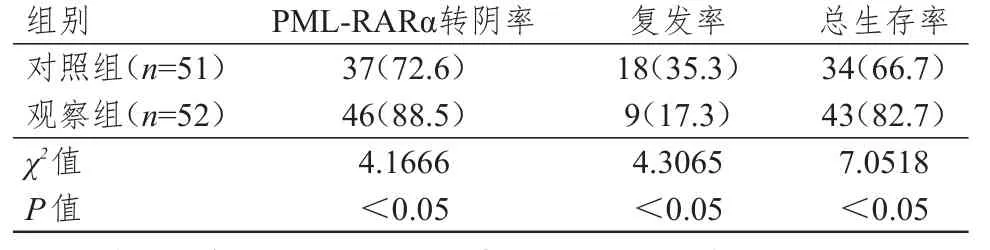
表1 两组CR患者预后比较[n(%)]
2.3白细胞水平对APL患者预后影响
选取观察组57例患者分析白细胞水平对预后的影响,WBC≥10×109/L患者复发率、病死率、未缓解(non-remission,NR)率与WBC<10×109/L患者相比,差异无统计学意义(P>0.05),CR率与总生存率则低于WBC<10×109/L患者,差异有统计学意义(P<0.05)。(表2)
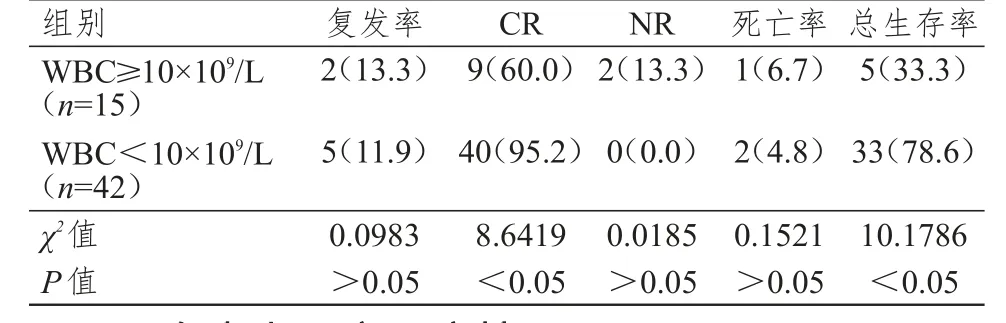
表2 白细胞水平对APL患者预后的影响[n(%)]
2.4所有患者不良反应情况
患者治疗过程中不良反应轻微,大多数患者能耐受。入院时肝功正常用砷剂后出现转氨酶升高患者12例,均在用护肝药或停用砷剂后转氨酶恢复正常。3例患者出现恶心呕吐等消化道不良反应,予对症处理后可缓解。全部患者均未出现严重骨髓抑制、中枢神经系统白血病及慢性砷中毒表现。
3 讨论
急性早幼粒细胞白血病(APL)自应用ATRA和AS2O3以来,已经成为白血病中疗效最好的亚型。APL有特征性的染色体,即15号和17号染色体易位融合的PML-RARa基因,ATRA直接与异常PMLRARα结合,抑制其转录表达,从而使肿瘤细胞正常分化成熟,AS2O3可下调APL细胞中抑制细胞凋亡的bcl-2基因表达,从而诱导细胞凋亡[8-9]。单用ATRA或AS2O3诱导化疗,CR率为92%~93%,近年来发现ATRA和AS2O3两种药物联用具有协同作用,双诱导治疗APL可以更快地达到CR[10]。
由于APL特有的DIC表现及诱导分化综合征的存在,导致患者早期病死率极高,对于初诊时的外周血白细胞计数>10×109/L的患者早期病死率可达10%~20%[11]。本研究中,ATRA联合AS2O3治疗APL的早期死亡和CR例数分别为3例(5.0%)和52例(86.7%),其中2例死于颅内出血,1例死于DIC,而ATRA单药组分别为2例(3.3%)和51例(85.0%),其中1例死于颅内出血,1例死于DIC,差异无统计学意义(P>0.05);ATRA联合AS2O3达到CR时间为(21.4±6.5)d,明显少于ATRA单药组(34.5±7.6)d,差异有统计学意义(P<0.05)。ATRA的缺点是达CR时间较长,维甲酸综合征发生可能性更高,加用AS2O3可以减少出血、维甲酸综合征的发生,使CR时间缩短,未发生维甲酸综合征。
已有研究发现,将全反式维甲酸单独用于治疗急性早幼粒细胞白血病,虽取得一定疗效,但早期复发率和高白细胞血症的发生率均较高,为克服单独用药的不足和缺陷,已有大量研究进行了探索,试图将全反式维甲酸与其他药物联合进行治疗,取得了一定疗效,三氧化二砷是一种具有代表性的药物。将三氧化二砷联合全反式维甲酸用于治疗早幼粒细胞白血病具有较好疗效,CR可达85%[12]。此外,还有学者在小鼠模型上进行了试验,发现当使用低浓度三氧化二砷时,主要起到诱导分化的作用,当浓度达到一定剂量时可起到诱导凋亡的作用,对其机制进行研究探讨发现,可能是通过降解PML/RARα融合蛋白来发挥其生理作用,且两者具有协同作用[13]。
本研究发现,ATRA联合AS2O3治疗APL的预后效果更好,PML-RARα转阴率和总生存率分别为88.5%和82.7%,高于ATRA单药组72.6%和66.7%;复发率为17.3%,明显低于ATRA单药组35.3%。取ATRA联合AS2O3治疗组57例分析白细胞水平,WBC≥10×109/L患者复发率、死亡率、NR与WBC<10×109/L患者相比,差异无统计学意义(P>0.05),CR与总生存率则明显低于WBC<10×109/L患者,差异有统计学意义(P<0.05)。治疗过程中不良反应轻微,大多数患者能耐受,入院时肝功正常用砷剂后有转氨酶升高的有12例,患者均可在用护肝药或停用砷剂转氨酶正常;3例患者出现恶心呕吐等消化道症状,予对症处理后可缓解;全部患者均未出现严重骨髓抑制、中枢神经系统白血病及慢性砷中毒表现,提示良好的应用前景。
综上所述,AS2O3联合ATRA的协同作用治疗初发APL的疗效较好,达到CR时间缩短,预后提高,不良反应少,白细胞水平对APL的预后有一定影响,导致CR率与总生存率降低。
[1]马向娟,任汉云,岑溪南,等.化疗、全反式维甲酸联合砷剂序贯治疗成人急性早幼粒细胞白血病疗效分析[J].中华血液学杂志,2010,31(5):328-332.
[2]Cheng Y,Zhang L,Wu J,et al.Long-term prognosis of childhood acute promyelocytic leukaemia with arsenic trioxide administration in induction and consolidation chemotherapy phases:a single-centre experience[J].Eur J Haematol,2013,91(6):483-489.
[3]Sanz MA,Iacoboni G,Montesinos P.Acute promyelocytic leukemia:do we have a new front-line standard of treatment[J].Curr Oncol Rep,2013,15(5):445-449.
[4]Lou Y,Qian W,Meng H,et al.Long-term efficacy of lowdose all-trans retinoic acid plus minimal chemotherapy induction followed by the addition of intravenous arsenic trioxide post-remission therapy in newly diagnosed acute promyelocytic leukaemia[J].Hematol Oncol,2014,32(1):40-46.
[5]Lou Y,Suo S,Tong H,et al.Characteristics and prognosis analysis of additional chromosome abnormalities in newly diagnosed acute promyelocytic leukemia treated with arsenic trioxide as the front-line therapy[J].Leuk Res,2013,37(11):1451-1456.
[6]Seftel MD,Barnett MJ,Couban S,et al.ACanadian consensus on the management of newly diagnosed and relapsed acute promyelocytic leukemia in adults[J].Curr Oncol,2014,21(5):234-250.
[7]张之南,沈悌.血液病诊断及疗效标准[M].3版.北京:科学出版社,2007:333-369.
[8]Efficace F,Mandelli F,Avvisati G,et al.Randomized phase III trial of retinoic acid and arsenic trioxide versus retinoic acid and chemotherapy in patients with acute promyelocytic leukemia:health-related quality-of-life outcomes[J].J Clin Oncol,2014,32(30):3406-3412.
[9]Shinagawa K,Yanada M,Sakura T,et al.Tamibarotene as maintenance therapy for acute promyelocytic leukemia:results from a randomized controlled trial[J].J Clin Oncol,2014,32(33):3729-3735.
[10]Ma H,Yang J.Insights into the all-trans-retinoic acid and arsenic trioxide combination treatment for acute promyelocytic leukemia:A meta-Analysis[J].Acta Haematol,2015,134(2):101-108.
[11]Long ZJ,Hu Y,Li XD,et al.ATO/ATRA/anthracyclinechemotherapy sequential consolidation achieves long-term efficacy in primary acute promyelocytic leukemia[J]. PLoS One,2014,9(8):e104610.
[12]Roldan CJ,Haq SM,Miller AH.Acute promyelocytic leukemia;early diagnosis is the key to survival[J].Am J Emerg Med,2013,31(8):1290.e1-1290.e2.
[13]Iland HJ,Seymour JF.Role of arsenic trioxide in acute promyelocytic leukemia[J].Curr Treat Opt Oncol,2013,14(2):170-184.
Analysis of the clinical efficacy and relapse rate of all-trans retinoic acid combined with arsenic trioxide on newly diagnosed acute promyelocytic leukemia
HUANG Yao#LIU Ye WANG Wei
Department of Hematology,Ninth Hospital of Xi'an,Xi'an 710054,Shaanxi,China
ObjectiveTo evaluate the clinical efficacy of induction therapy of arsenic trioxide(AS2O3)in combination with all-trans retinoic acid(ATRA)and ATRA treatment alone and the effect on relapse rate in newly diagnosed acute promyelocytic leukemia(APL).MethodThe clinical profile of 120 cases of newly diagnosed APL were included in the analysis,all patients were stratified as study group and control group according to respective treatment,with 60 cases in each.Oral ATRA and AS2O3i.v.were administered in study group,while oral ATRA alone was given in control group,dose adjustment was considered based upon peripheral WBC,liver function and clinical symptoms,until complete response(CR)was achieved.The CR rate and the time before PML-RARα turned negative,adverse reactions,3-year overall survival(OS)and relapse rate after consolidation chemotherapy,as well as the effect of WBC on the prognosis were all analyzed.ResultThe short-term morality and CR were similar between study group and control group(P>0.05),while the study group took less time to achieve CR than control group(P<0.05);PML-RARα negative rate and overall survival were both higher,and the recurrence rate was significantly lower in study group than that in control group(P<0.05);57 cases were included in WBC analysis,patients with WBC≥10×109had comparable relapse rate,mortality rate,NR rate with those with WBC<10×109,and the difference was not statistically significant(P>0.05),but the CR and overall survival rate was significantly lower in patients with higher WBC levels.ConclusionAS2O3in combination with ATRA was effective in treating newly diagnosed APL,with less time needed to achieve CR,and improved prognosis,besides,white blood cell is associated with the prognosis of APL,leading to lower CR rate and overall survival.
acute promyelocytic leukemia;arsenic trioxide;retinoic acid Oncol
R733.7
A
10.11877/j.issn.1672-1535.2016.14.07.14
2016-02-24)
(corresponding author),邮箱:15202903172@163.com
