脑活素联合微生态制剂治疗肝性脑病患者疗效观察*
2016-10-17陈振道陈浩
陈振道,陈浩
脑活素联合微生态制剂治疗肝性脑病患者疗效观察*
陈振道,陈浩
目的观察脑活素和微生态制剂联合治疗肝性脑病患者的临床疗效。方法选取2014年3月至2015年4月广东省化州市人民医院收治的76例肝性脑病患者,采用随机数字表法分为对照组和联合用药组,每组38例。给予对照组双歧杆菌乳杆菌三联活菌片,联合用药组则在给予微生态制剂的同时,给予脑活素静脉滴注。两组均观察28 d。采用干片法检测血氨水平,采用ELISA双抗体夹心法检测肿瘤坏死因子-α(TNF-α)水平;采用数字连接试验(NCT)和数字符号试验(DST)检测受试者智力能力。结果经过4周治疗后,对照组患者NCT和DST评分为(70.47±8.15)和(31.52±8.32),而联合用药组则分别为(41.06±6.61)和(56.89±9.23),联合用药组明显优于对照组,差异具有统计学意义(P<0.05);对照组血氨、ALT、TNF-α、TBIL分别为(69.71±19.56)μmol/L、(66.34± 15.82)U/L、(346.75±45.63)pg/ml和(51.32±8.77)μmol/L,而联合用药组则分别为(49.65±18.33)μmol/L、(58.48±12.66)U/L、(142.57±39.51)pg/ml和(40.19±8.24)μmol/L,联合用药组改善更明显,差异具有统计学意义(P<0.05)。结论脑活素联合微生态制剂治疗肝性脑病患者效果更为显著,值得临床进一步验证。
肝性脑病;脑活素;微生态制剂;治疗
肝性脑病(Hepatic encephalopathy,HE)是以代谢紊乱为主要特征的中枢神经系统功能失调综合征[1],多由急慢性肝功能严重失调或障碍引起,属各类型肝衰竭或失代偿期肝硬化等多类严重肝病的常见并发症[2],病死率高达35%~90%[3]。脑活素是动物脑蛋白提取的神经保护剂,对治疗中枢神经系统疾病具有良好的作用[4]。微生态制剂是指对宿主有益无害的微生物群经特殊加工而成的生态制剂,常用于调整消化系统微生态环境紊乱,治疗消化系统疾病[5,6]。我们观察了脑活素联合微生态制剂治疗肝性脑病患者的临床效果,现报告如下。
1 资料与方法
1.1一般资料我院2014年3月至2015年4月收治的肝性脑病患者76例,男39例,女37例;年龄34~69岁,平均年龄(43.3±2.1)岁。肝性脑病病因分别为慢加急性肝衰竭30例,失代偿期乙型肝炎肝硬化46例。诊断参考中华医学会消化病学分会2013年修订的《中国肝性脑病诊治共识意见》[7],其中Ⅰ期20例,Ⅱ期25例,Ⅲ期18例,Ⅳ期13例。
排除精神疾病、合并有其他严重的系统性疾病患者。采用随机数字表法将患者分为对照组38例和联合治疗组38例,两组患者年龄、性别、血氨、肝功能和HE分期均无显著性差异(P>0.05)。本研究获得我院医学伦理委员会批准。
1.2治疗方法两组患者均控制蛋白摄入,维持水电解质和酸碱平衡,持续低流量吸氧。给予对照组双歧杆菌乳杆菌三联活菌片(内蒙古双奇药业股份有限公司,批准文号S19980004)1.0口服或胃管注入,3次/d,治疗28 d;联合治疗组在对照组治疗的基础上,给予醒脑素(施普善注射液,奥地利依比威药物有限公司,批准文号H20100440)5 mL,加入10%葡萄糖溶液250 mL中静脉滴注,慢滴,1次/d,治疗28 d。
1.3观察指标采用干片法检测血氨水平(上海羽朵生物科技有限公司);采用ELISA双抗体夹心法检测肿瘤坏死因子-α(TNF-α)水平(上海科华生物工程股份有限公司);采用比色法测定血清谷丙转氨酶(ALT,上海信裕生物技术有限公司);采用改良J-G法测定血清总胆红素(TBIL,北京百奥莱博科技有限公司);采用溴甲酚绿法测定白蛋白(上海通蔚实业有限公司);使用中仪康辉国际贸易公司提供的CoaguChek XS检测仪测定INR;采用数字连接试验(Number connection test,NCT)记录患者连接数字所用的时间;采用数字符号试验(digit symbol test,DST)记录受试者90 s内写出的与数字对应的符号数。
1.4统计学方法应用SPSS 16.0统计软件处理,计量资料以(±s)表示,对正态分布的计量资料行t检验,P<0.05为存在显著性统计学差异。
2 结果
2.1两组NCT和DST评分变化经过4周治疗,联合用药组NCT和DST评分改善情况优于对照组,差异具有统计学意义(P<0.05,表1)。
2.2两组血氨、ALT和细胞因子水平变化经4周治疗,联合用药组血氨、ALT、TNF-α和TBIL改善优于对照组,差异均具有统计学意义(P<0.05,表2)。
2.3两组血清白蛋白和凝血功能指标比较见表3。
2.4并发症和转归情况对照组死亡16例,联合用药组死亡6例。
2.5不良反应本研究未出现严重不良反应。
表1 两组治疗前后NCT和DST评分(±s)比较
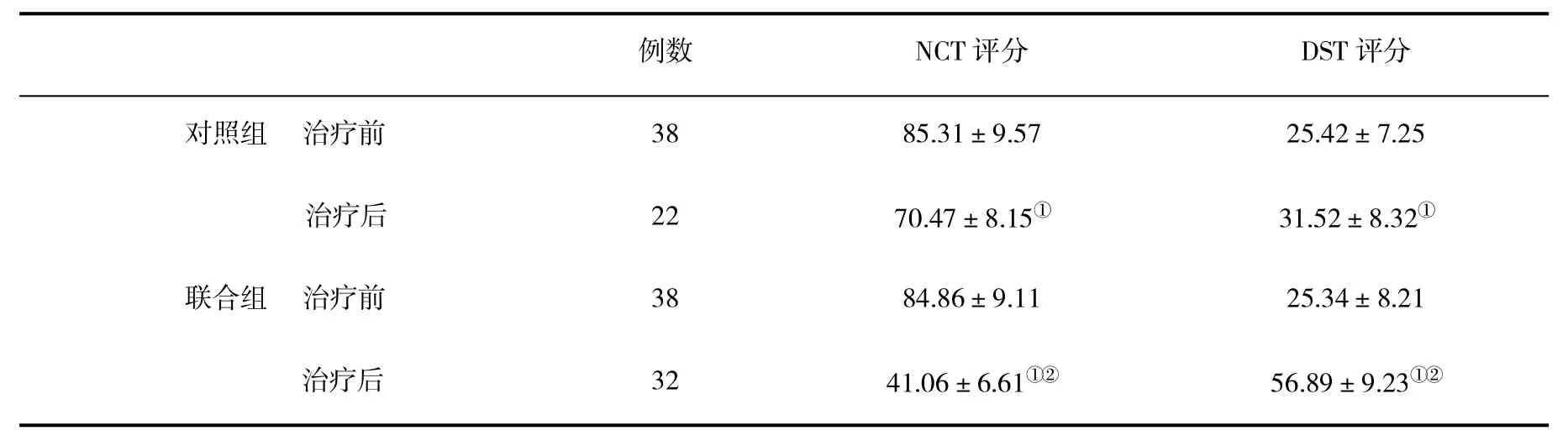
表1 两组治疗前后NCT和DST评分(±s)比较
与治疗前比,①P<0.05;与对照组比,②P<0.05
例数NCT评分DST评分对照组治疗前3885.31±9.5725.42±7.25治疗后2270.47±8.15①31.52±8.32①联合组治疗前3884.86±9.1125.34±8.21治疗后3241.06±6.61①②56.89±9.23①②
表2 两组治疗前后血氨、ALT和细胞因子水平(±s)比较
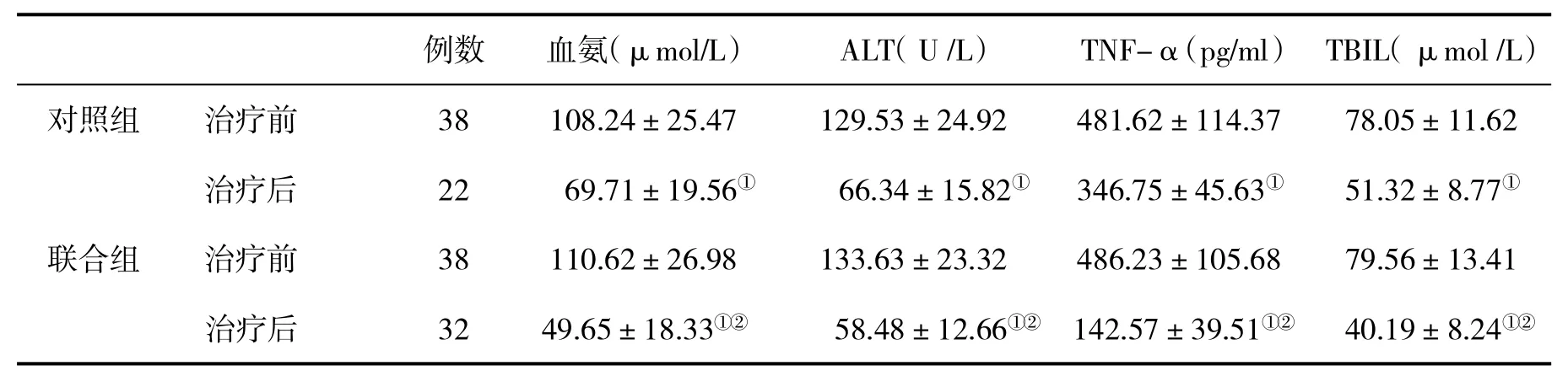
表2 两组治疗前后血氨、ALT和细胞因子水平(±s)比较
与治疗前比,①P<0.05;与对照组比,②P<0.05
例数血氨(μmol/L)ALT(U/L)TNF-α(pg/ml)TBIL(μmol/L)对照组治疗前38108.24±25.47129.53±24.92481.62±114.3778.05±11.62治疗后2269.71±19.56①66.34±15.82①346.75±45.63①51.32±8.77①联合组治疗前38110.62±26.98133.63±23.32486.23±105.6879.56±13.41治疗后3249.65±18.33①②58.48±12.66①②142.57±39.51①②40.19±8.24①②
表3 两组治疗前后血清ALB和INR水平(±s)比较
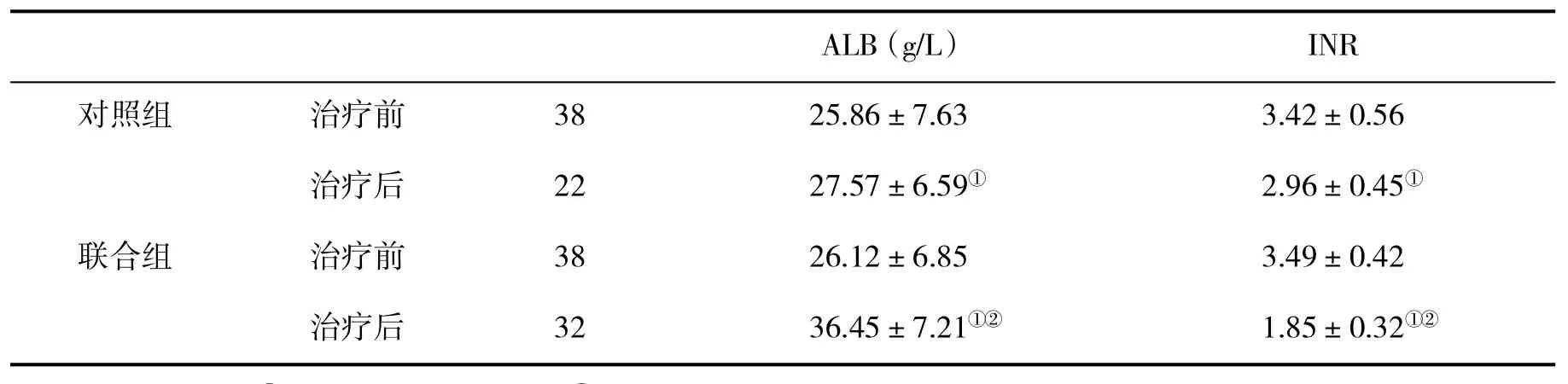
表3 两组治疗前后血清ALB和INR水平(±s)比较
与治疗前比,①P<0.05;与对照组比,②P<0.05
ALB(g/L)INR对照组治疗前3825.86±7.633.42±0.56治疗后2227.57±6.59①2.96±0.45①联合组治疗前3826.12±6.853.49±0.42治疗后3236.45±7.21①②1.85±0.32①②
3 讨论
肝性脑病作为一种肝脏严重病变后导致的神经异常综合征[8],是多种肝脏疾病常见的并发症和死亡原因,常表现为肝功能失调、代谢紊乱以及行为、智力、情感方面障碍为特征的中枢神经系统病变,对患者的身心健康造成巨大的伤害,也严重影响患者日常生活质量[9]。目前,对肝性脑病的发病机制有多种说法,包括氨中毒假说、γ-氨基丁酸/苯二氮(GABA/BZ)复合体假说、角质病假说、神经递质改变假说和锰中毒假说等等[10]。由于肝性脑病发病诱因复杂,多方面多手段治疗肝性脑病无疑是更适宜的治疗方案。
氨中毒假说是目前得到较多医学界认同的学说[11]。人体内的氨一般来自肠道细菌的分解产物,而HE患者由于胃肠道蠕动缓慢,菌群失调,常会导致血氨升高[12],肝脏是主要分解氨的器官,HE患者肝脏往往伴有严重的肝功能损害,代谢氨的能力严重下降,大量增加的氨进入血脑屏障,扰乱大脑运行代谢,造成中枢神经系统紊乱[13]。分解氨以及减少氨的产生无疑是治疗的关键,以往常用乳果糖类药物作为主要用药,但此类药物常会导致腹泻等不良反应。微生态制剂是指由微生物或促进微生物生长物质而制成有益菌制剂[14],常用的菌种有植物乳杆菌、地衣芽孢杆菌、枯草芽抱杆菌、双歧杆菌等。人体肠道内有高达10万亿的肠道菌群,HE患者肠道内往往菌群失去平衡,大量有害菌不断产生氨[15],大量的炎性介质通过门静脉到达肝脏,加重患者病情。微生态制剂可以补充和促进有益菌的生长,抑制有害菌生长,从而减少氨的产生[16],还可以使肠道的pH值降低,将氨变为难吸收的离子型铵排出体外,同时通过有益菌分解炎性介质,重塑HE患者已被破坏的肠道菌群,缓解氨和炎性介质等有害物质对患者肝脏及中枢神经系统的伤害[17]。
锰在人体内主要排泄器官为肝脏,以往研究表明,HE患者因肝功能受损,常会出现大量锰累积体内的情况。过量的锰沉积于肝脏,会降低三磷酸腺苷酶的活性,致肝脏的代谢受到破坏[18],还会导致胆红素分泌减少,并产生锰-胆红素络合物,进一步扰乱肝对锰的排泄。锰可以突破大脑的血脑屏障,破坏神经元,大量的锰会沉积于大脑基底节的星形胶质细胞,并破坏其中的线粒体,锰也会影响星形胶质细胞对谷氨酸的摄取,损害大脑的能量代谢[19],大量的锰还会加快神经类固醇的合成,增强γ-氨基丁酸的作用,导致中枢抑制效应。脑活素是一种提取自动物猪脑蛋白,由多种氨基酸组成的神经保护剂。其分子量低于10000,可突破血脑屏障,作用于脑部。脑活素可促进神经细胞蛋白合成,改善脑部的能量代谢[20],同时可以供应大量的氨基酸和脑蛋白,促进神经元的修复。脑活素还可以维护脑细胞线粒体结构的完整性,使到线粒体Ca2+超载减少,提高线粒体的活性,起到保护脑部线粒体的作用[21]。还可以促进脑细胞对葡萄糖和氧的吸收,增强脑部对锰的抵御力。此外,它还能减少自由基,具有抗炎的作用。脑活素对改善患者中枢神经系统的认知能力具有良好的疗效。
本研究联合用药组患者治疗后NCT和DST评分与治疗前比较均有明显的改善,而对照组则变化不大,说明脑活素可有效改善患者智力、行为、认知方面的能力。在血氨、ALT、TNF-α、TBIL改善方面,联合用药组也较对照组更明显。在肝性脑病的发病机制中,氨与锰存在一定的协同作用,均共同影响患者的星形胶质细胞,损害线粒体功能以及干扰脑部的正常能量代谢。脑活素与微生态制剂联合使用,既可以改善氨的产生和排泄,维护肝脏等消化系统的功能平衡,也减少了过量的氨对脑部的损害。同时,还可保护脑部神经元和线粒体,减少炎性介质的损害,恢复脑部正常代谢。两种药物联合使用,可分别治疗HE患者的中枢神经系统和消化系统病变,对引起HE的氨和锰两方面都能起到一定的疗效,改善了患者肝脏和脑部功能。可见脑活素与微生态制剂联合使用具备协同互补的作用,可更全面地治疗肝性脑病。
[1]中华医学会消化病学分会和肝病学分会.中国肝性脑病诊治共识意见(2013年,重庆).中华消化杂志,2013,33(9):581-592.
[2]Bajaj JS,Thacker LR,Heuman DM,et al.The Stroop smartphone application is a short and valid method to screen for minimal hepatic encephalopathy.Hepatology,2013,58(3):1122-1132.
[3]涂传涛.肝性脑病的诊断方法及其研究进展.实用肝脏病杂志,2009,12(2):158-160.
[4]万志荣,李继来.施普善(脑活素)对急性缺血性卒中的临床疗效研究.中华神经医学杂志,2011,10(11):1181-1183.
[5]覃燕玲.我院微生态制剂在慢性肝病治疗中的应用评价.实用药物与临床,2012,15(9):585-587.
[6]崔英.门冬氨酸鸟氨酸联合乳果糖治疗肝性脑病的疗效评价.中外医疗,2012,7(19):91-92.
[7]F erenci P,Lockwood A,Mullen K,et a1.Hepatic encephalopathy-definition,nomenclature,diagnosis,and quantification:final report of the working party at the 11 th World Congresses of Gastroenterology,Vienna,1998.Hepatology,2002,35(3):716-721.
[8]Mullen KD,Prakash RK.Management of covert hepatic encephalopathy.Clin Liver Dis,2012,16(1):91-93.
[9]白启轩,贾继东.肝性脑病的研究进展.现代消化及介入诊疗,2009,14(1):29-32.
[10]Bajaj JS,Cordoba J,Mullen KD,et a1.Review article:the design of clinical trials in hepatic encephalopathy-an International SocietyforHepaticEncephalopathyandNitrogenMetabolism(ISHEN)consensus statement.Aliment Pharmacol Ther,2011,33(7):739-747.
[11]Zheng G,Zhang LJ,Cao Y,et a1.Venous blood ammonia can be associated with cerebral blood flow in hepatic encephalopathy.Hepatology,2013,58(2):832-833.
[12]胡丽,欧阳义.纳洛酮联合门冬氨酸鸟氨酸治疗肝硬化并肝性脑病的临床研究.中国医学创新,2011,8(7):50-51.
[13]肖政,尹雄章,黄泽中.门冬氨酸鸟氨酸联合乳果糖治疗肝性脑病30例.医药导报,2103,32(5):623-625.
[14]陈诗焕.益生菌制剂对预防和治疗肝硬化患者发生并发症的影响.中国微生态学杂志,2008,20(3):277-278.
[15]秦庆福,李洪福.慢性肝病与肠道菌群的研究进展.中国微生态学杂志,2012,24(5):476-477.
[16]张安忠,杨崇美.微生态制剂在消化系统疾病中的应用.山东医药,2011,51(35):104.
[17]胡晔,赵桂鸣,张英平.微生态制剂治疗肝性脑病的研究进展.中国肝脏病杂志(电子版),2009,1(9):50-55.
[18]荆俊杰,陆晓青,陈敏,等.锰对小鼠脑和肝脏脂质过氧化及其钙、铁、锌的影响.毒理学杂志,2009,23(2):138-140.
[19]郑安,朱丕业.锰对神经细胞凋亡的影响.山西医科大学学报,40(9):2009,40(9):797-800.
[20]张青堂,张健,李安民.脑活素治疗新生儿缺氧缺血性脑病临床观察.实用儿科临床杂志,2009,19(7):610-611.
[21]罗恒.脑活素联合胞二磷胆碱治疗新生儿缺氧缺血性脑病的疗效观察.中国当代医药,2011,18(28):64-65.
(收稿:2016-01-04)
(本文编辑:陈从新)
Observation of the clinical efficacy of cerebrolysin combined with probiotics in treatment of patientswith hepatic encephalopathy
Chen Zhendao,Chen Hao.
Department of Gastroenterology,People'sHospital,Huazhou 525100,Guangdong Province,People's Republic of China.E-mail:czd0813@sina.com
ObjectiveTo observe the clinical efficacy of combined treatment of cerebrolysin and probiotics for patients with hepatic encephalopathy(HE).Methods76 patients with HE were randomly divided into combined treatment group and control group,with 38 cases in each.The patients in control group were treated with probiotics for 4 weeks,and the patients in combined treatment group were treated with cerebrolysin and probiotics for 4 weeks.The scores of number connection test(NCT)and digit symbol test(DST)were applied to evaluate brain functions.The blood ammonia,ALT,tumor necrosis factor-α(TNF-α)and serum bilirubin levels were assessed before and after the treatment.ResultsAt the end of 4 week treatment,the scores of NCT and DST in control group were(70.47±8.15)and(31.52±8.32),while they were(41.06±6.61)and(56.89±9.23)respectively in combined treatment group,significantly different in the two groups(P<0.05);The levels of blood ammonia,ALT,TNF-α and TBIL in control group were(69.71±19.56)μmol/L,(66.34±15.82)U/L,(346.75±45.63)pg/ml,and(51.32±8.77)μmol/L,while they were(49.65±18.33)μmol/L,(58.48±12.66)U/L,(142.57±39.51)pg/ml and(40.19±8.24)μmol/L in combined treatment group,with statistically significant difference(P<0.05).ConclusionThe clinical efficacy of cerebrolysin combined with probiotics for treatment of patients with HE is good,and it is worth to prove in clinical practice.
Hepatic encephalopathy;Cerebrolysin;Probiotics;Efficacy
10.3969/j.issn.1672-5069.2016.05.018
国家自然科学基金资助项目(编号:81300279);中国博士后科学基金资助项目(编号:2012M521579);广东省自然科学基金资助项目(编号:S2013040013549);广东省医学科研基金资助项目(编号:A2014020)
525100广东省化州市人民医院消化内科(陈振道);广东省人民医院消化内科(陈浩)
陈振道,男,33岁,大学本科,主治医师。E-mail:czd0813@sina.com
