美他多辛对酒精性肝病大鼠肝损伤的保护作用与抑制肝组织内炎性细胞因子水平有关
2016-10-17温博徐贝贝王炳元
温博,徐贝贝,王炳元
美他多辛对酒精性肝病大鼠肝损伤的保护作用与抑制肝组织内炎性细胞因子水平有关
温博,徐贝贝,王炳元
目的观察美他多辛对酒精性肝病(ALD)大鼠的保护作用及其对血清细胞因子水平的影响。方法将24只雄性Wistar大鼠分为对照组(NC,n=8)、酒精性肝病组(ALD,n=8)和美他多辛治疗组(MT,n=8)。在NC组和ALD组,给予等渗盐水灌胃,给予MT组等渗盐水和美他多辛(300 mg·kg-1·d-1)灌胃。2 w后,继续给予NC组等渗盐水,而在ALD组和MT组,给予50%酒精5 g·kg-1灌胃,1次/h,共3次。在末次灌胃8 h取血,采用ELISA法检测NF-κB、TNF-α、IL-1β、IL-6、IL-8和IL-10;取肝组织,采用RT-PCR法检测NF-κB和炎症因子mRNA水平。两个样本均数的比较采用t检验或近似t检验,多个样本均数的比较采用LSD检验。结果ALD组血清ALT较NC组显著升高[(100.13±10.64)U/L对(33.37±4.81)U/L,P<0.05],血清AST和GGT水平也显著升高(P值均<0.05);正常组动物血清IL-10、IL-1β、TNF-α、IL-6、IL8和NF-ΚB水平分别为(14.73±2.03)pg/ml、(92.38± 12.85)pg/ml、(2.66±0.81)pg/ml、(43.57±10.62)ng/ml、(0.29±0.07)ng/ml和(679.45±36.38)pg/ml,ALD动物分别为(16.19±1.94)pg/ml、(1927±233.69)pg/ml、(16.92±2.38)pg/ml、(127.49±9.33)ng/ml、(2.63±0.22)ng/ml和(1247.35±146.05)pg/ml,而美他多辛处理组则分别为(36.81±4.53)pg/ml、(304.13±34.79)pg/ml、(8.83± 1.01)pg/ml、(81.98±8.02)ng/ml、(1.45±0.22)ng/ml和(814.84±82.40)pg/ml,提示ALD组血清TNF-α、IL-1β、IL-6和IL-8水平显著高于NC组(P值均<0.05),MT组血清TNF-α、IL-1β、IL6和IL-8水平显著低于ALD组(P值均<0.05),IL-10水平显著高于ALD组(P<0.05);ALD组肝组织TNF-α、IL-1β、IL-6和IL-8 mRNA水平显著高于NC组(P值均<0.05),MT组TNF-α、IL-1β、IL-6和IL-8 mRNA水平显著低于,而IL-10 mRNA水平显著高于ALD组(P<0.05)。结论美他多辛对酒精性肝病大鼠的肝损伤有显著的保护作用,其机制可能是抑制了与NF-κB相关的炎症反应,进而抑制了TNF-α、IL-1β、IL6和IL-8等促炎因子水平,升高了抗炎因子IL-10水平有关。
酒精性肝病;美他多辛;NF-κB;细胞因子;大鼠
我国酒精性肝病(ALD)的发病率在饮酒者中达6.8%[1,2]。有研究者曾在湖南省居民的调查中发现,ALD的发病率为4.4%,其中酒精性肝炎的发病率为1.5%,酒精性肝硬化发病率为0.6%[3]。肝脏是酒精代谢的主要器官。短时间内大量饮酒是造成肝损伤的主要原因之一。酒精性肝损伤复杂的病理生理学过程以及发病机制至今尚未完全清楚。目前,仍缺乏治疗ALD的有效药物。美他多辛(Metadoxine)是一种由吡咯烷酮羧酸和吡哆醇的成盐形成的药物,是乙醛脱氢酶的激活剂,能够加快血液和组织中的酒精代谢,因此被欧洲多个国家作为急性酒精中毒(AAI)的辅助治疗药物[4,5]。研究表明,在对AAI患者的双盲对照临床试验中,美他多辛能够显著改善临床症状,并能显著降低血液中的酒精含量[6],但美他多辛的作用机制尚不完全清楚。本研究旨在探讨美他多辛对急性酒精性肝损伤大鼠的保护作用及其对细胞因子水平的影响,为美他多辛治疗急性酒精性肝损伤提供理论依据。
1 材料与方法
1.1动物、药品和试剂雄性Wistar大鼠,体质量(150±10)g,购于我校实验动物中心,饲养于SPF级实验室,温度控制在(23±2)℃,湿度控制在45%~65%,明暗交替为12 h。美他多辛由浙江震元制药有限公司提供。检测血清ALT、AST、GGT和核因子-κB试剂盒(南京建成生物工程研究所),检测白介素IL-1β、白介素IL-6、白介素IL-8、白介素IL-10和肿瘤坏死因子-α ELISA试剂盒(深圳达科为公司)。
1.2酒精性肝病模型制备将24只大鼠随机分为正常对照组(NC组,n=8)、酒精性肝病模型组(ALD组,n=8)和美他多辛治疗组(MT组,n=8)。给予所有大鼠普通饲料喂养,自由摄食及饮水。每日监测大鼠体质量并观察生存情况。给予NC组和ALD组等渗盐水1 ml灌胃,1次/d,给予MT组等渗盐水1 ml及美他多辛300 mg·kg-1d-1灌胃。2 w后,继续给予NC组等渗盐水1 ml,而给予ALD组和MT组动物50%酒精5 g·kg-1灌胃,1次/12 h,共3次。末次灌胃8 h后,脱颈处死动物。大鼠禁食8 h,记录体质量,给予10%水合氯醛(0.3 mg·kg-1)腹腔内注射,心脏穿刺取血5 ml,立即4℃,10000 r/m离心,10 min,分离血清,检测生物化学指标和细胞因子。取肝组织1.0 cm×1.0 cm×0.5 cm,浸泡于4%多聚甲醛中固定,石蜡包埋,HE染色,以Knodell(HAI)评分系统对肝脏炎症程度进行评分[7]。
1.3肝组织细胞因子mRNA检测采用RT-PCR法,肝组织于-80℃保存后,按RNA提取步骤提取RNA,反转录为cDNA,取cDNA 2 μl。引物均由华大生物有限公司设计、合成。β-actin上游引物:5' -AGCGCAAGTACTCTGTGTGG-3',下游引物:5' -AACAGTCCGCCTAGAAGCAT-3';TNF-α上游引物:5'-GTGGGCACAGTAATGTGGAG-3',下游引物:5'-TACACACGCTTGTTCGTTCA-3';IL-β上游引物:5'-TCTGTGACTCGTGGGATGAT-3',下游引物:5'-TTGTTGTTCATCTCGAAGCC-3';IL-10上游引物:5'-TAAGGGTTACTTGGGTTGCC-3',下游引物:5'-CCAGAGGGTCTTCAGCTTCT-3';IL-6上游引物:5'-CTTGGGACTGATGTTGTGAC-3',下游引物:5'-AATTAAGCCTCCGACTTGTG-3';IL-8上游引物:5'-GCGGAGAGATGAGAGTCTG-3',下游引物:5'-TCCAAGGGAAGCTTCAACAC-3';NF-κB上游引物:5'-TCCCCCAGAGACCTCATAGT-3',下游引物:5'-TGGAAATTCCTGATCCCGAC-3'。
1.4统计学方法应用SPSS 17.0软件进行统计分析。计量资料以(±s)表示。对方差不齐资料,采用近似t检验或Dunnett T3检验,对多个样本均数的比较采用单因素方差分析;对方差齐性资料,采用LSD检验,以P<0.05为有统计学意义。
2 结果
2.1急性酒精性肝损伤模型成模情况光镜下,NC组大鼠肝小叶结构清晰,肝细胞索排列整齐,肝小叶内偶见脂肪变性的肝细胞,肝细胞无坏死,无炎性细胞浸润,未见明显病理性改变;ALD组肝细胞广泛空泡变性,其内含有大量的脂滴,汇管区可见炎细胞浸润,个别大鼠肝小叶内存在散见的肝细胞点状坏死;MT组肝小叶结构清晰,肝细胞索排列整齐,肝小叶内偶见脂肪变性的肝细胞,肝细胞无坏死,仅有少量炎性细胞浸润(图1)。病理学检查说明急性酒精性肝损伤大鼠模型复制成功[8]。肝细胞纤维变性分级示:NC组F0~F1级,ALD组F2~F3级,MT组F1级[9];Knodell's HAI评分示MT组显著低于ALD组(P<0.05,表1)。
2.2大鼠血清生物化学指标的比较ALD组血清ALT、AST、GGT水平均显著高于NC组(P值均<0.05);MT组血清ALT、AST、GGT均显著低于ALD组(P值均<0.05,表2)。
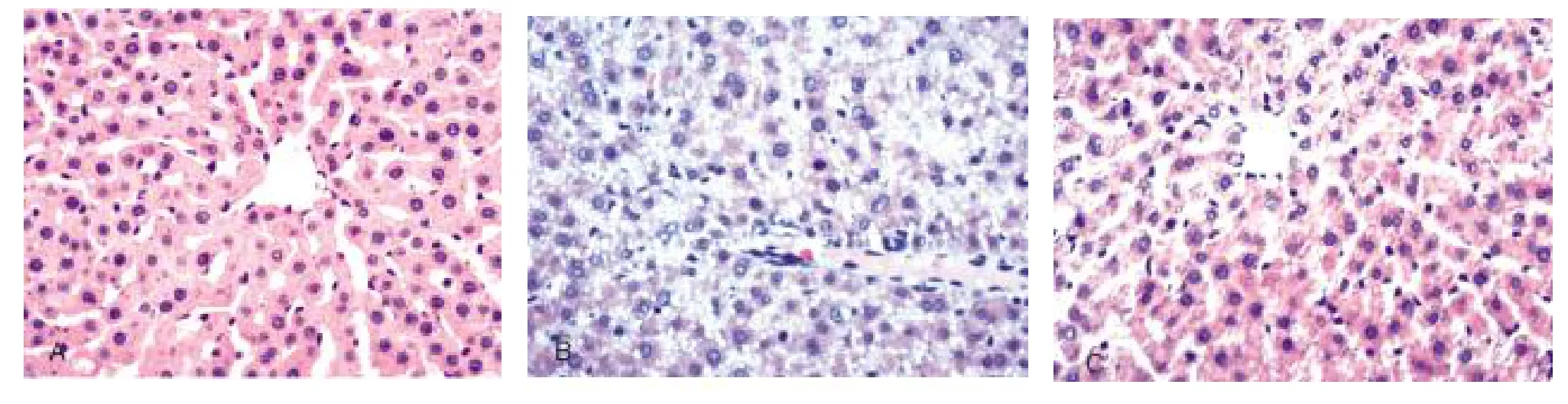
图1 各组大鼠肝组织病理学变化(HE,200×)
表1 各组大鼠肝组织Knodell's HAI评分(±s)比较
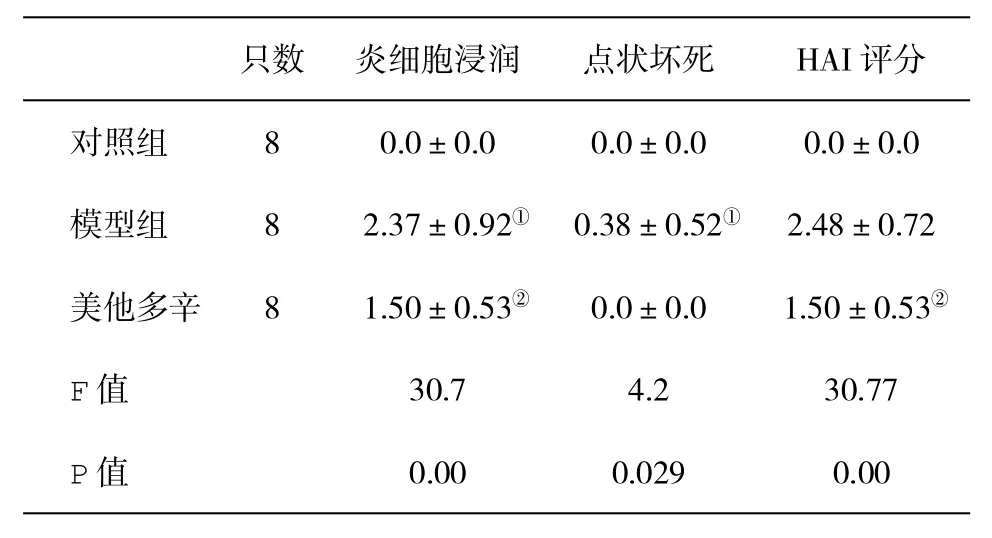
表1 各组大鼠肝组织Knodell's HAI评分(±s)比较
与正常对照组比,①P<0.05;与酒精模型组比,②P<0.05
只数炎细胞浸润点状坏死HAI评分对照组80.0±0.00.0±0.00.0±0.0模型组82.37±0.92①0.38±0.52①2.48±0.72美他多辛81.50±0.53②0.0±0.01.50±0.53②F值30.74.230.77 P值0.000.0290.00
表2 各组大鼠血清生化指标水平(U/L,±s)比较

表2 各组大鼠血清生化指标水平(U/L,±s)比较
与正常对照组比,①P<0.05;与酒精模型组比,②P<0.05
ALTASTGGT正常组33.37±4.8129.37±6.9336.37±11.49模型组100.13±10.64①185.75±8.84①214.13±13.34①美他多辛75.50±10.27②160.13±9.87②136.63±8.77②F值113.08755.47492.59 P值0.000.010.00
2.3大鼠血清细胞因子水平比较ALD组血清TNF-α、IL-1β、IL-6和IL-8水平显著高于NC组(P值均<0.05);MT组血清TNF-α和IL-1β、IL6和IL-8水平显著低于ALD组(P值均<0.05),IL-10水平显著高于ALD组(P<0.05,表3)。
2.4肝组织细胞因子基因水平变化的比较ALD组TNF-α、IL-1β、IL-6和IL-8 mRNA水平显著高于NC组(P值均<0.05);MT组TNF-α、IL-1β、IL-6和IL-8 mRNA水平显著低于,而IL-10 mRNA水平显著高于ALD组(P<0.05,表4)。
表3 各组血清细胞因子水平(±s)比较
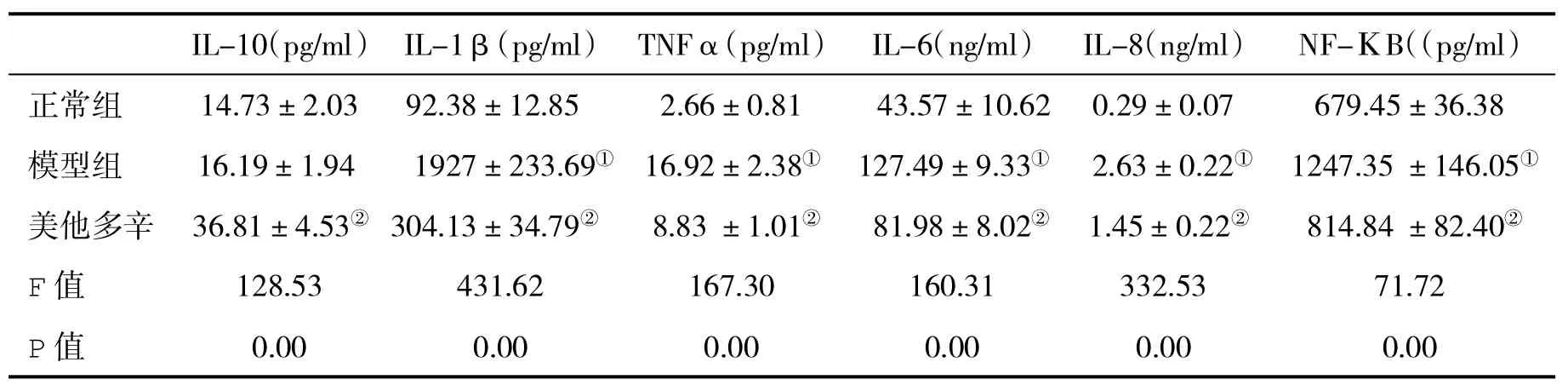
表3 各组血清细胞因子水平(±s)比较
与正常对照组比,①P<0.05;与模型组比,②P<0.05
IL-10(pg/ml)IL-1β(pg/ml)TNFα(pg/ml)IL-6(ng/ml)IL-8(ng/ml)NF-ΚB((pg/ml)正常组14.73±2.0392.38±12.852.66±0.8143.57±10.620.29±0.07679.45±36.38模型组16.19±1.941927±233.69①16.92±2.38①127.49±9.33①2.63±0.22①1247.35±146.05①美他多辛36.81±4.53②304.13±34.79②8.83±1.01②81.98±8.02②1.45±0.22②814.84±82.40②F值128.53431.62167.30160.31332.5371.72 P值0.000.000.000.000.000.00
表4 各组大鼠肝组织细胞因子基因水平(±s)变化的比较

表4 各组大鼠肝组织细胞因子基因水平(±s)变化的比较
与正常对照组比,①P<0.05;与模型组比,②P<0.05
IL-10IL-1βTNF-αIL-6IL-8NF-Κb正常组1.00±0.261.00±0.221.00±0.141.00±0.211.00±0.131.00±0.03模型组2.41±0.68①30.72±3.40①10.02±1.45①7.68±1.11①4.97±0.83①1.42±0.27①美他多辛8.48±2.27②6.85±1.76②5.51±1.09②3.17±0.87②2.60±1.04②1.31±0.05 F值167.30431.86128.53136.6753.3515.16 P值0.020.010.0050.010.000.00
3 讨论
研究表明,美他多辛可以激活乙醛脱氢酶,提高肝脏三磷酸腺苷浓度,减少乙醇对色氨酸吡咯酶的抑制,从而起到加速乙醇及其代谢产物代谢速度,减少毒性物质在肝脏内停留的时间[9~13]。还有研究显示美他多辛能预防肝细胞的氧化失调,减少脂质过氧化导致的肝脏损害[14],但其具体作用机制仍尚不明确。因此,本实验采用灌胃法建立大鼠急性酒精性肝损伤模型,观察美他多辛对肝脏的保护作用并从炎症反应和细胞因子的角度初步探讨了其可能的作用机制。
酒精性肝病的发病机制比较复杂,其发生是多种因素共同作用的结果,其中包括炎症反应、细胞凋亡、线粒体损伤、乙醇及其代谢产物对肝脏的直接毒理作用、氧化应激和免疫诱导损伤等[15]。炎症反应是酒精性肝病发生的关键因素之一,由内毒素、细胞因子及Kupffer细胞等多种途径介导。在酒精性肝病的发生过程中,乙醇可以改变肠粘膜的通透性,通过肠细菌移位引起肠源性内毒素血症,而内毒素对肝脏的损害主要是通过激活Kupffer细胞,诱导如NF-κB等转录因子进行磷酸化和核转位,促使各种细胞因子的基因转录,进而释放大量的细胞因子和炎症介质,如TNF-α、IL-1β、IL-6等[16]。多种细胞因子和炎症介质进一步引起放大级联反应,加重肝细胞的损伤,推进酒精性肝病的进展。
NF-κB是细胞中广泛存在的重要转录因子,既参与多种炎性介质的转录表达、免疫反应等过程,又与细胞凋亡的调控相关[17]。当细胞处于静息状态时,NF-κB在胞浆中处于非活性状态[18],当细胞受到如TNF-α、内毒素、氧化应激及酒精等的外部刺激均可激活NF-κB,启动下游多种靶基因的转录和表达[19]。NF-κB是一种调控炎症反应的多向因子[20]。本实验中,ALD组大鼠血清及肝细胞NF-κB、TNF-α和IL-1β水平均高于正常对照组,提示急性大量酒精暴露使大鼠体内与NF-κB相关的炎症反应调控系统处于一种活跃状态。美他多辛治疗组大鼠血清及肝细胞NF-κB、TNF-α和IL-1β水平均低于模型组,提示该药使急性大量酒精暴露大鼠体内与NF-κB相关的炎症反应调控系统处于一种抑制状态。
近年来,越来越多的学者认为细胞因子在酒精性肝病的发生发展中发挥重要作用[21]。TNF-α能引起肝细胞坏死[22,23]。TNF-α既可以导致肝细胞坏死,也可诱导其凋亡[24]。TNF-α还可以激活细胞因子级联反应,刺激其IL-1和IL-8等的产生,进一步加重肝细胞的损伤或凋亡[25,26]。IL-6作为肝细胞的刺激因子,可以直接刺激肝细胞增生并分泌大量的胶原,促进肝纤维化的形成[27,28],提示IL-6与酒精性肝病的发展密切相关。IL-8对中性粒细胞、嗜碱性粒细胞和T细胞具有趋化作用。在酒精性肝病发生时,肝细胞对TNF-α应答而释放IL-8,进一步促使炎症细胞聚集至肝脏,引起炎症。已有研究显示ALD患者血清IL-8显著升高。
IL-l0是一种抗炎细胞因子,对治疗许多肝脏疾病如肝纤维化,有着良好的应用前景。研究认为IL-10可通过多个途径发挥抗肝纤维化作用,主要途径可能有抑制Kupffer细胞活化及炎性递质、细胞因子、氧自由基释放,抑制NF-KB活性等。研究证实IL-10促进了再灌注损伤大鼠的肝细胞再生。本实验中美他多辛组动物血清IL-10和肝组织IL-10 mRNA水平均显著高于酒精性肝损伤模型组。
综上所述,美他多辛对急性酒精性肝损伤有显著的保护作用,其机制可能与抑制NF-κB相关的炎症反应调控系统来抑制TNF-α和IL-1β水平,升高IL-10水平有关。
[1]陈震,吕雄文,李俊,等.咖啡因对小数急性酒精性肝损伤的保护作用.安徽医科大学学报,2009,44(3):359-361.
[2]刘旭东,王炳元.日本酒精性肝病研究现状.实用临床医学,2007,11(3):22.
[3]戴水奇,黄顺玲,张雪红,等.湖南省酒精性肝病流行病学分析.中西医结合肝病杂志,2005,15(2):105.
[4]Addolorato G,Ancona C,Capristo E,et al.Metadoxine in the treatment of acute and chronic alcoholism:a review.Int J Immunopathol Pharm,2003,16(3):207-214.
[5]Vonghia L,Leggio L,Ferrulli A,et al.Acute alcohol intoxication. Eur J Intern Med,2008,19(8):561-567.
[6]Shpilenya LS,Muzychenko AP,Gasbarrini G,et al.Metadoxine in acute alcohol intoxication:a double-blind,randomized,placebocontrolledstudy.Alcohol ClinExperiment Res,2002,26(3):340-346.
[7]Schaff Z.The value of liver biopsy in chronic hepatitis.Orvosi hetilap,2011,152(22):856-858.
[8]Chang B,Sang LX.The role of FoxO4 in the relationship between alcohol-induced intestinal barrier dysfunction and liver injury.Int J Mol Med,2013,31(3):569-576.
[9]中华医学会肝病学分会脂肪肝和酒精性肝病学组.酒精性肝病诊疗指南.中华肝脏病杂志,2006,14(3):164-166.
[10]WangH,MaL,YinQ,etal.Prevalenceofalcoholicliver diseaseanditsassociationwithsocioeconomicstatusin north-eastern China.Alcoho Clid Experiment Res 2014,38(4):1035-1041.
[11]Felicioli R,Saracchi I,Flagiello M,et al.Effects of pyridoxinepyrrolidon-carboxylate on hepatic and cerebral ATP levels in ethanoltreatedrats.IntJClinPharmacol,1980,18(6):277-280.
[12]Ragusa N,Zito D,Bondi C,et al.Effects of pyridoxine on hepatic tryptophan pyrrolase activity in rat during chronic ethanol administration.Bioch Exp Biol,1980,16(4):391-396.
[13]Diaz Martinez MC,Diaz Martinez A,Villamil Salcedo V,et al. Efficacy of metadoxine inthe management of acutealcohol intoxication.J Int Med Res,2002,30(1):44-51.
[14]FeherJ,LengyelG.Anewapproachtodrugtherapyin non-alcoholic steatohepatitis(NASH).J Int Med Res,2004,31(6):537-551.
[15]厉有名.酒精性肝病的发病机制.中华肝脏病杂志,2003,11(11):690-691.
[16]Grove J,Daly AK,Bassendine MF,et al.Association of a tumor necrosisfactorpromoterpolymorphismwithsusceptibilityto alcoholic steatohepatitis.Hepatology,1997,26(1):143-146.
[17]王春妍,范玉强,迟宝荣,等.核因子-κB及其下游因子TNF-α、Bcl-2在急性肝损伤中的作用及机制.世界华人消化杂志,2008,16(25):2804-2808.
[18]Valen G,Yan ZQ,Hansson GK.Nuclear factor-kappa B and the heart.J Am Coll Cardiol,2001,38(2):307-314.
[19]Watanabe T,Jono H,Han JH,et al.Synergistic activation of NF-kappa B by nontypeable Haemophilus infuenzae and tumor necrosis factor-α.PNAS,2004,101(10):3563-3568.
[20]赵彩彦,丛斌.核因子-κB与酒精性肝病.国外医学.消化系疾病分册,2002,22(4):230-232.
[21]Marcos M,Gonzalez R.Common polymorphisms in interleukin genes(IL4,IL6,IL8 and IL12)are not associated with alcoholic liver disease or alcoholism in Spanish men.Cytokine,2009,45(3):158-161.
[22]NaveauS.Plasmalevelsofsolubletumornecrosisfactor receptors p55 and p75 in patients with alcoholic liver disease of increasing severity.J Hepatol,1998,28(5):778-784.
[23]Pastor LF,Romero A,Gonzalez-Sarmiento M,et al.238 G>apolymorphism of tumor necrosis factor alpha gene(TNFA)is associatedwith alcoholic liver cirrhosis inalcoholic Spanish men.Alcohol Clin Exp Res,2005,29(11):1928-1931.
[24]李海燕,李夏,金向群,等.黄芩苷对大鼠慢性酒精性肝损伤的影响.中国实验方剂学杂志,2008,14(6):58-60.
[25]Chen YL,Peng HC,Hsieh YC,et al.Epidermal growth factor improved alcohol-induced inflammation in rats.Alcohol,2014,48:701-706.
[26]PetrasekJ,BalaS,CsakT,etal.IL-1receptorantagonist ameliorates inflammasome-dependent alcoholic steatohepatitis in mice.J Clin Investig,2012,122(10):3476-3489.
[27]任红,张定风,贾小平,等.丙型肝炎患者肿瘤坏死因子和白细胞介素6的水平及意义.中国免疫学杂志,1992,8(1):50-52.
[28]Clarien PA,Carnargo CA.Acute reactant cytokines and neutrophiladhesionafterwarmischemiaincirrhoticand noncirrhotic human livers.Hepatology,1996,6(23):1456-1463.
(收稿:2016-01-13)
(本文编辑:陈从新)
Metadoxine relieving acute alcoholic liver injuries in rats with alcohol-induced liver diseases
Wen Bo,Xu Beibei,Wang Bingyuan.
Department of Geriatics Medicine,First Affiliated Hospital,China Medical University,Shenyang 110001,Liaoning Province,China Corresponding author:Wang Bingyuan,E-mail:cmu1hfnswby@126.com
ObjectiveTo investigate the effect of metadoxine(MT)on acute alcoholic liver injury in rats with alcohol-induced liver diseases(ALD).MethodsTwenty-four Wistar rats were randomly divided into normal control,alcoholic liver disease and metadoxine-intervened group,with 8 rats in each group.All rats were fed with normal chow.In the first two weeks,the rats in control and in ALD groups were administered normal saline,while in MT group were treated with metadoxine at dose of 300 mg·kg-1·d-1.The protocol lasted for 2 weeks.Then,the rats in ALD group and MT group were made acute liver injuries by alcohol gavage with 50%(v/v)ethanol at dose of 5 g·kg-1once every 12 hours,and a total of 3 times,while in rats in NC group were still administered normal saline.Eight hours after the last ethanol administration,the rats were sacrificed,and the blood and liver tissues were collected.The hepatic inflammatory cytokine mRNA was assayed by RT-PCR,and serum NF-κB,TNF-α,IL-1β,IL-6,IL-8 and IL-10 levels were detected by ELISA.The t-test was used for statistical analysis. ResultsSerum ALT levels in ALD group elevated obviously than in control[(100.13±10.64)U/L vs.(33.37±4.81)U/L,P<0.05],and serum AST and GGT levels increased also(all P<0.05);serum IL-10,IL-1β,TNF-α,IL-6,IL8 and NF-KB levels in control group were(14.73±2.03)pg/ml,(92.38±12.85)pg/ml,(2.66±0.81)pg/ml,(43.57±10.62)ng/ml,(0.29±0.07)ng/ml and(679.45±36.38)pg/ml,in ALD group were(16.19±1.94)pg/ml,(1927±233.69)pg/ml,(16.92±2.38)pg/ml,(127.49±9.33)ng/ml,(2.63±0.22)ng/ml and(1247.35±146.05)pg/ml,while in MT group were(36.81±4.53)pg/ml,(304.13±34.79)pg/ml,(8.83±1.01)pg/ml,(81.98±8.02)ng/ml,(1.45±0.22)ng/ml and(814.84±82.40)pg/ml,respectively,suggesting serum TNF-α,IL-1β,IL-6 and IL-8 levels were higher than those in control(all P<0.05),serum TNF-α,IL-1β,IL6 and IL-8 levels in MT group were lower,and serum IL-10 level in MT group was higher than in ALD group(all P<0.05);hepatic TNF-α,IL-1β,IL-6 and IL-8 mRNA levels in ALD group were much higher than in NC group(all P<0.05),hepatic TNF-α,IL-1β,IL-6 and IL-8 mRNA levels in MT group were much lower,while IL-10 mRNA level much higher than in ALD group(P<0.05).ConclusionMetadoxine can protect the alcohol-induced acute liver injuries by down-regulating pro-inflammatory cytokines and alleviating hepatic inflammation.
Alcoholic liver injuries;Metadoxine;Cytokines;NF-κB;Rats
10.3969/j.issn.1672-5069.2016.05.014
110001沈阳市中国医科大学附属第一医院老年消化科
温博,女,29岁,硕士研究生
王炳元,E-mail:cmu1hfnswby@126.com
