G-CSF在结肠炎相关结直肠癌中的表达△
2016-10-17石新英袁伟唐万燕左雯徐玥钟儒刚马洁
石新英 袁伟 唐万燕 左雯 徐玥 钟儒刚 马洁
1北京工业大学生命科学与生物工程学院,北京100022
2中国医学科学院肿瘤医院分子肿瘤学国家重点实验室,北京100021
G-CSF在结肠炎相关结直肠癌中的表达△
石新英1袁伟2#唐万燕2左雯2徐玥2钟儒刚1马洁2
1北京工业大学生命科学与生物工程学院,北京100022
2中国医学科学院肿瘤医院分子肿瘤学国家重点实验室,北京100021
目的探索粒细胞集落刺激因子(granulocyte-colony stimulating factor,G-CSF)在结肠炎相关结直肠癌小鼠模型中的表达情况,并研究小鼠结直肠部位G-CSF的细胞来源。方法利用致癌剂氧化偶氮甲烷(azoxymethane,AOM)和致炎剂葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导小鼠的结直肠癌,通过免疫组化方法检测G-CSF在炎症向肿瘤发展各阶段小鼠结直肠组织中的表达情况,利用免疫荧光方法检测小鼠结直肠部位与GCSF共定位的细胞。结果AOM/DSS小鼠模型能良好地模拟结肠炎相关结直肠癌病程特点:本研究将其分为3个阶段,即AD1、AD2、AD3阶段。其中AD1阶段小鼠结直肠部位存在大量淋巴细胞的浸润,AD2阶段小鼠有不典型增生和腺瘤,AD3阶段小鼠结直肠出现原位癌病变。与正常小鼠相比,AD1、AD2、AD3阶段小鼠结直肠部位G-CSF表达升高,且AD2阶段表达水平最高;G-CSF与小鼠结直肠部位的上皮细胞共定位最广泛,只有少量的肌成纤维细胞和巨噬细胞能跟G-CSF共定位。结论本研究中AOM/DSS小鼠模型经历了正常黏膜→不典型增生→腺瘤→腺癌的发展过程,能够较好地模拟人由炎症性肠病逐步发展成结肠炎相关结直肠癌的病程;AD小鼠与正常小鼠相比表达较高水平的G-CSF,且AD2阶段G-CSF表达最高;AOM/DSS小鼠模型中,G-CSF主要由小鼠结直肠部位的上皮细胞分泌,部分巨噬细胞和肌成纤维细胞也可以产生G-CSF。
结肠炎相关结直肠癌;炎症性肠病;粒细胞集落刺激因子
结直肠癌(colorectal cancer,CRC)是一种常见的恶性消化道肿瘤,它的发生与多种因素有关,其中慢性炎症是致结直肠癌发生的一个高危因素[1]。结肠炎相关结直肠癌(colitis-associated cancer,CAC)是结直肠癌的一种亚型,与炎症性肠病(inflammatory bowel diseases,IBD)密切相关,其中超过20%的炎症性肠病患者在未来30年内将会发展成结直肠癌,且患者的治疗难度大和病死率较高[2]。尽管炎症性肠病与CAC发生密切相关,但是确切的机制仍然没有得到系统的研究。
G-CSF作为一种造血生长因子,能够促进中性粒细胞的分化和成熟,并且影响其功能,通常被用于治疗癌症化疗后的嗜中性粒细胞减少症。近年来的研究表明,G-CSF在肿瘤发生发展中发挥很重要的作用。Rutella等[3]发现,G-CSF在子宫颈癌、卵巢癌、胰腺癌等肿瘤组织中的表达高于癌旁组织,且患者外周血中G-CSF含量较高。Gutschalkd等[4]研究表明G-CSF能够促进头颈鳞癌细胞系的增殖和迁移。此外,也有研究报道,膀胱癌和胃癌肿瘤组织产生高水平G-CSF与患者不良预后相关,提示G-CSF可能促进癌症的发生和发展[5-7]。多种类型细胞在适当的刺激下能够产生G-CSF,单核/巨噬细胞系是G-CSF的主要来源,间皮细胞、成纤维细胞和血管内皮细胞等也能够产生G-CSF[8]。然而,结肠炎向结直肠癌发展过程中,关于G-CSF的表达和来源的研究很少。本文主要研究能有效模拟人结肠炎相关结直肠癌的AOM/DSS小鼠模型中,结直肠部位G-CSF的表达情况,以及小鼠结直肠部位G-CSF的来源,为探索慢性炎症促进结直肠癌的发生发展提供新的思路,为拓展CAC的临床治疗提供可靠的理论支撑。
1 材料与方法
1.1实验材料
1.1.1试验用药氧化偶氮甲烷,购自美国Sigma公司;葡聚糖硫酸钠,购自美国Sigma公司。以上两种物品均具有致癌性,所以特殊保存。
1.1.2实验动物本研究使用的SPF级C57BL/6雌性小鼠(许可证号:SCXK(京)2014-0004),7周龄左右,体质量18~20 g,购自北京华阜康生物科技股份有限公司。恒温25~27℃,恒湿45%~50%条件,置于中国医学科学院肿瘤医院肿瘤研究所动物房层流超净架内饲养。
1.1.3试验试剂G-CSF Goat polyclonal IgG,购自Santa Cruz Biotechnology;Rat mAb to F4/80,Mouse mAb to E cadherin以及Rabbit mAb to alpha Smooth Muscle Actin购自Abcam;Alexa Fluor®594 donkey anti-goat IgG(H+L),Alexa Fluor®488 donkey anti-rat IgG(H+L),Alexa Fluor®488 donkey anti-mouse IgG(H+L)以及Alexa Fluor®488 donkey anti-rabbit IgG(H+L)购自Life TechnologiesTM;磷酸盐缓冲液,柠檬酸盐缓冲液,过氧化物封闭液,Normal Donkey Serum,抗体稀释液,山羊超敏二步法检测试剂盒,Harris苏木素染液,1%氨水,中性快干胶,Mounting Medium With DAPI,100×载玻片盒,均购自北京中杉金桥生物技术有限公司;CRYOMATRIX,购自Thermo Scientific;环保脱蜡透明剂,CITOGLAS黏附载玻片,均购自北京益利精细化学有限公司。
1.2仪器设备
激光共聚焦显微镜、LEICA倒置显微镜、冻冰切片机、石蜡切片机。
1.3实验方法
1.3.1AOM/DSS小鼠结直肠癌模型3周龄C57BL/ 6小鼠饲养4周后,体质量达到18~20 g,第1天腹腔注射AOM(剂量为12.5 mg/kg);10 d后第1次给小鼠饲喂含2.5%DSS的饮用水,时间为5 d,然后恢复饮用正常水休息14 d;重复两次DSS喂水过程,完成诱导,总诱导时间为53 d。实验分为4组,即未处理组(正常组)、1次DSS循环给水(AD1组)、两次DSS循环给水(AD2组)、3次DSS循环给水(AD3组),每组10只小鼠,每轮DSS循环给水后处死的小鼠分别命名为AD1小鼠、AD2小鼠和AD3小鼠。(图1)

图1 AOM/DSS法诱导C57BL/6小鼠CAC成瘤模型流程图
1.3.2免疫组化和免疫荧光镜检小鼠结直肠组织标本用10%中性甲醛溶液固定,常规石蜡包埋,行4 μm连续切片,制备成石蜡切片。选取部分行HE染色。另外的进行免疫组化实验,步骤如下:切片脱蜡至水,PBS冲洗;柠檬酸盐缓冲液进行抗原热修复,PBS冲洗;3%H2O2室温孵育,去除内源性过氧化物酶活性,PBS冲洗;3%BSA室温封闭1 h;滴加一抗,4℃冰箱过夜;第2天室温复温,PBS冲洗;滴加二抗检测试剂,PBS冲洗;DAB显色,显微镜下掌握染色程度;苏木素复染细胞核;梯度脱水透明化、中性快干胶封片;镜检。
小鼠结直肠组织标本用CRYOMATRIX包埋,行6 μm连续切片,制备成冰冻切片。免疫荧光实验步骤如下:切片从-80℃冰箱中取出先后在-20℃、4℃冰箱各放置10 min;用预冷的丙酮对切片在室温中进行固定,PBS冲洗;10%驴血清封闭1 h;滴加一抗,4℃冰箱过夜;第2天室温复温,PBS冲洗;滴加稀释适当倍数的荧光二抗室温孵育1 h,PBS冲洗;用DAPI染细胞核同时封片;镜检。
每组选取5只小鼠制作标本,每张切片随机挑选3个视野进行观察。
2 结果
2.1AOM/DSS小鼠模型能够有效复制结肠炎相关结直肠癌病程
AOM/DSS小鼠模型诱导过程中,发现小鼠饮用DSS水后表现出腹泻、血便和体质量减轻的症状。分别将3次DSS循环给水后的小鼠处死,将各阶段小鼠结直肠组织固定包埋后行HE染色。结果显示,AD1小鼠结直肠存在炎症和大量淋巴细胞的浸润;AD2小鼠结直肠有不典型增生和腺瘤;AD3小鼠结直肠部位出现原位癌病变(图2)。该模型中小鼠结直肠病理与人类CAC相似,能较好地模拟人类CAC的发展过程。
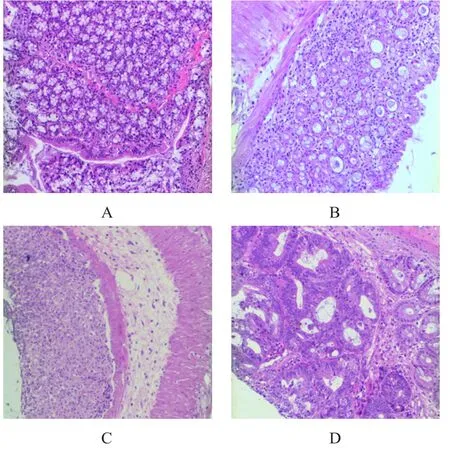
图2 正常和各阶段AD小鼠结直肠组织形态(HE染色,20× 10)
2.2G-CSF在结肠炎相关结直肠癌发生发展过程中表达升高
在本实验室前期工作阶段,利用蛋白芯片检测了不同阶段AD小鼠结直肠组织中细胞因子的表达变化,结果发现AD小鼠组织中G-CSF的表达水平高于正常小鼠。因此,利用免疫组化方法,我们检测各阶段AD小鼠结直肠组织中G-CSF的表达情况,根据G-CSF染色程度判断,与正常小鼠相比,AD小鼠均可见较高的G-CSF表达,其中AD2小鼠结直肠部位G-CSF的表达最高。(图3)
2.3AOM/DSS小鼠模型中G-CSF主要由上皮细胞分泌
为了明确AOM/DSS小鼠模型结直肠组织中G-CSF的来源,我们利用免疫荧光检测G-CSF与其可能来源的几种细胞的共定位情况,即上皮细胞、肌成纤维细胞及巨噬细胞。本实验利用3种细胞的标志蛋白E-Cadherin、α-SMA和F4/80分别标记上皮细胞、肌成纤维细胞、巨噬细胞。结果发现,AD小鼠3个阶段结直肠组织中G-CSF与上皮细胞、部分肌成纤维细胞和巨噬细胞均有共定位现象(图4),上皮细胞所占比例较大,提示小鼠的CAC形成过程中上皮细胞、肌成纤维细胞、巨噬细胞都可以分泌G-CSF,而G-CSF主要由上皮细胞分泌。
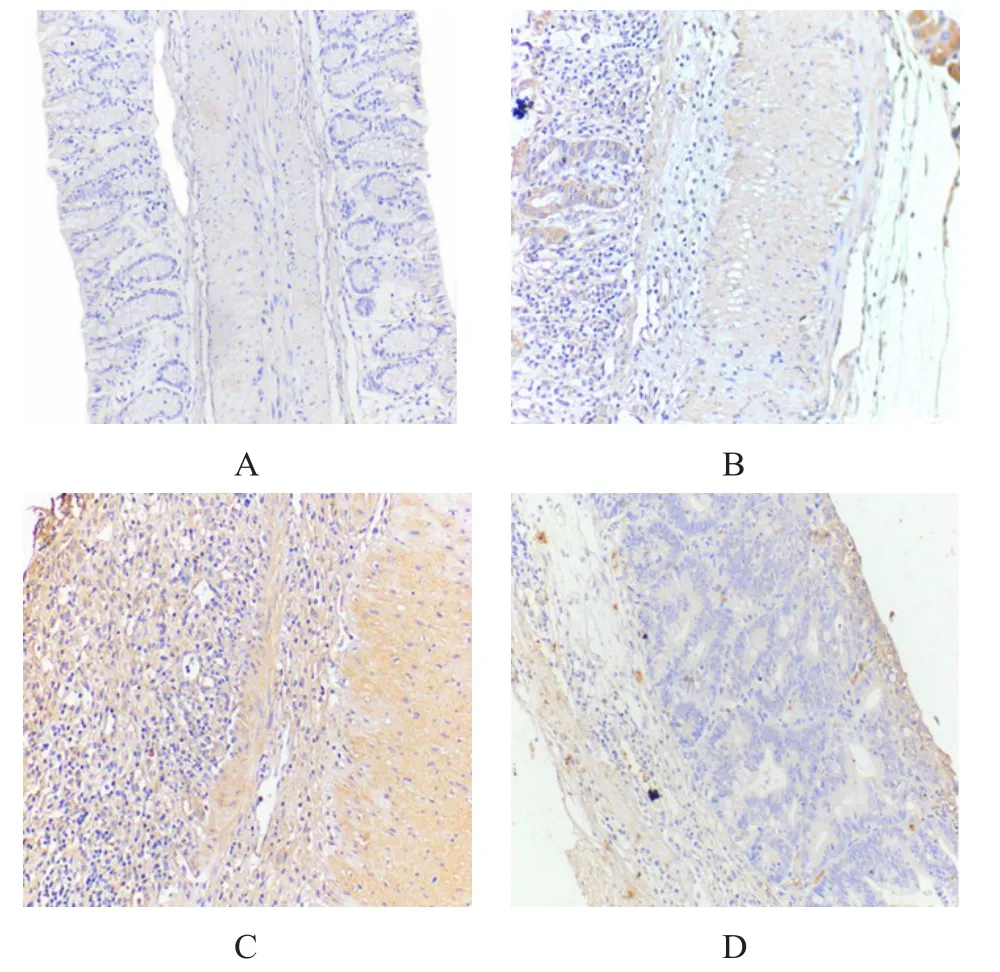
图3 正常和AD小鼠结直肠G-CSF表达情况(免疫组化染色,20×10)
3 讨论
G-CSF作为一种促炎性因子能够促进中性粒细胞的成熟和分化,并且能动员中性粒细胞从骨髓释放到外周血中。正常人血清中G-CSF的含量比较低,通常未达到检测水平,当机体发生感染或炎症时,血清中G-CSF水平显著升高。研究表明,G-CSF在子宫颈癌、卵巢癌、胰腺癌等肿瘤组织中的表达水平高于癌旁组织,且患者外周血中G-CSF含量较高。Morris等[9]研究指出,胃肠癌患者肿瘤组织高表达G-CSF和G-CSF受体,与淋巴结转移密切相关,提示G-CSF可能与胃肠癌患者不良预后相关。
有研究结果显示,T3期结直肠癌患者肿瘤组织中G-CSF的表达水平显著高于T2和T4期[9]。在本研究中,利用免疫组化方法分析G-CSF在正常和AD小鼠结直肠组织中的表达。笔者发现,与正常小鼠相比,AD小鼠结直肠部位的G-CSF表达升高,且AD2时期G-CSF含量最高,这与前面相关研究结果一致。本实验前期研究结果显示,AD小鼠结直肠浸润的MDSC逐渐增多,有研究表明G-CSF能够促进G-MDSC向肿瘤组织募集[10],本实验也证实了这一结论。提示在炎症发展成结直肠癌的过程中,随着炎症加剧,G-CSF表达增多,进一步募集了骨髓中MDSC,并促使其分泌IL6、IL-1β等促炎性因子,从而促进癌症的发展。也表明在AOM/ DSS小鼠模型不同阶段的结直肠组织中,G-CSF的表达差异与疾病进展相关。此外,免疫组化结果显示,G-CSF主要表达在上皮细胞,为了进一步明确结直肠组织中G-CSF的来源,笔者通过免疫荧光技术发现上皮细胞和G-CSF确实有共定位现象,说明在AOM/DSS小鼠模型中上皮细胞能够产生G-CSF,且与小鼠CAC的发展具有相关性。
研究发现,α-SMA阳性的基质成纤维细胞,通常被称为肌成纤维细胞或者活化的成纤维细胞,在消化道肿瘤的发展中发挥至关重要的作用,能够为肿瘤的发生发展和侵袭提供一个有利的微环境[11]。有研究表明,人的成纤维细胞和肌成纤维细胞能够产生G-CSF[8,12]。因此,笔者利用免疫荧光方法研究了AD小鼠中结直肠部位的肌成纤维细胞是否表达G-CSF。结果显示G-CSF和肌成纤维细胞只存在较少共定位现象,推测可能与切片中肿瘤来源的肌成纤维细胞较少有关。
巨噬细胞在炎症和癌症中发挥不可或缺的作用。文献报道,在溃疡性结肠炎和结直肠癌患者病灶部位有大量巨噬细胞浸润[13-15]。早期研究揭示,在IL-1、LPS和TNF-α炎性因子刺激下,巨噬细胞、内皮细胞和相关的间充质细胞能够产生GCSF。此外,一项利用雄性Crj的研究:CD-1(ICR)小鼠诱导结直肠癌发现[16]:腹腔M1型巨噬细胞仅在CAC过程的转移阶段产生较高水平的G-CSF,腹腔M2型巨噬细胞在整个CAC过程中高表达GCSF,尤其在腺瘤阶段和肿瘤形成阶段。本研究免疫荧光结果表明,在C57BL/6-AD小鼠中巨噬细胞确实能够表达G-CSF,这与前人研究结果相似。
临床病例报道结果显示,高表达G-CSF的结直肠癌患者,肿瘤体积较大并且有远端转移,尽管手术切除后使G-CSF的水平下降,但是这些患者的整体术后生存较差,提示G-CSF具有促进癌症进展的功能[17-18]。本研究结果表明,在小鼠CAC发生发展过程中G-CSF表达升高,并且利用免疫荧光方法证明了AD小鼠结直肠部位的上皮细胞、巨噬细胞和肌成纤维细胞能够分泌G-CSF,提示可以抑制上述细胞分泌G-CSF,从而减缓CAC的进程,为CAC的临床治疗提供了新的靶点和理论依据。
[1]Terzić J,Grivennikov S,Karin E,et al.Inflammation andcolon cancer[J].Gastroenterology,2010,138(6):2101-2114.
[2]Tenesa A,Dunlop MG.New insights into the aetiology of colorectal cancer from genome-wide association studies[J]. Nat Rev Genet,2009,10(6):353-358.
[3]RutellaS,ZavalaF,DaneseS,etal.Granulocytecolony-stimulatingfactor:anovelmediatorofTcelltolerance[J].JImmunol,2008,175(11):7085-7091.
[4]Gutschalk CM,Herold-Mende CC,Fusenig NE,et al.Granulocyte colony-stimulating factor and granulocyte-macrophage colony-stimulating factor promote malignant growth of cells from head and neck squamous cell carcinomas in vivo[J].Cancer Res,2006,66(16):8026-8036.
[5]Tachibana M,Murai M.G-CSF production in human bladder cancer and its ability to promote autocrine growth:a review[J].Cytokines Cell Mol Ther,1998,4(2):113-120.
[6]Torpy JM,Lynm C,Glass RM,et al.Stomach cancer[J].JAMA,2010,303(17):1771.
[7]Wang L,Xue J,Zadorozny EV,et al.G-CSF stimulates Jak2-dependent Gab2 phosphorylation leading to Erk1/2 activation and cell proliferation[J].Cell Signal,2008,20(10):1890-1899.
[8]Demetri GD,Griffin JD.Granulocyte colony-stimulating factor and its receptor[J].Blood,1991,78(11):2791-2808.
[9]Morris KT,Khan H,Ahmad A,et al.G-CSF and G-CSFR are highly expressed in human gastric and colon cancers and promote carcinoma cell proliferation and migration[J]. Br J Cancer,2014,110(5):1211-1220.
[10]Jeremy D,Qiang Hu,Asutin M,et al.Tumor-derived GCSF facilitates neoplastic growth through a granulocytic myeloid-derived suppressor cell dependent mechanism[J]. Plos One,2011,6(11):e27690.
[11]Worthley DL,Giraud AS,Wang TC.Stromal fibroblasts in digestive cancer[J].Cancer Microenviron,2010,3(1):117-125.
[12]Seelentag W,Mermod JJ,Vassalli P.Interleukin 1 and tumor necrosis factor-alpha additively increase the levels of granulocyte-macrophage and granulocyte colony-stimulating factor(CSF)mRNA in human fibroblasts[J].Eur J Immunol,1989,19(1):209-212.
[13]Siveen KS,Kuttan G.Role of macrophages in tumour progression[J].Immunol Lett,2009,123(2):97-102.
[14]Xie J,Itzkowitz SH.Cancer in inflammatory bowel disease[J].World J Gastroenterol,2008,14(3):378-389.
[15]Bar-On L,Zigmond E,Jung S.Management of gut inflammation through the manipulation of intestinal dendritic cells andmacrophages[J].SeminImmunol,2011,23(1):58-64.
[16]Wang W,Li X,Zheng D,et al.Dynamic changes of peritoneal macrophages and subpopulatons during ulcerative colitis to metastasis of colorectal carcinoma in a mouse model[J].Inflammation Research,2013,62(7):669-680.
[17]Matsuda A,Sasajima K,Matsutani T,et al.Aggressive undifferentiated colon carcinoma producing granulocyte-colony stimulating factor:report of a case[J].Surgery Today,2009,39(11):990-993.
[18]Fujiwara Y,Yamazaki O,Takatsuka S,et al.Granulocyte colony-stimulating factor-producing ascending colon cancer as indicated by histopathological findings:report of a case[J].Osaka City Med,2011,57(2):79-84.
The expression of G-CSF in colitis-associated cancer△
SHI Xin-ying1YUAN wei2#TANG Wan-yan2ZOU Wen2XU Yue2ZHONG Ru-gang1MAJie21Beijing University of Technology,Beijing 100022,China
2State Key Laboratory of Molecular Oncology,Cancer Hospital,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100021,China
ObjectiveTo investigate the expression of granulocyte-colony stimulating factor(G-CSF)in a mouse model of colitis-associated cancer(CAC),and to study the cellular source of G-CSF in colorectum area.MethodCAC in mouse model was induced by carcinogen azoxymethane(AOM)and pro-inflammatory agents dextran sodium sulfate(DSS).The expression of G-CSF in the colorectum of normal and AD mice was examined by immunohistochemistry.The cellular source of G-CSF was investigated by immunofluorescence.ResultAOM/DSS mouse model well simulated the characteristic pathological process of CAC,and was staged as AD1,AD2 and AD3 in our study.The colonrectum in AD1 mice suffered heavy infiltration of lymphocytes.AD2 mice had dysplasia and adenoma.AD3 mice appeared cancer in situ.AD mice had a higher expression level of G-CSF than normal mice,and the expression of G-CSF in AD2 mice was the highest.G-CSF was mainly co-localized with the intestinal epithelial cells of colorectum area,and only a few myofibroblasts and macrophages exhibited significant co-localization with G-CSF.ConclusionIn this study,AOM/DSS mice underwent a typical development process of normal mucosa→hyperplasia→adenoma→adenocarcinoma,which is similar with the development of human CAC.The level of G-CSF in AD mice was higher than that of normal mice,and the expression level of G-CSF in AD2 mice was the highest.In AOM/DSS mouse model,the major cellular source of G-CSF were intestinal epithelial cells,and a few myofibroblasts and macrophages can also produce G-CSF.
colitis-associated cancer;inflammatory bowel diseases;granulocyte colony-stimulating factor Oncol prog,2016,14(2)
R735.3
A
10.11877/j.issn.1672-1535.2016.14.02.20
2015-10-10)
国家重点基础研究发展计划(2014CB542103);北京市自然科学基金(7144237);科技北京百名领军人才培养工程(Z13110700513001);北京市科技新星计划(Z131107000413066)
(corresponding author),邮箱:yuanwei7568@163.com
