丹参酮ⅡA通过调控PKC/CyclinD1通路抗大鼠心肌成纤维细胞增殖作用研究
2016-10-17付晓杰孙红霞
付晓杰,孙红霞
(1.北华大学校医院,吉林 吉林 132013;2.北华大学药学院,吉林 吉林 132013)
丹参酮ⅡA通过调控PKC/CyclinD1通路抗大鼠心肌成纤维细胞增殖作用研究
付晓杰1,孙红霞2
(1.北华大学校医院,吉林 吉林132013;2.北华大学药学院,吉林 吉林132013)
目的观察丹参酮ⅡA(TaishinoneⅡA,TSN)和蛋白激酶C(PKC)抑制剂白屈菜红碱(Chelerythrine,Chele)抗血管紧张素Ⅱ(Angiotensin Ⅱ,AngⅡ)诱发的心成纤维细胞(Cardiac fibroblast,CFb)增殖、细胞周期、Ⅰ型胶原纤维(Collagen Ⅰ)、PKC和细胞周期蛋白CyclinD1表达的影响,阐明TSN抗CFb增殖的分子机制.方法培养的新生Wistar大鼠CFb分为对照组、AngⅡ组、Chele+AngⅡ组、Chele+AngⅡ+TSN组和AngⅡ+TSN组,胰酶消化、差速贴壁培养CFb,噻唑蓝(MTT)比色法检测细胞增殖;免疫细胞化学染色(IC)法测定Collagen I含量;流式细胞仪(FCM)检测细胞周期;免疫印迹法(WB)检测PKC和细胞周期蛋白CyclinD1表达.结果 与AngⅡ组比较,Chele和TSN组及Chele+AngⅡ+TSN组能显著降低CFb增殖率(P<0.05或P<0.001),降低Collagen Ⅰ含量(P<0.05或P<0.01),提高CFb G0/G1期细胞百分比,降低S期细胞百分比(P<0.05或P<0.01),抑制PKC和CyclinD1蛋白表达(P<0.05或P<0.01).结论 TSN和Chele能显著抑制由AngⅡ诱导的CFb增殖和胶原蛋白分泌,其机制可能是通过抑制PKC-CyclinD1传导通路实现的.
丹参酮ⅡA;白屈菜红碱;CyclinD1;心肌成纤维细胞
【引用格式】付晓杰,孙红霞.丹参酮ⅡA通过调控PKC/CyclinD1通路抗大鼠心肌成纤维细胞增殖作用研究[J].北华大学学报(自然科学版),2016,17(5):616-619.
心肌纤维化(MF)以心成纤维细胞增殖、胶原大量沉积和分布为特征,可导致心室重构.AngⅡ通过CFb上Ⅰ型受体,诱导CFb增殖并分泌大量胶原纤维,导致MF发生[1].研究表明:丹参酮ⅡA(TSN)是常用的活血化瘀中药丹参提取物,能抑制CFb增殖和减少胶原合成[2],但对其抑制增殖机制的信号通路研究报道甚少.因此,本实验观察TSN对AngⅡ诱导成纤维增殖、细胞周期变化、 Ⅰ型胶原含量、PKC和细胞周期蛋白D1表达及PKC抑制剂对各指标影响,为其抗MF作用信号通路作用的研究提供依据.
1 材料与方法
1.1细胞、试剂、仪器
1~3 d出生乳鼠心肌细胞,放置含10% 胎牛血清IMDM培养液,在37 ℃、5% CO2、饱和湿度条件下培养60~90 min.差速贴壁法分离CFb,经倒置显微镜、TE、IC检测FN阳性染色及α-SMC阴性染色,CFb纯度98%,近融合生长时按1∶6传代,实验采用3代细胞.TSN(中国药品所,编号115767-201416);白屈菜红碱、胰蛋白酶(宝泰克公司);S-P免疫组化试剂盒(福州迈新);PKC,CyclinD1,AngⅡ,MTT(西格玛公司);IMDM培养基(HyClone 公司);胎牛血清(杭州四季青);CO2培养箱(三瑞斯公司);自动酶标检测仪(AUSTRALIA);奥林巴斯倒置显微镜(日本).
1.2实验分组
Con组:IMDM空白培养液;AngⅡ组:培养基加入终浓度10-7mol/L AngⅡ;Chele+AngⅡ组:培养基加入终浓度为10-7mol/L AngⅡ和10-6mol/L Chele;Chele+AngⅡ+ TSN组:培养基加入10-7mol/L AngⅡ,10-6mol/L Chele,10-6mol/L TSN;TSN组:培养基加入10-6mol/L TSN,10-7mol/L AngⅡ.
1.3MTT检测细胞增殖能力
每组7复孔,将各组细胞接种于培养板中,药物作用24 h,每孔加入5 g/L MTT 10 μL,有蓝紫色结晶沉淀后加入DMSO 150 μL降解沉淀,酶标仪490 nm波长处测定光吸收值(A值),经IMDM不含细胞的空白孔调零.各干预组与AngⅡ组A值差值百分率表示CFb增殖抑制率.
1.4FCM方法检测细胞周期
各干预因素作用24 h后收集细胞,70%、-20 ℃乙醇过夜,重悬于PBS中,将RNA酶加入细胞悬液中,37 ℃水浴30 min,加入PI染液,冰浴30 min.用尼龙网过滤,上机.根据PI标记的DNA含量确定细胞所处细胞周期,并计算各时相分布百分比(%).
1.5免疫组化法检测Collagen I纤维表达
用预先放置7 mm×7 mm盖玻片的24孔培养板培养CFb,药物干预24 h,取出盖玻片用PBS洗涤,经Poly-甲醛固定,SP法IC染色,一抗用PBS作阴性对照.阳性细胞为胞质棕黄色颗粒,Image-ProPlus 分析系统行图像分析,对表达于胞质的棕黄色颗粒定位.计算每组切片视野阳性点面积总和、光密度值,确定细胞中Ⅰ型胶原平均阳性强度百分比(%).
1.6WB检测PKC和细胞CyclinD1蛋白表达
药物干预12 h收集细胞,SDS-PAGE分离蛋白,100 V、20 mA电转移2 h,PVDF 膜蛋白转移,BSA封闭,加稀释的小鼠抗大鼠CyclinD1抗体,4 ℃孵育过夜,HRP标记IgG抗体室温孵育2 h,洗膜,DAB显色.凝胶成像系统分析PKC和CyclinD1灰度值,与β-actin比值表示蛋白质含量.
1.7统计学分析
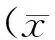
2 结 果
2.1MTT法检测TSN对CFb增殖抑制作用
AngⅡ组MTT的代谢率提高,MTT-OD值明显升高,与Con组比较具有显著性统计学意义(P<0.001),可见AngⅡ对CFb具有促增殖作用.加入各干预因素后,MTT值显著低于AngⅡ组,具有显著性统计学意义(P<0.05或P<0.01).结果见表1.
2.2FCM检测细胞周期
CFb S期的细胞百分率在AngⅡ组显著高于Con组,G0/G1期细胞百分率显著低于Con组(P<0.01).各不同处理因素作用后,CFb S期的细胞百分率显著下降,而G0/G1期细胞百分率显著升高(P<0.05或P<0.01).结果见表2.
表1白屈菜红碱和丹参酮ⅡA对CFb增殖的抑制作用
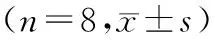
注:与对照组比较,#:P<0.001,P<0.05;与Ang Ⅱ组比较,**:P<0.01 ;△:P<0.05
表2白屈菜红碱和丹参酮ⅡA对细胞周期的影响
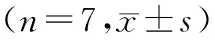
注:与对照组比较,#:P<0.05,##:P<0.01;与 AngⅡ组比较,*:P<0.05,**:P<0.01;与AngⅡ+Chele组比较,△:P<0.05
2.3IC检测Ⅰ型胶原纤维表达
与对照组相比,AngⅡ组棕黄色染色细胞增多,显示Collagen Ⅰ表达量明显提高(P<0.01);与AngⅡ相比,Chele+AngⅡ组和AngⅡ+TSN组降低Collagen Ⅰ表达(P<0.01),AngⅡ+Chele+TSN组最为明显(P<0.001),与AngⅡ+Chele group 比较,差异显著(P<0.01).见图1,表3.
2.4WB检测PKC和CyclinD1蛋白表达
AngⅡ组PKC,CyclinD1蛋白表达与Con组比较明显升高(P<0.01).与AngⅡ组比较,Chele组、TSN组具有明显的抑制PKC和CyclinD1蛋白表达作用(均P<0.05),AngⅡ+Chele+TSN共用组抑制作用最强(P<0.01),与Chele组比较差异具有显著性统计学意义(P<0.05).见图2,表4.
注:与对照组比较,#:P<0.01;与 AngⅡ组比较,*:P<0.05,**:P<0.01;与AngⅡ+chele组比较,△:P<0.05
3 讨 论
心肌纤维化(MF)以CFb增殖并大量分泌胶原蛋白为显著特征,后期发展为心室重构.AngⅡ与CFb上AT1型受体结合,通过G蛋白激活磷脂酶C(PLC),PLA2和PLD.PLC催化PIP2产生二酰基甘油(DAG)和三磷酸肌醇(IP3),IP3通过促进Ca2+释放进而间接激活PKC,DAG可直接活化PKC,促进CFb增殖.研究显示:多种信号通路参与了MF发生和发展[3-4],活化后的PKC在经核蛋白磷酸化后与转录因子C-Myc,NF-κB,C-Fos和C-Jun结合,启动基因转录和蛋白翻译过程,诱导MF发生[4-5].
在G1期调节中,CyclinD1是一种重要的调控蛋白,还属于及早表达蛋白,与细胞周期蛋白依赖激酶(CDK)形成复合物,经由CDK激酶作用后磷酸化,增进一些关键基因表达.CyclinD1是Cyclin D家族成员,编码蛋白与CDK2,CDK4,CDK5,CDK6 等激酶结合,活化CDK,使细胞由G1期进入S期[5].细胞增殖主要取决于细胞内CDK活性,其活性依赖于正调控因子细胞周期蛋白及负调控因子CDI 的浓度,形成以视网膜细胞瘤蛋白(pRb)为关键的复杂调控系统.磷酸化的Rb蛋白构象改变释放结合的核转录因子E2F和具有激酶活性的C-Abl蛋白等,游离的E2F进入核内,结合一系列与S 期相关基因启动子区域,促进基因转录,基因产物促进细胞通过细胞周期的限制点进入自主分裂程序[6].
TSN是丹参根的干燥提取物,众所周知丹参具有活血化瘀作用.诸多研究证实:TSN ⅡA在抗MF作用中较为肯定,TSN ⅡA具有抗心肌肥厚及抗血小板聚集等作用[7].实验数据表明:Chele+TSN明显降低MTT值(P<0.05或P<0.01),减少Ⅰ型胶原含量(P<0.01或P<0.001),明显增多G0/G1期细胞百分比,减少S期细胞百分比(P<0.05或P<0.01),减少PKC,CyclinD1蛋白表达(P<0.05或P<0.01),与Chele+AngⅡ相比,有显著差异(P<0.05或P<0.01),显示TSN与Chele可协同作用抑制PKC和CyclinD1蛋白表达,从而抑制CFb增殖和胶原生成.PKC活性受到抑制后,AngⅡ诱导的CFb增殖受阻.Chele+AngⅡ组和TSN+AngⅡ组比较上述各指标无显著差异(P>0.05),TSN组与AngⅡ组相比数值虽有下降,但未降到正常水平,说明TSN不能完全阻断PKC通路,尚有其他通路参与PKC介导的AngⅡ促CFb增殖作用[8-10].文献报道:CyclinD1属早期调节蛋白,故选取12 h作为干预因素时间点[11].PKC抑制剂能明显抑制CFb增殖和Ⅰ型胶原分泌,降低CyclinD1蛋白表达,抑制细胞增殖,说明AngⅡ诱导MF是通过激活PKC信号通路得以实现.
综上所述,AngⅡ通过PKC通路活化来增加CFb增殖和胶原分泌,导致MF,TSN通过部分阻断PKC通路对抗AngⅡ的诱导作用,减少细胞周期CyclinD1蛋白表达,抑制细胞增殖,使细胞停滞于G0期,从而阻止CFb增殖和胶原蛋白合成与分泌,抑制MF的发生.
[1] Zhang H T,Zhao L Y,Liu C Z,etal.Effect of carvedilol on NOS/NO system in cardiac fibroblast with hepertensive rat [J].J Chin Arteriosclerosis,2004,12(3):321-324.
[2] Cai H,Zhao Z M,Xiu C Y.Effect of Taishinone ⅡA on cardiac fibroblast proliferation and transfor ming growth factor β1 induced by lysophosphatidic acid[J].Med Postgraduate Bull,2008,21(2):621-624.
[3] Martin van Eickels,Hans Vetter,Christian Grohé.Ang- iotensin-converting enzyme (ACE) inhibition attenuates insulin-like growth factor-I(IGF-I)induced cardiac fibr- oblast proliferation[J].British Journal of Pharmacology,2000,131:1592-1596.
[4] Li A G,Zhao L Y,Zheng Q S,etal.Effect of avastatin on cardiac fibroblast endothelin-1 and NOS/NO system in adult rat[J].Med Postgraduate Bull,2003,16(10):733-735.
[5] Lents N H,KeTSNn S M,Bellone C,etal.Stimulation of the Raf/MEK/ERK cascade is necessary and sufficient for activation and Thr-160 phosphorylation of a nuclear-targeted CDK2[J].J Biol Chem,2005,277:47469-47475.[6] Larsen E C,Di Gennaro J A,Saito N,etal.Differential requirement for classic and novel PKC isoforms in res- piratory burst and phagocytosis in RAW 264.7 cells[J].J Immunol,2007,165(5):2809-2817.[7] Takahashi K,Ouyang X,Komatsu K,etal.Sodium tanshinone ⅡA sulfonate derived from Danshen (Salviamiltiorrhiza) attenuates hypertrophy induced by angi- otensin Ⅱ in cultured neonatal rat cardiac cells[J].Biochem Pharmacol,2002,64(4):745-749.
[8] Tojima Y,Fujimoto A,Delhase M,etal.NAK is an I kappaB kinase activating kinase[J].Nature,2007,404(6779):778-782.
[9] Chen C,Sytkowski A J.Erythropoietin activates two distinct signaling pathways required for the initiation and the elongation of c-myc[J].Biol Chem,2006,276 (42):38518-38526.
[10] CHIO C C,CHANG Y H,HSU Y W,etal.PKA dependent activation of PKC,p38 MAPK and IKK in macrophage:implication in the induction of inducible nitric oxide synthase and interleukin-6 by dibutyryl cAMP[J].Cell Signal,2006,16:565-575.
[11] Calbo J,Parreno M,Sotillo E,etal.G1 cyclin/cyclin-dependent kinase-coordinated phosphorylation of endoge- nous pocket proteins differentially regulates their interac- tions with E2F4 and E2F1 and gene expression[J].J Biol Chem,2007,277:50263-50274.
【责任编辑:陈丽华】
Inhibition of Taishinone ⅡA on Cardiac Fibroblasts Proliferation through PKC/CyclinD1Pathways in Rats
Fu Xiaojie1,Sun Hongxia2
(1.Hospital of Beihua University,Jilin 132013,China;2.PharmacyCollegeofBeihuaUniversity,Jilin132013,China)

Taishinone(TSN)ⅡA;Chelerythrine(Chele);cyclinD1;cardiac fibroblast
1009-4822(2016)05-0616-04
10.11713/j.issn.1009-4822.2016.05.012
2016-03-12
吉林省科技发展计划项目(200705355).
付晓杰(1966-),女,主管检验师,主要从事检验学临床研究,E-mail:752261452@qq.com;通信作者:孙红霞(1965-),女,博士,教授,硕士生导师,主要从事心血管药理学研究,E-mail:sunhongxia@126.com.
R542.2
A
