异烟肼与牛血清白蛋白相互作用的光谱和电化学研究
2016-10-16王婉君孙登明
王婉君, 马 伟*, 孙登明
(淮北师范大学化学与材料科学学院,安徽淮北 235000)
蛋白质是生命活动的主要承担者,是药物发挥药效的重要载体和靶分子,它能与进入体内的药物小分子迅速的结合并达到动态平衡,从而发挥药物的生物学功效[1,2],因此研究具有药理活性的小分子与蛋白质的相互作用,对于解析药物发挥药效的作用机理,揭示药物药效的实质内涵具有重要的意义,同时也是药物动力学及临床药理学的重要内容。当前药物小分子和牛血清白蛋白相互作用的研究已见报道[3,4],但用电化学方法和荧光光谱法同时研究小分子与蛋白质的作用机制和测定方法报道较少。
异烟肼(INH)又称4-吡啶甲酰肼,是异烟酸的酰肼,对结核杆菌有抑制和杀灭作用,其生物膜穿透性好,被列为首选抗结核药物[5]。本文用自制的L-天冬氨酸修饰电极(PLA/GCE),用循环伏安法研究了INH与牛血清白蛋白(BSA)的相互作用,测定了结合常数、结合位点数,并与荧光光谱法进行了比较。同时INH与BSA的作用具有定量关系,本文研究了测定的最佳条件,利用荧光光谱法和电化学方法对INH和BSA进行了测定,获得了满意的结果。
1 实验部分
1.1 仪器和试剂
BAS100/W电化学分析系统(美国,BAS公司);FP-6500型荧光光谱仪(日本,岛津公司);pHS-3C型精密酸度计(上海康仪仪器有限公司)。电化学实验采用三电极体系:自制聚L-天冬氨酸修饰电极(PLA/GCE)[6]为工作电极,Ag/AgCl电极为参比电极,铂丝为辅助电极。
BSA(国药集团化学试剂有限公司)储备液:2.0×10-4mol/L,按常规配制,在4 ℃左右保存,使用时再稀释至所需浓度;INH储备液:1.0×10-2mol/L,使用时再稀释至所需浓度;L-天冬氨酸溶液:5.0×10-3mol/L;磷酸盐缓冲溶液(PBS);其它试剂均为分析纯。水为二次石英亚沸蒸馏水。
1.2 实验方法
1.2.1电化学法取pH=7.0的PBS 2.0 mL,1.0×10-3mol/L INH溶液5.0 mL,加入不同浓度的BSA溶液,以水定容于10 mL容量瓶中,摇匀,静置10 s后倒入电解池。在温度298 K条件下,测量INH溶液、INH和BSA混合溶液的循环扫描伏安(CV)图。
1.2.2荧光光谱法在10 mL比色管中,加入pH=7.0的PBS 2.0 mL,浓度为2.0×10-4mol/L BSA溶液1.0 mL,再加入不同浓度的INH溶液,以水定容,摇匀,静置30 min。于温度298 K下,在荧光光度计上记录286~500 nm波长范围内的荧光发射光谱(λex=285 nm,λem=343 nm,激发和发射狭缝宽度均为5 nm)。
2 结果与讨论
2.1 BSA与INH相互作用的CV图和荧光猝灭光谱图
INH和INH-BSA体系的循环伏安图见图1。INH在聚L-天冬氨酸修饰电极上产生一个灵敏的氧化峰,加入BSA后INH的峰电流明显降低,峰电位左移,表明两者之间发生了相互作用。
由于色氨酸和酪氨酸残基等的存在使蛋白质能发出较强的荧光。由BSA和INH相互作用的荧光光谱图(图2)可以看出,在343 nm处有荧光最大发射峰,固定BSA的浓度,BSA的内源荧光强度随着INH浓度的增加逐渐降低,表明INH能猝灭BSA的内源荧光,两者之间发生了相互作用。
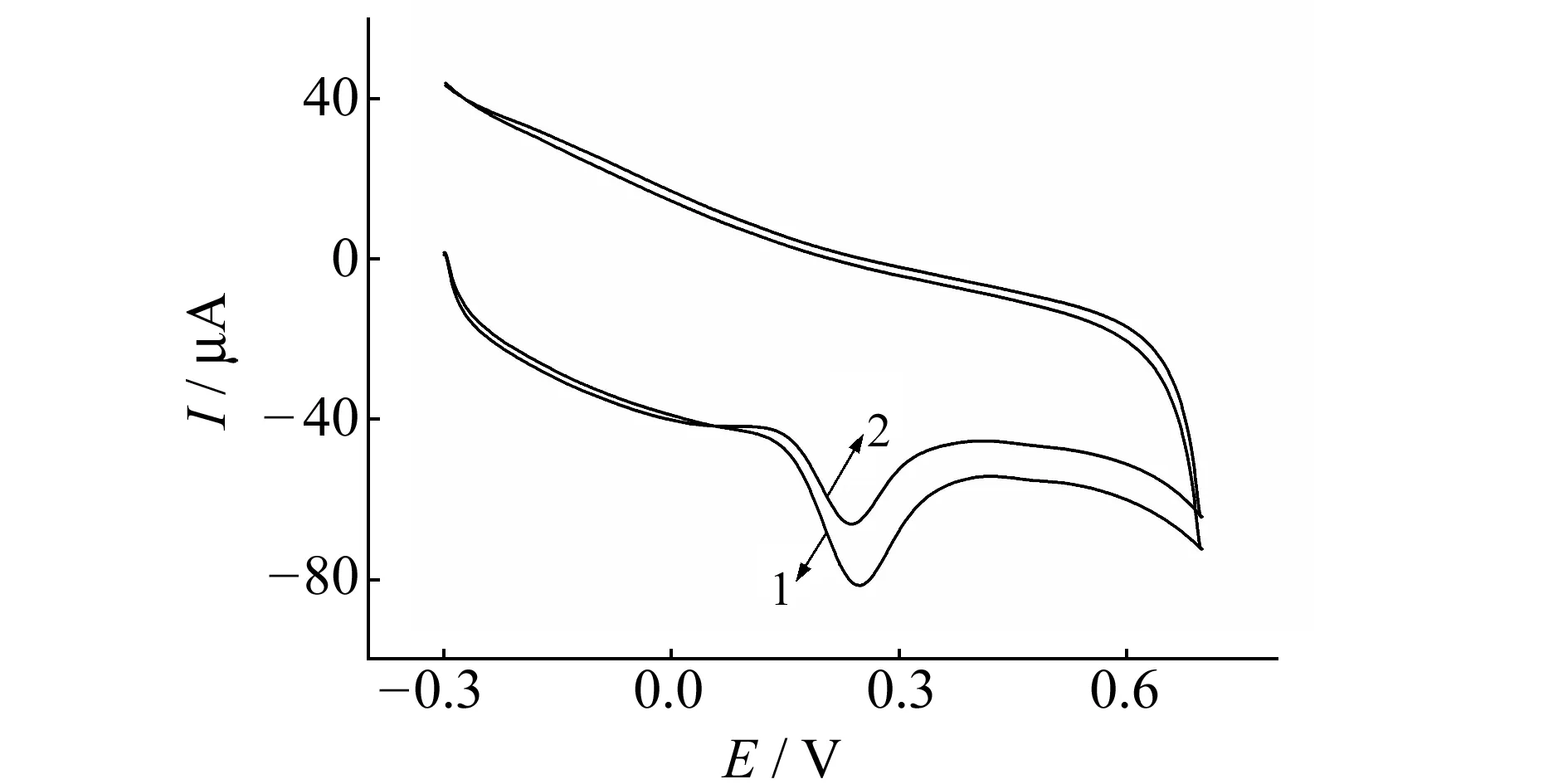
图1 异烟肼与牛血清白蛋白相互作用的循环伏安图Fig.1 Cyclic voltammograms of BSA in the presence of INH1.INH;2.INH-BSA;cINH=5.0×10-4 mol/L;cBSA=2.0×10-5 mol/L;t=5 s;v=0.12 V/s;pH=7.0.
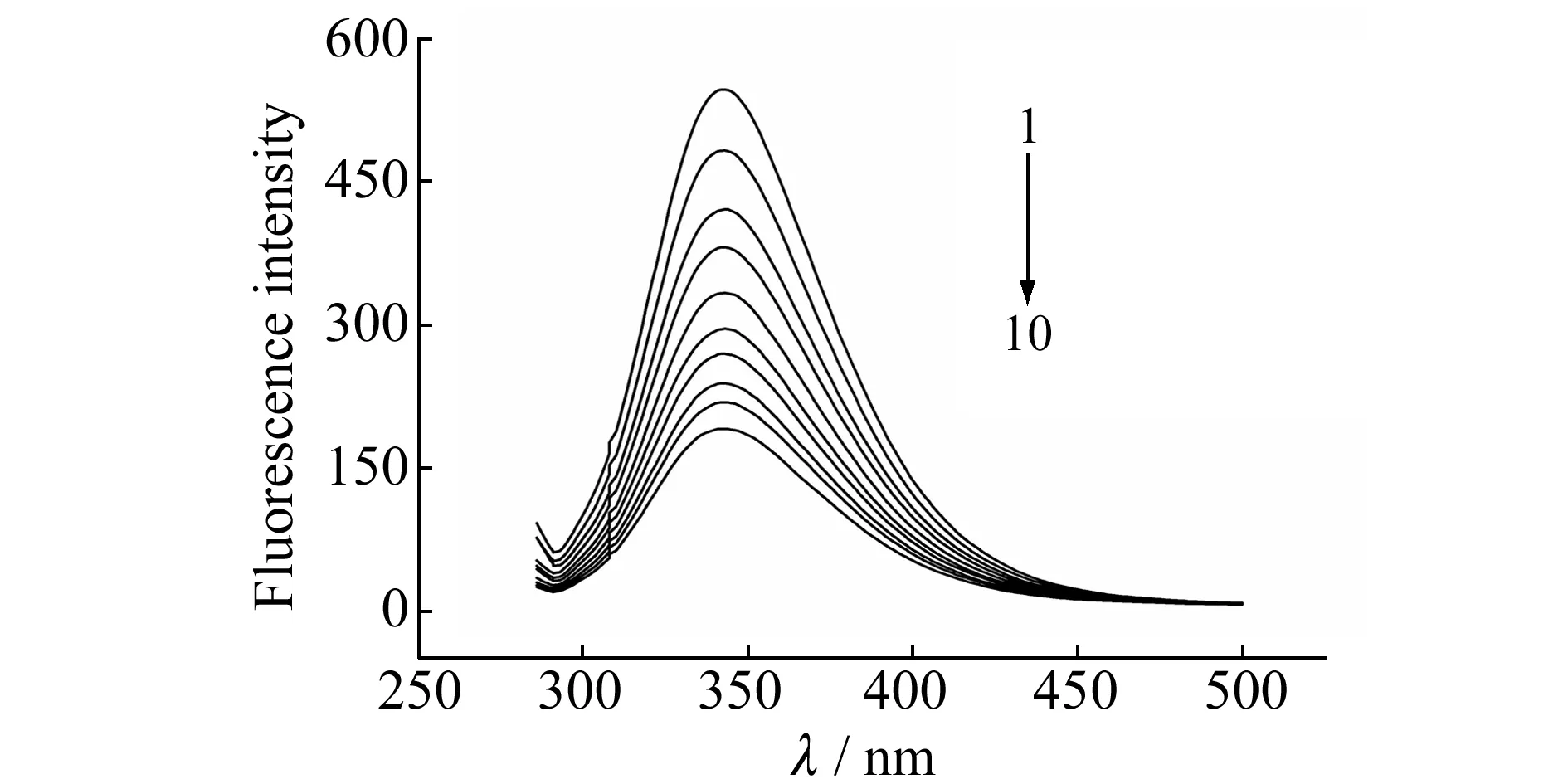
图2 异烟肼与牛血清白蛋白相互作用的荧光猝灭光谱图Fig.2 Fluorescence quenching of BSA in the presence of INH cBSA=2.0×10-5 mol/L;cINH(1-10)=0,5.0×10-5,1.0×10-4,1.5×10-4,2.0×10-4,2.5×10-4,3.0×10-4,3.5×10-4,4.0×10-4,4.5×10-4 mol/L;pH=7.0.
2.2 INH与BSA相互作用的光电化学机理
2.2.1电化学机理采用循环伏安法,改变底液的酸度进行测定,结果见图3。它表明,随着pH值的增加,INH与INH-BSA体系中氧化峰和还原峰电位均逐渐负移,峰电位与pH呈良好的线性关系,INH:Epa(V)=0.6307-0.05075pH,R=0.9977,斜率为50.75 mV/pH,接近59 mV/pH,说明INH在电极上发生了等电子等质子反应,氧化还原峰为INH分子苯环上的邻羟基氧化所致;INH-BSA:Epa(V)=0.6341-0.05037pH,R=0.9986,斜率为50.37 mV/pH,比INH的斜率减小。

图3 (A)异烟肼在修饰电极上随pH的变化的CV曲线;(B)峰电位与pH的关系曲线;(C)异烟肼-牛血清白蛋白在修饰电极随pH的变化的CV曲线;(D)峰电位与酸度的关系曲线Fig.3 (A)Cyclic voltammograms of INH at modified electrode at different solution pH;(B) The relationship between the peak potential and pH;(C) Cyclic voltammograms of INH-BSA at modified electrode at different solution pH;(D) The relationship between the peak potential and pH pH(from 1 to 17):2.0,2.5,3.0,3.5,4.0,4.5,5.0,5.5,6.0,6.5,7.0,7.5,8.0,8.5,9.0,9.5,10.0;scan rate:120 mV/s;cINH=5.0×10-4 mol/L,cBSA=2.0×10-5 mol/L,t=5 s.

假定INH与BSA只形成一种简单的化合物BSA-mINH,而结合常数(β)和结合位点数(m)可根据下式[8]求得:
lg[△I/(△Imax-△I)]=lgβ+mlg[Q]
(1)
式中,△Imax表示加入BSA前后INH峰电流的最大差值。作lg[△I/(△Imax-△I)]~lg[Q]的关系图,其线性方程为:lg[△I/(△Imax-△I)]=4.189+1.137lg[Q],R=0.9970。求得m=1.137,β=1.544×104L/mol。
2.2.2荧光猝灭机理荧光猝灭过程分为静态猝灭和动态猝灭[9]。静态猝灭是猝灭剂和荧光物质的基态分子之间的相互作用,其猝灭过程遵循Stern-Volmer方程:
F0/F=1+Kqτo[Q]=1+KSV[Q]
(2)
上式中,Fo是未加入猝灭剂时的荧光强度;F是加入猝灭剂后的荧光强度;Kq是双分子猝灭过程速率常数,KSV是Stern-Volmer动态猝灭常数。而[Q]则是猝灭剂的浓度,τo是猝灭剂不存在的条件下生物大分子的平均寿命,通常生物大分子的荧光寿命大约为10-8s。
由实验结果得出,INH与BSA相互作用的Stern-Volmer方程曲线是一条直线。它们显示出良好的线性关系,其线性回归方程为:F0/F=1+4.083×103[Q],R=0.9966。方程对应的斜率为Stern-Volmer方程曲线的猝灭常数KSV,即KSV=4.083×103L/mol。由KSV=Kqτo,可以求得猝灭过程的速率常数Kq=4.083×1011L/(mol·s),远大于各类淬灭剂对生物大分子的最大扩散常数2.00×1010L/(mol·s),因此INH对BSA的荧光淬灭以静态猝灭为主。
因为INH对BSA是静态猝灭过程,所以可用对数方程来计算二者的结合常数K和结合位点数n[10]:
lg[(F0-F)/F]=lgK+nlg[Q]
(3)
式中,F0和F分别是不存在和存在猝灭剂时的荧光强度,K为蛋白质和猝灭剂的结合常数,n为结合位点数,[Q]是猝灭剂的浓度。
以lg[(F0-F)/F]对lg[Q]作图为一直线,其线性方程为:lg[(F0-F)/F]=4.170+1.177lg[Q],R=0.9991;则K=1.479×104L/mol,n=1.177。与电化学方法基本一致。
2.2.3热力学函数的变化及作用力类型的确定小分子与生物大分子的相互作用力类型包括氢键、范德华力、静电引力、疏水作用力[11,12],根据反应前后热力学参数焓变△H和熵变△S的相对大小,可以判断出药物与蛋白质相结合的主要作用力类型。根据298 K、308 K两个温度下的结合常数可以计算出INH和BSA相互作用的热力学函数值,结果列于表1。根据实验结果298 K、308 K时△H<0,且△S>0。因此可以推测在该温度范围内,该体系中INH和BSA之间的作用力主要是静电作用力和疏水作用力。

表1 不同温度下INH与BSA相互作用的热力学参数
2.3 测定INH和BSA的最佳条件
实验表明,电化学线性扫描伏安法测定INH-BSA的最佳条件为:pH=3.0的PBS,用量为2.0 mL;扫描电位范围为-0.3~0.7 V;扫描速率为0.12 V/s。荧光光谱法测定INH-BSA的最佳条件为:pH=7.0的PBS,用量为2.0 mL;激发波长为285 nm;发射波长为343 nm;放置时间15 min。在最佳条件下,分别用荧光光谱法(固定BSA浓度为2.0×10-5mol/L)、电化学循环伏安法(固定INH浓度为5.0×10-4mol/L)对INH-BSA进行了测定,测定结果见表2。

表2 工作曲线(n=8)
2.4 干扰试验
采用荧光光谱法对10 mL混合后浓度为5.0×10-4mol/L的INH,及2.0×10-5mol/L的BSA溶液进行测定,允许误差在±5%以内,共存物质允许量(mg)为:K+、Na+(4.0),Ba2+、Pb2+(1.0),Fe3+(0.5),Mg2+、Mn2+(0.3),Ca2+、Zn2+、Al3+(0.2),Cu2+、葡萄糖(0.1)。
采用循环伏安法对混合后浓度为5.0×10-4mol/L的INH,及2.0×10-5mol/L的BSA进行测定,共存物质的允许量(mg)为:Na+、K+、Na+、Mg2+、Al3+、Ca2+、Mn2+、Ba2+、Co2+、葡萄糖(≥1.0 mg,未做最高限),Fe3+(0.3),Pb2+(0.5),半胱氨酸、Cu2+(0.1)。
2.5 样品分析
将一定量异烟肼片溶解于100 mL容量瓶中,配制一定浓度的溶液,取5 mL的异烟肼样品溶液并加入2 mL BSA、3 mL PBS(pH=7.0),采用电化学法进行分析;另外,对BSA配制了不同浓度的合成样品,取2 mL并加入5 mL INH、3 mL PBS(pH=7.0),采用荧光光谱法进行分析,结果如表3。

表3 INH和BSA合成样品分析(n=5)
3 结论
采用电化学、荧光光谱两种方法对INH与BSA的相互作用进行了研究。结果表明,INH与BSA之间结合作用较强,静态猝灭导致BSA内源荧光减弱,而运用电化学方法,BSA的加入使INH氧化峰电流降低,峰电位基本不变,峰电流的降低值与所加入的BSA浓度在一定范围内呈线性关系。研究了其结合常数、结合位点数和线性范围等。该研究对于阐明INH在体内的运输过程和药用机理,设计和合成新药的研究有一定的指导意义。
