DFMG调节TLR-4抑制损伤内皮细胞对平滑肌细胞增殖和迁移促进作用
2016-10-15杨舒婷符晓华
黄 荷,张 勇,杨舒婷,符晓华
(湖南师范大学医学院心血管疾病研究室,长沙 410113)
DFMG调节TLR-4抑制损伤内皮细胞对平滑肌细胞增殖和迁移促进作用
黄 荷,张 勇,杨舒婷,符晓华
(湖南师范大学医学院心血管疾病研究室,长沙 410113)
目的:观察7 -二氟亚甲基- 5,4-二甲氧基异黄酮(DFMG)是否能干预损伤内皮细胞对平滑肌细胞增殖和迁移的促进作用,且其干预过程是否与TLR4信号通路相关。方法:采用CCK-8法和Transwell迁移法测定LPC诱导的内皮细胞的损伤对平滑肌细胞的增殖和迁移的影响。采用Western blot和荧光定量PCR测定损伤共培养体系中的内皮细胞TLR4在蛋白水平和基因水平的表达。运用TLR4特异性激动剂(LPS)和特异性的抑制剂(CLI095),采用CCK8法和Transwell迁移法测定损伤共培养体系中平滑肌细胞的增殖能力和迁移能力。结果:①随着LPC浓度的增加,LPC诱导的内皮细胞损伤引起平滑肌细胞的增殖和迁移的效应增强,并且选取30 μM的LPC作用于内皮细胞并与平滑肌细胞共培养作为实验的损伤共培养模型。②经光密度值分析,LPC组的内皮细胞TLR4的表达量是对照组的2倍;经荧光定量PCR分析,LPC组的内皮细胞TLR4的表达量是对照组的2.414倍。③相比,损伤组和LPS组的平滑肌细胞的增殖和迁移能力较对照组更强;相比,CLI095组和DFMG组的平滑肌细胞的增殖和迁移能力较损伤组更弱。结论:LPC诱导的内皮细胞的损伤可以引起平滑肌细胞的增殖和迁移,而DFMG可能是通过抑制TLR4信号阻碍损伤的内皮细胞对平滑肌细胞增殖和迁移的促进作用。
内皮细胞;平滑肌细胞;增殖;迁移;共培养;DFMG、TLR4
动脉粥样硬化(Atherosclerosis,AS)是一种炎症性疾病[1-3],是心血管病中常见的最重要的病理过程。而血管内皮的损伤被认为是AS的“始发因素”。血管内皮损伤可引起血管壁通透性增加,减少NO、内皮素-1的分泌并促进血管平滑肌细胞的增殖和迁移以及巨噬细胞活化成为泡沫细胞,进而引起AS[4-6]。研究表明,TLR4参与了动脉粥样硬化的发生与发展[7-10]。7-二氟甲氧基-5,4’-二甲氧基金雀异黄素(7-difluoromethoxy-5,4’- dimethoxygenistein,DFMG),是本课题组自主合成的新型活性化学实体(专利申请号:2007101043894;公开号:CN 101225081A)[11]。前期试验证实DFMG有抗动脉粥样硬化的作用。那么,DFMG是否可能是通过抑制TLR4信号来拮抗损伤内皮细胞对平滑肌细胞增殖和迁移的促进作用?
1 材料与方法
1.1 材料与试剂 人血管内皮细胞(VECs)和人血管平滑肌细胞(VSMCs)由本实验室保存;7-二氟甲氧基-5,4’-二甲氧基金雀异黄素,即DFMG,由本实验室合成并保存;溶血性磷脂酰胆碱(LPC)购自美国Sigma公司;实时定量PCR试剂盒、逆转录试剂盒、BCA蛋白定量试剂盒购自中国唯赞公司;DAB显影试剂盒购自以色列Bioind公司;TLR4一抗购自美国ABGENT公司;GAPDH一抗购自中国康为世纪公司;二抗购自中国康为世纪公司;Transwell共培养板购自美国康宁公司。
1.2 氧化损伤内皮细胞-平滑肌细胞共培养模型的制备 按照以下方法进行损伤共培养模型的建立。血管内皮细胞和血管平滑肌细胞分别稀释成细胞悬液1× 105/mL。血管内皮细胞种于下室,并用LPC进行预处理。然后,平滑肌细胞种于上室。细胞之间内没有直接的物理连接,但能通过分泌可溶性因子通过聚碳酸酯膜进行相互作用。其模型的最佳浓度用LPC设置的浓度梯度(0,10,20,30,40和50 μM)经统计学分析最终获取。
1.3 CCK-8法检测平滑肌细胞活力 血管内皮细胞生长至80%融合时,接种到Transwell下室,并与1 μM 的DFMG、1 μM的LPS或者1 μM的CLI095进行预孵育,再进行损伤共培养模型的建立。24h后进行CCK-8的测定。加 CCK-8之前更换新鲜培养基,去掉药物的影响。每孔加入20 μL的CCK-8 试剂(注意不要在孔中生成气泡,它们会影响 O.D值的读数)。将培养板在培养箱内孵育2小时后,用酶标仪测定在450 nm处的吸光度。 最后根据O.D值计算细胞活力值。
1.4 Transwell迁移实验测定平滑肌细胞的迁移能力
血管内皮细胞生长至80%融合时,接种到Transwell下室,并与1 μM的DFMG、1 μM的LPS或者1 μM的CLI095进行预孵育,再进行损伤共培养模型的建立。24 h后,取出Transwell小室(孔径8 μm),弃去孔中培养液,用无钙的PBS洗2遍,甲醇固定30分钟,将小室适当风干。0.1%结晶紫染色或者PI染色20 min,用棉签轻轻擦掉上层未迁移细胞,用PBS洗3遍。随机四个高倍视野计数。
1.5 Western blot实验测定TLR4蛋白水平的表达30 μM 的LPC作用于内皮细胞,并与平滑肌细胞共培养,24小时收集内皮细胞的蛋白样品,使用裂解液,反复冻融法提取蛋白。收集完蛋白样品后,测定每个蛋白样品的蛋白浓度(BCA法)。按照参考文献资料配制SDS-PAGE凝胶。并在收集的蛋白样品中加入适量浓缩的SDS-PAGE蛋白上样缓冲液(5×)。100℃变性 10 min,每孔蛋白上样量约为 50 μg。开始电泳。待溴酚蓝到达胶的底端处附近即可停止电泳,随即转膜并4℃ 封闭过夜。随后,参照抗体说明书进行一抗(TLR4稀释比例1∶1000;GAPDH稀释比例1∶5000)和二抗(稀释比例 1∶10000)的孵育。最后用ECL类试剂和显影仪来检测蛋白。结果用Image J软件进行光密度值测定TLR4的相对表达量。
1.6 实时荧光定量PCR法检测TLR4 mRNA的表达情况 采用Trizol法提取内皮细胞的总RNA。提取完毕后,采用紫外吸收测定法,即取少量液体用TE稀释(一般1∶100稀释)后,读取其在分光光度计260 nm和280 nm处的吸收值,可以测定RNA溶液浓度和纯度。并按照中国唯赞公司提供的操作说明进行反转录聚合酶链反应(Reverse Transcription-PCR,RT-PCR),得到比较稳定的cDNA。然后,根据NCBI中公布的TLR4基因序列(NM_138554),使用DNAMAN软件,设计扩增TLR4基因的引物,引物设计好后交由生工生物工程(上海)股份有限公司合成,采用PAGE纯化。引物序列为:TLR4-UP:5'- CCGAGGCCATTATGCTATGT -3';TLR4-DN:5'- TCCCTTCCTCCTTTTCCCTA -3'。按照中国唯赞公司提供的操作说明进行实时荧光定量PCR (Quantitative Real-time PCR)。得到的数据用于计算TLR4 mRNA 的相对表达量(以GAPDH基因为内参照)。
1.7 统计学分析 实验数据采用SPSS13.0 统计软件对数据进行方差齐性检验、单因素方差分析的统计学分析。若方差齐,则使用SNK法进行多样本之间的两两比较,若方差不齐,则使用Dunnett-t进行多样本之间的两两比较。当P<0.05则认为差异具有统计学意义。
2 结果
2.1 LPC诱导的内皮细胞的损伤促进平滑肌细胞的增殖 不同浓度的LPC(0,10,20,30,40和50 μm)作用于内皮细胞,并与平滑肌细胞共培养,24小时后收集平滑肌细胞,用CCK-8法测定平滑肌细胞的增殖,结果如图所示(图1)。由结果可知,从30 μm开始,随着LPC浓度的增加,平滑肌细胞的增殖能力也增加。
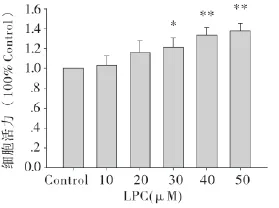
图1 损伤VECs对VSMCs增殖的影响
2.2 LPC诱导的内皮细胞的损伤促进平滑肌细胞的迁移
不同浓度的LPC(0,10,20,30,40和50 μm)作用于内皮细胞,并与平滑肌细胞共培养,24小时后收集平滑肌细胞,用PI染色,在荧光显微镜下计数迁移的细胞数,结果如图所示(图2)。由结果可知,从30 μm开始,随着LPC浓度的增加,平滑肌细胞的增殖能力也增加。并且选取30 μm的LPC作用于内皮细胞并与平滑肌细胞共培养作为实验的损伤共培养模型。

图2 损伤VECs对VSMCs迁移的影响
根据LPC浓度分为六组:(A)Control组/0 μM组,(B)10 μM组,(C)20 μM组,(D)30 μ组,(E)40 μM组,(F)50 μM组;采用PI染色计数迁移的平滑肌细胞(200×)
2.3 损伤共培养模型中内皮细胞的TLR4的表达将30 μm 的LPC作用于内皮细胞后与平滑肌细胞共培养,作为本实验的LPC组,而正常内皮细胞与平滑肌细胞共培养作为对照组。24小时后收集LPC组和对照组中的内皮细胞,提蛋白和RNA,Western Blot(图3A)和实时荧光定量PCR(图3B)的结果如图所示。经光密度值分析结果可知,LPC组内皮细胞TLR4的表达量约为对照组的2.3倍;经实时定量PCR相对定量分析可知,LPC组内皮细胞TLR4的表达量约为对照组的2.4倍。

图3(A) 损伤共培养体系中损伤VECs的TLR4蛋白水平的表达

图3(B) 损伤共培养体系中损伤VECs的TLR4基因水平的表达
2.4 DFMG通过TLR4抑制损伤内皮细胞对平滑肌细胞增殖的促进作用 实验分为五组:对照组(正常内皮细胞与平滑肌细胞共培养组)、损伤组(即LPC组或损伤共培养模型组,用30 μm的LPC损伤内皮细胞再与平滑肌细胞共培养)、TLR4激动剂组(即LPS组,内皮细胞提前与LPS进行预孵育,再进行损伤共培养模型的建立)、TLR4抑制剂组(即CLI095组,内皮细胞提前与CLI095进行预孵育,再进行损伤共培养模型的建立)和DFMG组(内皮细胞提前与DFMG进行预孵育,再进行损伤共培养模型的建立)。采用CCK-8法测量以上各组中平滑肌细胞的增殖,结果如图所示(图4)。由结果可知,与对照组相比,损伤组和LPS组的平滑肌细胞增殖能力增强;与损伤组相比,CLI095组和DFMG组的平滑肌细胞的增殖能力减弱。
2.5 DFMG通过TLR4抑制损伤内皮细胞对平滑肌细胞迁移的促进作用 实验分组如下(同3.4):对照组、损伤(LPC)组、TLR4激动剂(LPS)组、TLR4抑制剂(CLI095)组和DFMG组,采用结晶紫染色计数迁移的平滑肌细胞,结果如图所示(图5)。由结果可知,与对照组相比,损伤组和LPS组的平滑肌细胞的迁移能力增强;与损伤组相比,CLI095组和DFMG组的平滑肌细胞的迁移能力减弱。
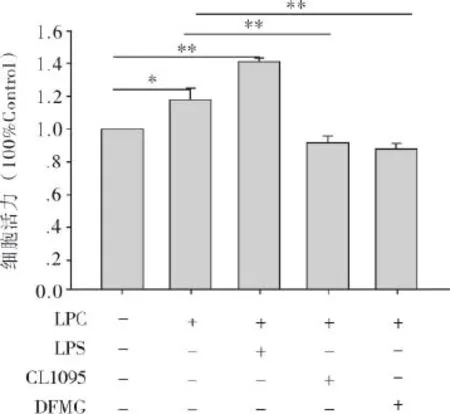
图4 DFMG通过TLR4抑制损伤VECs对VSMCs增殖的促进作用
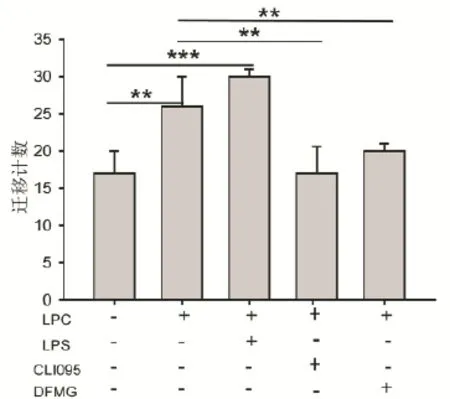
图5 DFMG通过TLR4抑制损伤VECs对VSMCs迁移的促进作用
3 讨论
动脉粥样硬化(Atherosclerosis,AS)始于血管内皮细胞的损伤。内皮细胞是位于血流与血管平滑肌之间一层表面光滑的细胞。它不但是一道生理屏障,而且能分泌合成多种血管活性物质、细胞因子、趋化因子和粘附因子等,从而调节细胞与血管功能。血管内皮损伤可引起血管壁通透性增加,减少NO、内皮素-1的分泌并促进血管平滑肌细胞的增殖和迁移以及巨噬细胞活化成为泡沫细胞,最后引起AS[4-6]。所以拮抗内皮细胞损伤对于防止AS十分重要。但内皮细胞并不是参与AS的唯一细胞,血管平滑肌细胞、巨噬细胞等都参与其中。这些因素相互作用,最终导致疾病的发生。其中,内皮细胞和平滑肌细胞又是构成血管壁最主要的细胞成分,两种细胞间的相互调节、相互影响和相互作用是血管壁自身结构稳定性得以维持的关键。因此研究内皮细胞与平滑肌细胞之间的相互作用尤为关键。近来兴起的Transwell共培养技术使得研究两种细胞之间的相互作用成为可能。本研究运用Transwell共培养技术建立的损伤内皮细胞-平滑肌细胞的共培养模型,将内皮细胞的损伤设为起始因素,观察其对平滑肌细胞的作用。结果(图1和图2)发现在损伤共培养体系中,平滑肌细胞的增殖能力和迁移能力均增强。
许多研究表明,动脉粥样硬化是一种炎症性疾病[7-10]。而TLR4在AS的炎症反应和免疫反应中有重要作用。Medzhito V[12]等于1997年首次发现并命名TLR4。Masakazu Shinohara[13]等指出TLRs以固有免疫和适应性免疫的方式参与了动脉粥样硬化的发生发展,并且起着关键的作用。S Gargiulo[7]等指出人和动物的动脉粥样硬化瘢块中,TLR4表达增多,并且TLR4的活化能上调多种细胞因子、趋化因子和粘附分子(IL-6,IL-1β,TNF-α,MMP-9等),这些因子和分子参与细胞募集和增殖,进而触发炎性反应,促进内膜下泡沫细胞集聚。在本研究中,我们用Western Blot和荧光定量PCR验证了在损伤共培养体系中内皮细胞TLR4的总蛋白与基因表达量增多(图3)。这些已有的研究成果以及我们的前期抗体芯片的结果均提示TLR4可能成为预防和治疗AS的重要靶点。
金雀异黄素(genistein,GEN),化学名为5,7,4’-三羟基异黄酮,是一种来源于豆类植物的异黄酮。已有研究证明金雀异黄素(Genistein,GEN)可通过TLR4及其信号转导通路抑制动脉粥样硬化的发生与发展[14,15]。7-二氟甲氧基-5,4’-二甲氧基金雀异黄素(7-difluoromethoxy-5,4’- dimethoxygenistein,DFMG),是本课题组针对GEN的缺点进行改造得到的新型活性化学实体[11,16]。我们的前期试验证实DFMG具有抗动脉粥样硬化的作用。但是,在内皮细胞与平滑肌细胞共同存在的情况下,DFMG的作用及其机制还不十分明确。本研究通过建立损伤内皮细胞-平滑肌细胞共
培养体系,模拟DFMG对内皮细胞和平滑肌细胞的作用方式,观察DFMG对损伤共培养体系中平滑肌增生迁移的影响。同时,运用TLR4激动剂(LPS)和TLR4拮抗剂(CLI095)验证DFMG的作用机制。结果(图4和图5)发现,与对照组的平滑肌细胞的增殖和迁移能力相比,损伤组和LPS组的平滑肌细胞的增殖和迁移能力增强;与损伤组的平滑肌细胞的增殖和迁移能力相比,CLI095组和DFMG组的平滑肌细胞的增殖和迁移能力减弱。也就是说,损伤的内皮细胞和TLR4激动剂(LPS)刺激的内皮细胞均能引起平滑肌细胞的增殖和迁移能力增强,而DFMG和TLR4拮抗剂(CLI095)的处理后的内皮细胞均能抑制损伤共培养模型中平滑肌细胞的增殖。一方面表明DFMG能抑制损伤共培养体系中平滑肌细胞的增殖和迁移;另一方面揭示了DFMG的这一抑制作用可能跟TLR4信号密切相关。但是在损伤共培养体系中,DFMG是如何发挥作用的,还有赖于更多的直接实验进行证实。本研究为进一步探讨DFMG 拮抗内皮细胞与平滑肌细胞的相互作用机制提供了理论和实验基础。
[1] Galkina E, Ley K. Immune and inflammatory mechanisms of atherosclerosis[J]. Annu Rev Immunol , 2009, 27: 165-197.
[2] Geng YJ, Jonasson L. Linking Immunity to Atherosclerosis: Implications for Vascular Pharmacology-A tribute to Göran K. Hansson[J]. Vascul Pharmacol, 2012, 56(1-2): 29-33.
[3] Hansson GK. Inflammation and immune response in atherosclerosis[J]. Curr Atheroscler Rep, 1999, 1(2): 150-155.
[4] Bertoluci MC, Cé GV, da Silva AM, et al. Endothelial dysfunction as a predictor of cardiovascular disease in type 1 diabetes[J]. World J Diabetes, 2015, 6(5): 679-692.
[5] Fu XH, Wang L, Zhao H, et al. Synthesis of genistein derivatives and determination of their protective effects against vascular endothelial cell damages caused by hydrogen peroxide[J]. Bioorg Med Chem Lett, 2008,18(2): 513-517.
[6] 李丹, 李玉洁, 杨庆, 等. 血管内皮功能障碍与动脉粥样硬化研究进展[J]. 中国实验方剂学杂志, 2012(08): 272-276.
[7] Gargiulo S, Gamba P, Testa G, et al. Relation between TLR4/NF-κB signaling pathway activation by 27-hydroxycholesterol and 4-hydroxynonenal, and atherosclerotic plaque instability[J]. Aging Cell,2015, 14(4): 569-581.
[8] Scholtes VP, Versteeg D, de Vries JP, et al. Toll-like receptor 2 and 4 stimulation elicits an enhanced inflammatory response in human obese patients with atherosclerosis[J]. Clin Sci (Lond), 2011, 121(5):205-214.
[9] 耿红莲, 屠小卿, 朱烨, 等. 动脉粥样硬化相关自身抗体的检测及临床意义[J]. 中华检验医学杂志, 2004, 27(2): 82-84.
[10] 盛富强, 程龙献. TLR4信号通路与动脉粥样硬化的研究进展[J].心脏杂志, 2009(04): 572-574.
[11] Zhao H, Li C, Cao JG, et al. 7-Difluoromethyl-5, 4'-dimethoxygenistein,a novel genistein derivative, has therapeutic effects on atherosclerosis in a rabbit model[J]. J Cardiovasc Pharmacol, 2009, 54(5): 412-420.
[12] Medzhitov R, Preston-Hurlburt P, Janeway CA Jr. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity[J]. Nature, 1997, 388(6640): 394-397.
[13] Shinohara M, Hirata K, Yamashita T, et al. Local Overexpression of Toll-Like Receptors at the Vessel Wall Induces Atherosclerotic Lesion Formation[J]. Arterioscler Thromb Vasc Biol, 2007, 27(11): 2384-2391
[14] Dijsselbloem N, Goriely S, Albarani V, et al. A critical role for p53 in the control of NF-κB-dependent gene expression in TLR4-stimulated dendritic cells exposed to Genistein[J]. J Immunol, 2007, 178(8):5048-5057.
[15] Zhou X, Yuan L, Zhao X, et al. , Genistein antagonizes inflammatory damage induced by β-amyloid peptide in microglia through TLR4 and NF-κB[J]. Nutrition, 2014, 30(1): 90-95.
[16] Zhang Y, Li L, You J, et al. Effect of 7-difluoromethyl-5, 4'-dimethoxygenistein on aorta atherosclerosis in hyperlipidemia ApoE(-/-)mice induced by a cholesterol-rich diet[J]. Drug Des Devel Ther, 2013,7: 233-242.
DFMG Inhibited Proliferation and Migration of Smooth Muscle Cells Stimulated by LPCInduced Injured Endothelial Cells through Depressing TLR4
Huang He, Zhang Yong, Yang Shu-ting, Fu Xiao-hua
(Department of Cardiovascular disease, Medicine College, Hunan Normal University, Changsha 410006, China)
Objective To observe the effect of 7-Difluoromethyl-5,4’-dimethoxygenistein (DFMG) on the proliferation and migration of vascular smooth muscle cells(VSMCs) stimulated by LPC-induced injured vascular endothelial cells(VECs),and whether the intervention process of DFMG is related to the TLR4. Methods The proliferation and migration of VSMCs was detected by CCK-8 assay and Transwell-migration method. The TLR4 protein and gene expression of VECs was detected by western blot and fluorescence quantitative PCR. Using TLR4 specific agonist (LPS) and specific inhibitor (CLI095), the proliferation and migration ability of VSMCs was analysed by CCK-8 assay and Transwell-migration method. Results The injured VECs induced by LPC caused the proliferation and migration of VSMCs, and VSMCs cocultured with VECs induced by 30 μM LPC became the injured coculture model of the following experiment. TLR4 protein expression of the injured VECs in the injured coculture model was 2.3 times as much as that of the normal VECs in the normal coculture model; TLR4 gene expression of the injured VECs in the injured coculture model was 2.4 times as much as that of the normal VECs in the normal coculture model. The proliferation and migration capacity of the injured group and the agonist group were stronger than that of the normal group. In addition, the proliferation and migration capacity of the inhibitor group and the DFMG-treated group were weaker than that of the injured group. Conclusion The injured VECs induced by LPC caused the proliferation and migration of VSMCs, and DFMG inhibited proliferation and migration of VSMCs in the LPC-induced injured VECs-VSMCs cocultured model by depressing TLR4.
TLR4; DFMG; VECs; VSMCs; Proliferation; Migration; Co-culture
R363
A
1673-016X(2016)01-0001-05
2015-11-13
国家自然科学基金资助项目(81370382);湖南省自然科学基金项目(14JJ2059)
符晓华,E-mail:fuxh1@126.com
